 |
Главная |
Энтальпия продуктов сгорания
|
из
5.00
|
При проведении конструкторских и поверочных расчетов котельных агрегатов, а также при обработке результатов испытаний необходимо знать энтальпии продуктов сгорания. Так как теплоемкости газов различны, то энтальпии компонентов дымовых газов следует подсчитывать отдельно.
Энтальпия теоретического объема газов при температуре  подсчитывается по формуле:
подсчитывается по формуле:

Энтальпия продуктов сгорания при  будет больше
будет больше  :
:

Из-за малости величин  при расчетах ими пренебрегают и формула для определения энтальпии продуктов сгорания при
при расчетах ими пренебрегают и формула для определения энтальпии продуктов сгорания при  выглядит следующим образом:
выглядит следующим образом:

ОСНОВЫ ТЕОРИИ ГОРЕНИЯ
Химические реакции взаимодействия веществ подчиняются закону действующих масс, который формулируется следующим образом: при постоянной температуре скорость реакции в гомогенной системе (т. е. системе, состоящей из веществ в одинаковом агрегатном состоянии) пропорциональна произведению концентраций реагирующих веществ. В общем случае для реакции типа

скорость прямой реакции

скорость обратной реакции

где  – концентрации реагирующих веществ;
– концентрации реагирующих веществ;
m, n, p, q – число молей реагирующих веществ;
 – константы скорости прямой и обратной реакции.
– константы скорости прямой и обратной реакции.
В топках котельных агрегатов реакции окисления горючих веществ идут практически только в прямом направлении. Скорости обратных реакций разложения – диссоциации продуктов сгорания при топочных температурах (1600–18000С и ниже) весьма малы. Так, например, степень диссоциации водяных паров в этих условиях составляет не более 1–3%.
Зависимость скорости химической реакции  от температуры тождественна зависимости от температуры константы скорости реакции К.
от температуры тождественна зависимости от температуры константы скорости реакции К.
Температурная зависимость константы скорости реакции носит название закона Аррениуса:

где К0 – предэкспоненциальный множитель;
Е – энергия активации, равная суммарной энергии атомов или молекул, вступающих в химическую реакцию, ккал/моль;
R – универсальная газовая постоянная, равная 1,986 ккал/моль·град;
Т – температура реагирующих веществ, °К.
Предэкспоненциальный множитель К0 в статической физике трактуется как характеристика полного числа столкновений молекул.
Величина его увеличивается с повышением температуры не сильно:

Множитель  зависит от температуры Ти величины Е, носящей название энергии активации.Величина этого множителя изменяется от 0(при Е = ∞ или T =0)до 1(при E = 0 или Т = ∞).При данных значениях Ти Емножитель
зависит от температуры Ти величины Е, носящей название энергии активации.Величина этого множителя изменяется от 0(при Е = ∞ или T =0)до 1(при E = 0 или Т = ∞).При данных значениях Ти Емножитель  с точки зрения статической физики рассматривается как доля общего числа столкновений молекул, обладающих энергией, равной или большей, чем энергия активации Е.
с точки зрения статической физики рассматривается как доля общего числа столкновений молекул, обладающих энергией, равной или большей, чем энергия активации Е.
Следовательно, не все столкновения молекул реагирующих веществ приводят к химическому взаимодействию.
Для протекания химической реакции необходимо, чтобы молекулы обладали некоторым запасом энергии, достаточным для преодоления атомарных связей в реагирующих молекулах. Так, например, для системы с начальной энергией молекул Е0, соответствующей точке А, (рис. 4.1) для осуществления химической реакции необходимо увеличить энергию до Е1– энергии активации реагирующих молекул (точка В). Конечные продукты реакции (точка С) будет обладать энергией Е2. Тепловой эффект этой прямой реакции будет положительным, т.е. произойдет освобождение энергии в количестве  (реакция экзотермическая).
(реакция экзотермическая).

Рис. 4.1. Прямая и обратная химические реакции
Для протекания обратной реакции начальная энергия системы в точке С–Е2 должна быть увеличена до энергии активации Е1. Так как продукты этой реакции (точка А) будут иметь энергию Е0, то тепловой эффект реакции будет отрицательным, т. е. для осуществления обратной реакции необходимо затратить энергию в размере Q = Eq – Е2 (реакция эндотермическая). Таким образом, энергию активации можно рассматривать как некоторую величину энергии, которой должны обладать молекулы реагирующих веществ, чтобы вступить во взаимодействие.
Экспериментальные исследования показали, что для некоторых реакций, и в частности реакций горения, наблюдается несоответствие между действительными скоростями реакций и расчитанными по стехиометрическим равенствам согласно законам кинетики химических реакций. Это свидетельствует о том, что механизм этих реакций не отвечает стехиометрическим уравнениям; последние дают лишь итоговый материальный баланс реагирующих веществ и конечных продуктов реакций.
Реакции горения газов относятся к цепным реакциям. Они характеризуются наличием промежуточных стадий с участием свободных атомов или неустойчивых соединений, для которых требуется меньшая энергия активации, т. е. так называемых активных молекул.
Цепные реакции, протекающие с неизменным числом активных молекул, продолжающих начатую цепь, называются неразветвленными. между действительными скоростями реакций и расчетными по стехиометрическим равенствам согласно законам кинетики химических реакций. Это свидетельствует о том, что механизм этих реакций не отвечает стехиометрическим уравнениям; последние дают лишь итоговый материальный баланс реагирующих веществ и конечных продуктов реакций.
Реакции горения газов относятся к цепным реакциям. Они характеризуются наличием промежуточных стадий с участием свободных атомов или неустойчивых соединений, для которых требуется меньшая энергия активации, т. е. так называемых активных молекул.
Цепные реакции, протекающие с неизменным числом активных молекул, продолжающих начатую цепь, называются неразветвленными. Если же в процессе реакций число активных молекул увеличивается и вновь возникающие активные молекулы образуют новые цепи, то такие цепные реакции носят название разветвленных.
Процессы горения водорода, окиси углерода и углеводородов являются разветвленными цепными реакциями.
Время сгорания определяется не только скоростью химической реакции  , но и временем, затрачиваемым на создание контакта горючего вещества с окислителем
, но и временем, затрачиваемым на создание контакта горючего вещества с окислителем  :
:

В гомогенной системе  –время на смесеобразование горючего с окислителем, а в гетерогенной (т. е. системе, состоящей из веществ разных агрегатных состояний)
–время на смесеобразование горючего с окислителем, а в гетерогенной (т. е. системе, состоящей из веществ разных агрегатных состояний)  – время диффузии окислителя к поверхности горения.
– время диффузии окислителя к поверхности горения.
Если  существенно меньше
существенно меньше  ,то полное время сгорания определяется только скоростью химических реакций (т. е. кинетикой процесса)
,то полное время сгорания определяется только скоростью химических реакций (т. е. кинетикой процесса)  и процесс протекает в кинетической области горения. Если
и процесс протекает в кинетической области горения. Если  , то полное время сгорания то полное время сгорания определяется скоростью диффузии окислителя к поверхности горючего вещества или временем смесеобразования гомогенной смеси горючего и окислителя
, то полное время сгорания то полное время сгорания определяется скоростью диффузии окислителя к поверхности горючего вещества или временем смесеобразования гомогенной смеси горючего и окислителя  и процесс протекает в д иффузионной области горения.
и процесс протекает в д иффузионной области горения.
Между кинетической и диффузионной существует промежуточная диффузионно-кинетическая область горения, в которой протекание химических реакций по времени соизмеримо со смесеобразованием или диффузией окислителя к поверхности горючего, т. е.  .
.
В процессе горения твердого топлива помимо гетерогенных реакций, существенную роль играют и гомогенные реакции. Гетерогенные реакции, протекающие на поверхности углерода, приводят к образованию окиси углерода СО и углекислоты СО2:
С+02→2СО;
С+02→С02.
Соотношение образующихся объемов СО и СО2 – продуктов этих первичных реакций – зависит от температурных условий процесса. При температурах до 12000С, по-видимому они образуются примерно в одинаковых количествах, с повышением температуры доля СО возрастает.
В камерных топках процесс химического взаимодействия горючих соединений с кислородом, в результате которого происходит выделение тепла, всегда сопровождается параллельно с ним идущим процессом поглощения тепла ограждающими поверхностями.
Количество тепла, выделяющееся при химической реакции, пропорционально скорости реакции; следовательно, зависимость тепловыделения при горении от температуры тоже экспоненциальная.
Теплопоглощение ограждающими поверхностями может быть выражено уравнением

где  – коэффициент теплоотдачи;
– коэффициент теплоотдачи;
F – площадь ограждающих поверхностей;
Т – средняя температура реагирующей смеси;
 – средняя температура тепловоспринимающих поверхностей.
– средняя температура тепловоспринимающих поверхностей.
Графическое изображение зависимостей тепловыделения и теплопоглощения от температуры дано на рис. 4.2.
Рис. 4.2. Кривые тепловыделения и теплопоглощения.
При низкой начальной температуре смеси, когда скорости химических реакций малы, тепловыделение Qв незначительно превышает теплопоглощение Qn(QB > Qn).Точка А на рисунке отвечает равенству; QB = Qn; это устойчивое состояние системы характеризуетсявесьма малыми скоростями химических реакций, при которых протекают процессы медленного окисления горючих соединений. Повышение температуры смеси выше Т1 невозможно, так как при этом тепловыделение будет меньше теплопоглощения (QB < Qn).
Если повысить начальную температуру смеси, кривая теплопоглощения становится касательной к кривой тепловыделения; в точке касания В QB = Qn. Дальнейшее ускорение реакции приводит к быстрому повышению температуры и самовоспламенению,
так как при этом QB > Qn.
Температура, соответствующая точке Вна рисунке, т. е. отвечающая равенству тепловыделения и теплопоглощения, называется температурой воспламенения.
Таким образом, температура воспламенения не является физической константой. Она зависит от природы и состава горючей смеси и интенсивности теплообмена в зоне воспламенения.
В технических устройствах зажигание топлива производят путем подвода тепла от постороннего источника. Образующийся фронт пламени представляет собой очень тонкий слой смеси, в котором происходит горение.
Скорость перемещения отдельного элемента фронта горения в направлении, перпендикулярном к поверхности фронта пламени, носящая название нормальной скорости распространения пламени, определяется главным образом скоростью химических реакций горения. Следовательно, она зависит от природы соединения, состава горючей смеси и температуры горения.
Для каждого соединения характерны свои нижние и верхние пределы концентраций в смеси с воздухом, вне которых процесс поддержания горения невозможен: при концентрациях горючего соединения меньше нижнего предела смесь забалластирована избыточным воздухом, больше верхнего предела — в смеси содержится излишнее количество горючего соединения. В обоих случаях расходы тепла на прогрев этих смесей превышают тепловыделение.
Фронт пламени является границей между слабо нагретой горючей смесью и продуктами сгорания, имеющими высокую температуру. От фронта пламени тепло передается близлежащим слоям, еще не достигшим температуры воспламенения путем теплопроводности и за счет диффузии высоконагретых продуктов сгорания. Поэтому скорость распространения пламени может быть значительно повышена турбулизацией потока.
5. ТЕПЛОВОЙ БАЛАНС И К.П.Д. КОТЕЛЬНОГО АГРЕГАТА
5.1. Располагаемое тепло.
Эффективность использования топлива в котельном агрегате определяется в основном двумя факторами: полнотой процесса сгорания топлива и глубиной охлаждения продуктов сгорания.
Большая часть тепла, вносимого в котельный агрегат, воспринимается поверхностями нагрева и передается рабочему телу. За счет этого тепла производятся подогрев воды до температуры кипения, ее испарение и перегрев пара. Это — полезно используемое тепло.
Остальное тепло составляющее в современных котлоагрегатах примерно 8–12%, не используется для получения пара. Это происходит вследствие различного рода потерь тепла, сопутствующих работе котельного агрегата.
Распределение вносимого в котельный агрегат тепла на полезно используемое и отдельные потери производится путем составления теплового баланса (рис. 5.1.1.).

Рис. 5.1.1. Тепловой баланс котла
В общем виде уравнение теплового баланса котельного агрегата при установившемся режиме работы записывается следующим образом:
 кДж/кг, кДж/м3,
кДж/кг, кДж/м3,
где  располагаемое тепло на 1кг рабочего топлива твердого или жидкого или на 1м3 сухого газообразного топлива,
располагаемое тепло на 1кг рабочего топлива твердого или жидкого или на 1м3 сухого газообразного топлива,
 полезно используемое тепло,
полезно используемое тепло,
 потеря тепла с уходящими газами,
потеря тепла с уходящими газами,

 потеря тепла от химической неполноты сгорания топлива,
потеря тепла от химической неполноты сгорания топлива,
 потеря тепла от механической неполноты сгорания топлива,
потеря тепла от механической неполноты сгорания топлива,
 потеря тепла от наружного охлаждения котельного агрегата,
потеря тепла от наружного охлаждения котельного агрегата,
 потеря с физическим теплом шлаков.
потеря с физическим теплом шлаков.
Уравнение теплового баланса может быть выражено в процентах по отношению к величине располагаемого тепла:
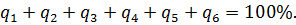
Отношение полезно использованного тепла к располагаемому есть коэффициент полезного действия котельного агрегата (рассчитанный по прямому балансу):

Коэффициент полезного действия котельного агрегата может быть рассчитан по обратному балансу, т.е.

Коэффициент полезного действия котельного агрегата с учетом расхода электроэнергии и тепла на собственные нужды называют к.п.д. нетто:

где  суммарный расход энергии, °/0, на электрические двигатели, которые обслуживают работу котельного агрегата, расход тепла в виде пара на обдувку, потери с утечками и продувочной водой, отнесенные к располагаемому теплу.
суммарный расход энергии, °/0, на электрические двигатели, которые обслуживают работу котельного агрегата, расход тепла в виде пара на обдувку, потери с утечками и продувочной водой, отнесенные к располагаемому теплу.
Располагаемое тепло котельного агрегата  может быть представлено следующим уравнением:
может быть представлено следующим уравнением:

где  — низшая теплота сгорания топлива,
— низшая теплота сгорания топлива,
 — физическое тепло топлива,
— физическое тепло топлива,
 — тепло воздуха при подогреве его вне котельного агрегата,
— тепло воздуха при подогреве его вне котельного агрегата,
 — тепло, вносимое паром, употребляемым для распыливания мазута,
— тепло, вносимое паром, употребляемым для распыливания мазута,
 — тепло, расходуемое при сжигании сланцев на разложение карбонатов.
— тепло, расходуемое при сжигании сланцев на разложение карбонатов.
Физическое тепло топлива равно:
Qтл = стлtтл, кДж/кг, кДж/м3,
где стл— теплоемкость рабочей массы топлива,
tтл — температура топлива, °С.
Для твердых топлив  в большинстве случаев невелико. При замкнутой схеме сушки топлива температуру tтлпринимают близкой к температуре окружающей среды (в среднем 20°С). Только при применении разомкнутых схем пылеприготовления температура пыли берется из расчета сушки (она составляет примерно 60–70°С).
в большинстве случаев невелико. При замкнутой схеме сушки топлива температуру tтлпринимают близкой к температуре окружающей среды (в среднем 20°С). Только при применении разомкнутых схем пылеприготовления температура пыли берется из расчета сушки (она составляет примерно 60–70°С).
При работе котельных агрегатов на сернистом мазуте или твердых топливах с большим содержанием серы иногда воздух перед воздухоподогревателем предварительно нагревают в специальных устройствах – калориферах. Количество тепла, вносимое воздухом в котельный агрегат, рассчитывают тогда по формуле:

здесь  – отношение количества воздуха на входе в котельный агрегат к теоретически необходимому;
– отношение количества воздуха на входе в котельный агрегат к теоретически необходимому;
 и
и  — энтальпия теоретически необходимого количества воздуха на входе в котельный агрегат и холодного воздуха.
— энтальпия теоретически необходимого количества воздуха на входе в котельный агрегат и холодного воздуха.
Количество тепла, которое вводится в котельный агрегат с паром, используемым для распыливания мазута, подсчитывают по формуле:

где  – расход пара, идущего на распыливание мазута, кг\кг,
– расход пара, идущего на распыливание мазута, кг\кг,
 – энтальпия этого пара, кДж/кг;
– энтальпия этого пара, кДж/кг;
2500 кДж/кг – условно принимаемая величина энтальпии пара, содержащегося в уходящих газах.
При сжигании сланцев небольшая часть выделяющегося в топке тепла расходуется на разложение карбонатов. Эта затрата тепла пропорциональна содержанию карбонатов в сланцах:
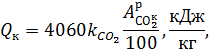
где  — содержание углекислоты карбонатов в рабочей массе сланцев, °/0;
— содержание углекислоты карбонатов в рабочей массе сланцев, °/0;
 — степень разложения карбонатов;
— степень разложения карбонатов;
4060 кДж/кг – средний расход тепла на разложение карбонатов, отнесенный к одному килограмму углекислоты.
Для котельных агрегатов, работающих на твердых топливах (кроме сланцев) при отсутствии подогрева воздуха вне котла, располагаемое тепло близко по своей величине к теплоте сгорания топлива, т. е.

Полезно использованное тепло в котельном агрегате в самом общем случае может быть подсчитано по следующей формуле:

где D – паропроизводительность котла, кг/c;
 – расход продувочной воды, кг/c;
– расход продувочной воды, кг/c;
B – секундный расход топлива;
 – энтальпии, соответственно, пара, котловой воды, питательной воды,
– энтальпии, соответственно, пара, котловой воды, питательной воды, 
Тепло, полезно отданное в котле, определяется в общем случае из выражения:
 кВт,
кВт,
где  – количество выработанного перегретого пара, кг/с;
– количество выработанного перегретого пара, кг/с;
 – энтальпия перегретого пара, кДж/кг, определяемая по
– энтальпия перегретого пара, кДж/кг, определяемая по  и
и  согласно заданию;
согласно заданию;
 – энтальпия питательной воды, кДж/кг, определяемая по рпв и tпв;
– энтальпия питательной воды, кДж/кг, определяемая по рпв и tпв;
 – количество выработанного насыщенного пара, кг/с, отданного помимо пароперегревателя с энтальпией hнп;
– количество выработанного насыщенного пара, кг/с, отданного помимо пароперегревателя с энтальпией hнп;
 – энтальпия насыщенного пара, кДж/кг, определяемая по давлению в барабане котла;
– энтальпия насыщенного пара, кДж/кг, определяемая по давлению в барабане котла;
 – расход воды на продувку котла, кг/с, с энтальпией при ее кипении hкип, кДж/кг, определяемой по давлению в барабане котла
– расход воды на продувку котла, кг/с, с энтальпией при ее кипении hкип, кДж/кг, определяемой по давлению в барабане котла  =
=  ,
,
где П – процент продувки, %; D – производительность котла, кг/с; значение П определяется заданием на проектирование.
Примечания:
а) если по заданию пар перегретый, отсутствует вторая составляющая  в формуле;
в формуле;
б) если по заданию пар насыщенный, отсутствует первая составляющая  .в формуле.
.в формуле.
Расход топлива, подаваемого в топку, определяется по формуле
 ,
,
в которой hк.а. выражается в процентах.
 – тепло, внесенное поступающим в котельный агрегат воздухом, при подогреве последнего вне агрегата отборным паром, отработанным теплом и т.п. подсчитывается по формуле:
– тепло, внесенное поступающим в котельный агрегат воздухом, при подогреве последнего вне агрегата отборным паром, отработанным теплом и т.п. подсчитывается по формуле:
 =
=  [
[  –
–  ], кДж/кг или кДж/м3,
], кДж/кг или кДж/м3,
где  – отношение количества воздуха на входе в котел (в воздухоподогреватель) к теоретически необходимому;
– отношение количества воздуха на входе в котел (в воздухоподогреватель) к теоретически необходимому;  и
и  – энтальпии теоретически необходимого количества воздуха на входе в котельный агрегат и холодного воздуха, которые определяются по Н-u таблице, кДж/кг или кДж/м3.
– энтальпии теоретически необходимого количества воздуха на входе в котельный агрегат и холодного воздуха, которые определяются по Н-u таблице, кДж/кг или кДж/м3.
При отсутствии специальных указаний температура воздуха поступающего в котел, принимается равной 30°С.
Тепло, вносимое в агрегат паровым дутьем ("форсуночным" паром),  определяется по формуле
определяется по формуле
 кДж/кг,
кДж/кг,
где  и
и  – расход и энтальпия пара, идущего на распыливание топлива, кг/кг и кДж/кг.
– расход и энтальпия пара, идущего на распыливание топлива, кг/кг и кДж/кг.
Для подсчета суммарных объемов продуктов сгорания, воздуха и теплоты, отданной газами в поверхностях нагрева, вводится расчетный расход топлива, вычисляемый с учетом механической неполноты сгорания q4 по формуле
 , (м3/с ) (кг/с)
, (м3/с ) (кг/с)
При сжигании газообразного и жидкого топлив q4 = 0 и значение Вр = В (м3/с), (кг/с)
5.2. Потери тепла с уходящими газами.
В тепловом балансе котельного агрегата наибольшей является потеря тепла с уходящими газами  . Величина ее составляет
. Величина ее составляет
4–8%располагаемого тепла. Относительная потеря тепла с уходящими газами равна:

абсолютная

где  – энтальпия уходящих газов;
– энтальпия уходящих газов;
 – энтальпия холодного воздуха;
– энтальпия холодного воздуха;
 – потеря тепла от механической неполноты сгорания.
– потеря тепла от механической неполноты сгорания.
С повышением температуры уходящих газов потери тепла увеличиваются. При росте  на 12-16°С
на 12-16°С  повышается примерно на 1%. Поэтому желательно иметь возможно более низкую температуру дымовых газов, покидающих котельный агрегат.
повышается примерно на 1%. Поэтому желательно иметь возможно более низкую температуру дымовых газов, покидающих котельный агрегат.
Однако глубокое охлаждение газов требует больших поверхностей нагрева, которые в свою очередь обусловливают значительное гидравлическое сопротивление газоходов.
Оптимальные значения температуры уходящих газов для различных топлив устанавливаются на основании технико-экономических расчетов, сравнивающих стоимость дополнительных поверхностей нагрева и увеличение затрат на собственные нужды котельных агрегатов с получаемой экономией топлива.
5.3. Потери тепла от химической неполноты сгорания топлива.
Процесс сжигания топлива не всегда идет полностью до образования продуктов полного сгорания: СО2, SO2 и Н2О. Иногда в дымовых газах содержатся и продукты неполного горения: СО, Н2, СН4; тяжелые углеводороды.
Тепло, которое осталось химически связанным в недогоревших; газах, сохранившихся всмеси с продуктами полного сгорания топлива,не используется в котельном агрегате и составляет потерю от химической неполноты сгорания. Эта потеря может быть выражена впроцентах от располагаемого тепла:

В топочных камерах при сжигании всех видов топлива величина  обычно не превышает 0,5%.
обычно не превышает 0,5%.
Потерю тепла от химической неполноты сгорания топлива при работе котельного агрегата рассчитывают на основании данных полного газового анализа продуктов сгорания по формуле:
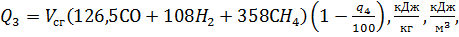
где – 
 – соответственно содержание окиси углерода, водорода, метана в продуктах сгорания,%;
– соответственно содержание окиси углерода, водорода, метана в продуктах сгорания,%;
 – объем сухих газов,
– объем сухих газов,  .
.
5.4. Потери тепла от механической неполноты сгорания топлива.
Топливо, поступающее в топку, сгорает не полностью. Некоторое количество твердого топлива уносится продуктами сгорания в газоходы котла или остается недогоревшимв шлаке.
Механическая неполнота сгорания сопутствует сжиганию также жидких и газообразных топлив. Тяжелые углеводороды, содержащиеся в них, подвергаясь разложению, выделяют значительные количества свободного углерода в виде сажи. Особенно сильное сажеобразование наблюдается при горении вязких мазутов.
Тепло, содержащееся в твердых частицах топлива, унесенных дымовыми газами или удаленных из топки вместе со шлаком, не используется в котельном агрегате и составляет потерю от механической неполноты сгорания.
Она можете быть выражена в процентах от располагаемого тепла:
 .
.
Для топочных камер потери тепла с механической неполнотой сгорания топлива слагаются из потерь тепла за счет недожога горючих соединений в шлаке  уносе
уносе  и провале
и провале  .
.
|
из
5.00
|
Обсуждение в статье: Энтальпия продуктов сгорания |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

