 |
Главная |
Распределение Максвелла-Больцмана
|
из
5.00
|
Полученные в предыдущих параграфах распределения Больцмана (5.23) и Максвелла (5.62)описывают зависимость концентрации молекул от координат  и функцию распределения по скоростям и функцию распределения по скоростям  соответственно. При этом распределение Больцмана описывается в пространстве координат соответственно. При этом распределение Больцмана описывается в пространстве координат  , ,  и и  , а распределение Максвелла в пространстве скоростей , а распределение Максвелла в пространстве скоростей  , ,  и и  .
Если ввести 6-мерное пространство, координатами молекулы в котором являются величины .
Если ввести 6-мерное пространство, координатами молекулы в котором являются величины  , ,  , ,  , ,  , ,  и и  , то функция распределения в таком пространстве будет зависеть от этих шести переменных: , то функция распределения в таком пространстве будет зависеть от этих шести переменных:  . Считая пространственные переменные . Считая пространственные переменные  , ,  , ,  и компоненты скорости и компоненты скорости  , ,  , ,  статистически независимыми друг от друга, на основании формулы (5.10) можно записать: статистически независимыми друг от друга, на основании формулы (5.10) можно записать:
Или
где выражение для кинетической энергии имеет вид:
Формула (5.77) называется функцией распределения Максвелла-Больцмана. Она может быть использована в случае, когда полная энергия молекулы При получении закона распределения Максвелла-Больцмана предполагалось, что температура газа не зависит от координаты точки. В частности, температура газа на всех высотах над поверхностью Земли при термодинамическом равновесии должна быть одинакова. С этим утверждением связан парадокс, всесторонне рассмотренный Максвеллом. Дело в том, что при движении вверх молекулы газа должны затрачивать свою кинетическую энергию на преодоление силы тяжести, и поэтому их средняя кинетическая энергия (а следовательно и температура) должна уменьшаться. Но этого не происходит вследствие того, что при этом не все молекулы, из-за недостатка их кинетической энергии, смогут преодолеть силу тяжести. Молекулы, имеющие недостаточную кинетическую энергию, не могут подняться высоко, что приведет, в соответствии с распределением Больцмана, к уменьшению их концентрации с высотой. Поэтому температура газа останется неизменной. Функция распределения в более общем случае, когда кинетическая энергия зависит только от скорости
где постоянная
Здесь: Формула (5.79) позволяет описывать равновесное распределение для достаточно произвольной термодинамической системы. Полученные выше функции распределения описывают случай, когда полная энергия частицы
где величина
Если полное число частиц в системе равно
Формула (5.81) называется распределением Больцмана для дискретных состояний. |
Опыт Перрена
В 1908 г. французский физик Жан Батист Перрен ставит эксперимент, результаты которого должны были стать прямым подтверждением статистической теории броуновского движения Эйнштейна–Смолуховского.
Истинность этой теории Перрен проверил, исследуя распределение частиц эмульсии по высоте. В основу экспериментальной работы Перрена легли результаты исследования Л. Больцмана. В 1876 г. немецкий физик Людвиг Больцман (1844–1906), убежденный сторонник молекулярного учения о строении вещества, открыл закон распределения молекул атмосферного воздуха в поле тяготения (рис. 2). В математической формулировке этот закон имел следующий вид:
|

|
| Рис. 2. Распределение молекул различных газов в воздухе в поле тяжести согласно закону Больцмана |
Ж. Б. Перрен применил эту формулу для исследования распределения броуновских частиц с высотой. Он предположил, что систему из броуновских частиц можно рассматривать в качестве модели молекулярно-кинетической структуры газа. Интересны рассуждения ученого по этому поводу: «Молекула сахара, содержащая 45 атомов, и молекула сульфата хинина, содержащая свыше 100 атомов, играют в растворе не большую и не меньшую роль, чем какая-нибудь молекула воды, содержащая всего лишь 3 атома. А раз так, то нельзя ли предположить, что не существует предельного размера частиц, для которых справедливы эти законы? Разве нельзя предположить, что даже видимые частицы и те подчиняются этим законам… Частица, совершающая броуновское движение, играет не большую и не меньшую роль, чем обычная молекула в процессе соударения со стенками сосуда. Короче говоря, разве нельзя предположить, что законы газов применимы также и к эмульсиям, состоящим из видимых частиц? ».
Действительно, например, молекулы кислорода и азота в воздухе, двигаясь в среднем со скоростью примерно 500 м/с, испытывают каждую секунду более миллиарда столкновений. Поэтому путь молекулы, как и броуновской частицы, тоже представляет собой сложную ломаную линию. И если бы можно было зарисовать траекторию движения молекулы, она принципиально ничем бы не отличалась от траектории движения броуновской частицы. Различие состоит лишь в том, что молекулы в газах движутся по прямой, пока не столкнутся с другими молекулами, после чего они резко меняют направление своего движения (см. модель 1). Броуновская же частица, в отличие от молекулы, не совершает свободного движения, а испытывает частые столкновения, в результате которых она беспорядочно смещается то в одну, то в другую сторону(см. модель 2). Интересно представить себе пространственно-временные масштабы этого движения. Как показывают расчеты, для броуновской частицы размером 0,1 мкм одно перемещение происходит за три миллиардные доли секунды на расстояние всего 0,5 нм (1 нм = 0,001 мкм).
Билет№35
Молекулярное движение –постоянное, хаотичное и непрерывное перемещение частиц вещества.
|
из
5.00
|
Обсуждение в статье: Распределение Максвелла-Больцмана |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы


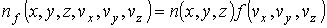
 ,
,
 .
.
 равна сумме её потенциальной энергий
равна сумме её потенциальной энергий  во внешнем силовом поле и кинетической энергии
во внешнем силовом поле и кинетической энергии  её поступательного движения:
её поступательного движения:  .
. , а потенциальная - только от радиус-вектора
, а потенциальная - только от радиус-вектора  микрочастицы, имеет вид:
микрочастицы, имеет вид: ,
,
 определяется из условия нормировки (5.5):
определяется из условия нормировки (5.5):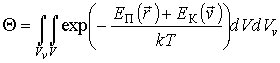 .
.
 - объем, занимаемый системой в координатном пространстве,
- объем, занимаемый системой в координатном пространстве,  - соответствующий объем в пространстве скоростей.
- соответствующий объем в пространстве скоростей. , необходимо использовать вместо функции распределения вероятность нахождения частицы в состоянии со значением энергии
, необходимо использовать вместо функции распределения вероятность нахождения частицы в состоянии со значением энергии  :
:  . В случае дискретных состояний можно записать следующее выражение для этой вероятности
. В случае дискретных состояний можно записать следующее выражение для этой вероятности  ,
,
 .
.
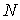 , то число частиц
, то число частиц 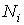 в состоянии с энергией
в состоянии с энергией  .
.
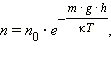 или
или 