 |
Главная |
Окислительно-восстановительные реакции
|
из
5.00
|
1. Какие реакции принадлежат к окислительно-восстановительным?
________________
2. Составьте электронные уравнения полуреакций окисления и восстановление процессов, которые отвечают таким химическим реакциям:
KMnО4 + HI ® Mn2 + I2 +KI + H2O;
________________
Zn + HNO3(конц.) ® Zn(NO3)2 + NO2 + H2O.
________________
Расставьте коэффициенты в приведенных реакциях.
3. Закончите уравнение реакции, составьте ионные уравнения реакций и расставьте коэффициенты:
FeSO4 + KMnО4 + H2SO4 ® MnSO4 + Fe2(SO4)3 +…
________________________________
K2Cr2O7 + HCl ® CrCl3+Cl2 +…
________________________________
Оценка домашней работы ______________ Подпись преподавателя___________

Окислительно-восстановительными реакциями называются реакции, сопровождающиеся изменением степени окисления элементов вследствие смещения или полного перехода электронов от одних атомов или ионов к другим. Под степенью окисления понимают заряд атома элемента в соединении, вычисленный исходя из предположения, что вещество состоит из простых ионов. Следует, однако, иметь в виду, что понятие о степени окисления является формальным. Так, например, в растворе HNO3 нет иона пятивалентного азота, а есть ион NO  (содержащий азот в степени окисления +5).
(содержащий азот в степени окисления +5).
Окисление – процесс отдачи электронов атомом, молекулой или ионом; восстановление – процесс присоединения электронов атомом, ионом или молекулой. Окисление и восстановление – взаимосвязанные процессы, протекающие одновременно: окисление невозможно без одновременно протекающего с ним восстановления и наоборот.
Окислителями называются атомы, молекулы или ионы, принимающие электроны; восстановителями – атомы, молекулы или ионы, отдающие электроны.
Окислителями могут быть атомы и молекулы некоторых неметаллов (в первую очередь, галогенов и кислорода); сложные ионы и молекулы, содержащие атомы элементов в высшей или в одной из наиболее высоких степеней окисления 



 ,
,  и др; положительно заряженные ионы металлов (Fe3+, Au3+, Hg2+ и др.). Самый сильный окислитель – электрический ток (окисление происходит на аноде). В лаборатории в качестве окислителей чаще всего применяют: KМnO4, K2Cr2O7, HNO3, H2SO4 (конц.), Н2О2.
и др; положительно заряженные ионы металлов (Fe3+, Au3+, Hg2+ и др.). Самый сильный окислитель – электрический ток (окисление происходит на аноде). В лаборатории в качестве окислителей чаще всего применяют: KМnO4, K2Cr2O7, HNO3, H2SO4 (конц.), Н2О2.
Типичными восстановителями являются почти все металлы и многие неметаллы (С, Н2 и др.) в свободном состоянии; отрицательно заряженные ионы неметаллов (S2, I-, PH3 и др.); катионы, степень окисления которых может возрасти (Sn2+, Fe2+, Cu+ и др.); сложные ионы и молекулы, содержащие атомы в промежуточной степени окисления 

 и др.). В лаборатории в качестве восстановителей обычно применяются следующие кислоты: H2SO3, HI, H3PO3, H2S, HNO2 и их соли. Для проведения восстановления при высоких температурах часто используют С, СО, Н2.
и др.). В лаборатории в качестве восстановителей обычно применяются следующие кислоты: H2SO3, HI, H3PO3, H2S, HNO2 и их соли. Для проведения восстановления при высоких температурах часто используют С, СО, Н2.
Следует подчеркнуть, что соединения, содержащие элементы в максимальной и минимальной степенях окисления, могут быть соответственно или только окислителями 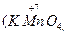


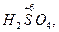
 , или только восстановителями
, или только восстановителями 

 Если же вещество содержит элемент в промежуточной степени окисления, то в зависимости от условий проведения реакции оно может быть и окислителем, и восстановителем. Так, нитрит калия, содержащий азот в степени окисления +3, в присутствии сильного окислителя, например бихромата калия, проявляет восстановительные свойства, окисляясь при этом до нитрита (степень окисления азота повышается до +5):
Если же вещество содержит элемент в промежуточной степени окисления, то в зависимости от условий проведения реакции оно может быть и окислителем, и восстановителем. Так, нитрит калия, содержащий азот в степени окисления +3, в присутствии сильного окислителя, например бихромата калия, проявляет восстановительные свойства, окисляясь при этом до нитрита (степень окисления азота повышается до +5):
 →
→ 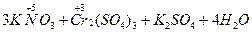 .
.
При взаимодействии с иодидом калия, который является восстановителем, нитрит калия, наоборот, проявляет окислительные свойства, при этом степень окисления азота понижается до +2 (образуется NO):
 →
→  .
.
Такая окислительно-восстановительная двойственность характерна также для 
 (и ее солей) и т.д.
(и ее солей) и т.д.
Следует иметь в виду, что характер многих окислительно-восстановительных реакций зависит от среды, в которой они протекают. Для создания кислой среды чаще всего используют разбавленную серную кислоту. Концентрированная серная кислота и азотная кислота любой концентрации сами являются окислителями, а концентрированная хлористоводородная кислота проявляет восстановительные свойства, поэтому использование для создания кислой среды H2SO4 (конц.), HNO3, HCl (конц.) может привести к протеканию побочных процессов. Для создания щелочной среды обычно используют растворы КОН или NaOH (при реакциях между расплавленными реагентами щелочная среда создается введением основных солей, Na2CO3 или К2СО3).
Для составления уравнения окислительно-восстановительной реакции надо знать, от каких атомов, молекул и ионов к каким атомам, молекулам и ионам переходят электроны и в каком количестве. Эти данные часто находят экспериментально.
При подборе стехиометрических коэффициентов в уравнениях окислительно-восстановительных реакций следует помнить, что число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем.
 Физические величины в химии
Физические величины в химии

 |
Традиционные названия кислот и их остатков
| Формулы кислот | Название кислоты | Кислотный остаток | Название кислотного остатка |
| HNO2 | азотистая | NO21- | нитрит |
| HNO3 | азотная | NO31- | нитрат |
| HBr | бромоводородная | Br1- | бромид |
| HJ | йодоводородная | J1- | йодид |
| HF | фтороводородная (плавиковая) | F1- | фторид |
| H2SiO3 | кремниевая | SiO32- | силикат |
| HMnO4 | марганцовая | MnO41- | перманганат |
| H2MnO4* | марганцовистая | MnO42- | манганат |
| H2SO4 | серная | SO42- HSO41- | сульфат гидросульфат |
| H2SO3 | сернистая | SO32- HSO31- | сульфит гидросульфит |
| H2S | сероводородная | S2- HS1- | сульфид гидросульфид |
| H2CO3 | угольная | CO32- HCO31- | карбонат гидрокарбонат (бикарбонат) |
| CH3COOH | уксусная | CH3COO1- | ацетат |
| H3PO4 | ортофосфорная | PO43- H2PO41- HPO42- | ортофосфат дигидрофосфат гидрофосфат |
| HPO3 | метафосфорная | PO31- | метафосфат |
| H3PO3 (H2HPO2) | ортофосфористая | HPO31- | фосфит |
| H3PO2 (HH2PO2) | фосфорноватистая | H2PO21- | гипофосфит |
| HCl | хлороводородная (соляная) | Cl1- | хлорид |
| HClO | хлорноватистая | ClO1- | гипохлорит |
| HClO2 | хлористая | ClO21- | хлорит |
| HClO3 | хлорноватая | ClO31- | хлорат (KClO3 – бертолетова соль) |
| HClO4 | хлорная | ClO41- | перхлорат |
| H2CrO4 | хромовая | CrO42- | хромат |
| H2Cr2O7* | двухромовая | Cr2O72- | бихромат |
| HCN | Циановодородная (синильная) | CN- | цианид |
* кислоты в свободном виде не известны. В скобках приведены тривиальные названия.
|
из
5.00
|
Обсуждение в статье: Окислительно-восстановительные реакции |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

