 |
Главная |
Образец билета тестированного контроля. по теме: Химическая термодинамика и термохимия
|
из
5.00
|
по теме: Химическая термодинамика и термохимия.
Вопросы: Ответы:
1. К каким химическим процессам применим а) изобарным;
закон Гесса? б) изотермическим;
в) изобарно-изотермическим.
2. Укажите правильное соотношение DH для а) DH2 < DH1 < DH3
(1) H2(г) + O(г) = H2O(г) б) DH2 > DH1 > DH3
(2) H2(г) + 0,5 O2(г) = H2O(г) в) DH1 > DH2 > DH3
(3) 2H(г) + O(г) = H2O(г)
| 3. В каком случае энтальпия реакции нейтрализации составляет -56,5 кДж/моль? а) при нейтрализации слабой кислоты сильным основанием; б) при нейтрализации слабой кислоты слабым основанием; в) при нейтрализации сильной кислоты сильным основанием. 4. Вычислите энтальпию реакции: CuS(тв) + 2O2(г) = CuSO4(тв), если DHf(CuS) = -48,5 кДж/моль; DHf(CuSO4) = -769,12 кДж/моль. а) -817,62 кДж; б) -720,62 кДж; в) 720,62 кДж. 5. Вычислите энтальпию фазового перехода Sаморф. ® Sкрист., если DHсгор. (Sкрист.) = -849,8 кДж/моль; DHсгор.(Sаморф.) = -866,5кДж/моль. а) 16,7 кДж; б) -16,7 кДж; в) 1716,3 кДж. 6. В каком из следующих случаев реакция возможна при любых температурах? а) DH < 0; DS > 0; б) DH > 0; DS > 0; в) DH < 0; DS < 0. |
Ответы на задания образца билета ТК:
| Номер вопроса | ||||||
| Код ответа | в | б | в | б | б | а |
ЗАНЯТИЕ 8.
Тема: Химическая кинетика и катализ.
Под скоростью химической реакции понимают изменение концентрации одного из участников реакции в единицу времени при неизменном объёме системы. При этом не важно о каком из участвующих в реакции веществ идет речь, так как все они связаны между собой уравнением реакции, а потому по изменению концентрации одного из веществ можно судить о соответствующих изменениях концентрации всех остальных. Концентрацию (С) выражают в
моль/л, а время (t) в секундах или минутах.
Средняя скорость реакции А + В = С + D равна 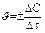 , где DC = C2 - C1, Dt = t2 - t1.
, где DC = C2 - C1, Dt = t2 - t1.
Знак минус ставится потому, что, несмотря на убывание концентрации одного из реагирующих веществ А или В и, следовательно, на отрицательное значение разности С2 - С1, С2 < С1, DС < О, скорость реакции может быть только положительной величиной. Если же следить за изменением концентрации одного из продуктов реакции С или D, то она в ходе реакции будет возрастать С2 > С1, DС > О, и поэтому в правой части приведенного уравнения надо ставить знак плюс.
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ (закон действующих масс):
u = k  C(A)
C(A)  C(B), где
C(B), где
С(А) и С(В) - молярные концентрации А и В, k - константа скорости реакции зависит от природы веществ и от температуры.
Для гомогенной реакции общего вида: а А + в В = с С + d D
u = k  Ca(A)
Ca(A)  Cb(B)
Cb(B)
Уравнение, связывающее скорость реакции с концентрацией реагирующих веществ, называют кинетическим уравнением реакции.
Для гетерогенной реакции вида: 1) А(г) + 2В(тв) = АВ2 (ж)
u = k.С(А)
2) А(г)+ 2В(ж) = АВ2 (ж)
u = k.С(А)
3) А(ж) + 2В(тв) = АВ2 (ж)
u = k.С (А)
Таким образом, в кинетическое уравнение не входит концентрация твёрдого вещества (всегда), а жидкого - в реакции с газом.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа, которое математически выражается соотношением:  , где
, где
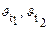 - скорость реакции соответственно при начальной и конечной темпе-ратурах; g - температурный коэффициент, который показывает во сколько раз увеличилась константа скорости реакции при увеличении температуры на 100.
- скорость реакции соответственно при начальной и конечной темпе-ратурах; g - температурный коэффициент, который показывает во сколько раз увеличилась константа скорости реакции при увеличении температуры на 100.
Правило Вант-Гоффа является приближенным, более точно зависимость скорости от температуры выражается уравнением Аррениуса:
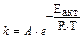 , где
, где
A - постоянная, независящая от температуры; e = 2,17828 (основание натураль-ного логарифма); Eакт - энергия активации; R = 8,314 Дж/моль. K (газовая постоянная); T - абсолютная температура (Т = t + 273).
Задачи с решениями
1. Гомогенная реакция между веществами А и В протекает по уравнению 2А + В = С, концентрация вещества А равна 6 моль/л, а вещества В - 5 моль/л. Константа скорости реакции равна 0,5 л2  моль-2
моль-2  с-1. Вычислите скорость химической реакции в начальный момент и в тот момент, когда в реакционной смеси останется 45% вещества В.
с-1. Вычислите скорость химической реакции в начальный момент и в тот момент, когда в реакционной смеси останется 45% вещества В.
Решение:
Согласно закону действующих масс: u = k  C2(A)
C2(A)  C(B). Скорость химической реакции в начальный момент равна u0 = 0,5
C(B). Скорость химической реакции в начальный момент равна u0 = 0,5  62
62  5 = 90,0 (моль
5 = 90,0 (моль  л-1
л-1  с-1). По истечении некоторого времени в реакционной смеси останется 45% вещества В, т.е. концентрация вещества В станет равной С1(В) = 0,45
с-1). По истечении некоторого времени в реакционной смеси останется 45% вещества В, т.е. концентрация вещества В станет равной С1(В) = 0,45  5 = 2,25 (моль/л).
5 = 2,25 (моль/л).
Значит, концентрация вещества В уменьшилась на 5,0 - 2,25 = 2,75 (моль/л).
Так как вещества А и В взаимодействуют между собой в соотношении 2:1, то концентрация вещества А уменьшилась на 5,5 моль/л (2,75  2) и стала равной 6,0 - 5,5 = 0,5 (моль/л).
2) и стала равной 6,0 - 5,5 = 0,5 (моль/л).
Скорость химической реакции в тот момент, когда в реакционной смеси останется 45% вещества В, станет u1 = 0,5  (0,5)2
(0,5)2  2,25 = 0,28 (моль
2,25 = 0,28 (моль  л-1
л-1  с-1).
с-1).
Ответ: u0 = 90,0 моль/(л.с), u1 = 0,28 моль/(л.с).
2. Окисление глюкозы в организме протекает через несколько промежуточных стадий по суммарному уравнению: С6Н12О6 (т) + 6О2 (г) = 6СО2 (г) + Н2О(ж). Запишите кинетическое уравнение этой реакции и определите, как изменится скорость реакции: а) в условиях высокогорья, где концентрация кислорода вдвое меньше; б) в барокамере, где давление воздуха вдвое больше атмосферного.
Решение:
Запишем кинетическое уравнение реакции окисления глюкозы:
u = k  C6(O2)
C6(O2)
Обозначим начальную концентрацию О2 через а моль/л, тогда
u0 = k  а 6
а 6
а) В условиях высокогорья С1(О2) = а/2 моль/л. u1 = k  ( а/2)6 =
( а/2)6 = 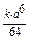 . Определим как изменяется скорость:
. Определим как изменяется скорость:  .
.
Следовательно, скорость реакции уменьшается в 64 раза.
б) В барокамере С(О2) = 2 а моль/л. u2 = k  (2а)6 = 64.k
(2а)6 = 64.k  а 6. Определим, как изменится скорость:
а 6. Определим, как изменится скорость:  .
.
Следовательно, скорость реакции увеличивается в 64 раза.
3. Во сколько раз уменьшится скорость окисления глюкозы в организме, если уменьшить температуру тела с 37° до 30° при температурном коэффициенте g = 1,7?
Решение:
По правилу Вант-Гоффа: 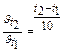 ,
, 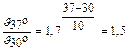 .
.
Следовательно, скорость реакции уменьшилась в 1,5 раза.
4. При увеличении температуры от 10° до 50°С скорость реакции увеличилась в 16 раз. Определите её температурный коэффициент.
Решение:
По правилу Вант-Гоффа:
 , g4 = 16; g =
, g4 = 16; g = 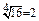
Ответ: температурный коэффициент реакции равен 2.
5. Раствор лекарственного вещества содержит 500 активных единиц в 1мл. Через 40 дней в нём осталось 20 единиц в мл. Реакция протекает по первому порядку. Рассчитайте константу скорости и период полупревращения реакции.
Решение:
Для реакции 1-го порядка
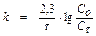 ,где
,где
С0 и Сt - начальная и текущая концентрации, а t - время.
t = 24.40 (дней) = 960 (часов).
 = 0,0034 (час-1)
= 0,0034 (час-1)
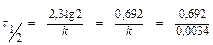 = 203,5 (час) = 8,5 (дней).
= 203,5 (час) = 8,5 (дней).
6. В ферментативной реакции через час после её начала осталось 48 г субстрата, а через 3 часа - 27 г. Определите начальную концентрацию субстрата, считая, что реакция имеет первый порядок.
Решение: Для реакции 1-го порядка: 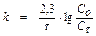
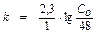 ;
; 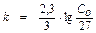 ;
; 
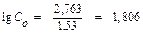 ; С0 = 63,97 г субстрата.
; С0 = 63,97 г субстрата.
7. Как изменится скорость реакции: 4HCl + O2 ® 2Cl2 + 2H2O, протекающей в газовой фазе, если увеличить в три раза:
1) концентрацию кислорода;
2) концентрацию хлороводорода;
3) давление в системе?
Решение: Если обозначить концентрации HCl и O2 соответственно через x и y , то выражение для скорости реакции примет вид: u = k.C4(HCl).C(O2) = k  x4
x4  y. После увеличения концентрации в 3 раза они будут равны 3 x для HCl и 3y для O2, поэтому:
y. После увеличения концентрации в 3 раза они будут равны 3 x для HCl и 3y для O2, поэтому:
1) u = k  x4
x4  3y = 3k
3y = 3k  x4
x4  y. Увеличение скорости реакции по отношению к первоначальной составляет:
y. Увеличение скорости реакции по отношению к первоначальной составляет:  = 3.
= 3.
2) u = k  (3 x)4
(3 x)4  y = 81
y = 81  k
k  x4
x4  y, u2/u = 81.
y, u2/u = 81.
3) Увеличение давления во столько же раз увеличивает концентрацию газообразных реагирующих веществ, поэтому: u3 = k  (3x)4
(3x)4  3
3  y = 243k
y = 243k  x4
x4  y, u3/u = 243.
y, u3/u = 243.
Вопросы и задачи для самоподготовки.
1.Что изучает химическая кинетика? Какова ее практическая цель?
2. Что называется скоростью химической реакции, какова её размерность?
3. Дайте определения и приведите примеры гомогенных и гетерогенных реакций. Как находятся их скорости?
4. В каких случаях правая часть равенства u = DC/Dt имеет знак «+» или «-»? Как называется величина u?
5. От каких факторов зависит скорость химических реакций? Сформулируйте закон действующих масс.
6. Что называют константой скорости? Каков физический смысл этой величины? Зависит ли константа скорости от температуры, природы реагирующих веществ и их концентрации?
7. Изменится ли значение константы скорости реакции: а) при замене одного катализатора другим; б) при изменении концентрации реагирующих веществ?
8. Что такое молекулярность реакции; порядок реакции? Приведите примеры моно-, ди- и тримолекулярных реакций; реакций нулевого, первого, второго, третьего порядков.
9. Напишите кинетические уравнения следующих химических реакций:
а) H2 (г) + Cl2 (г) ® 2 HCl (г)
б) 2 NO (г) + O2 (г) ® 2 NO2(г)
в) CaO(т) + CO2(г)® CaCO3(г)
г) 4NH3(г) + 3 О2(г) ® 2 N2(г) + 6H2O(г)
д) FeO(т) + H2(г) ® Fe(т) + H2O(ж)
10. Как влияет давление на скорость реакции?
11. Какими формулами выражаются правило Вант-Гоффа, уравнение Аррениуса, определяющие зависимость скорости реакции от температуры?
12. Что называют температурным коэффициентом скорости реакции? Какие он может иметь значения?
13. Почему повышение температуры увеличивает скорость реакции? Какие молекулы называют активными?
14. Зависит ли температурный коэффициент скорости реакции от значения энергии активации?
14. Зависит ли значение энергии активации реакции в случае гетерогенного
катализа от площади поверхности катализатора и от её структуры?
16. Скорость каких реакций в большей степени зависит от температуры - тех, у которых энергия активации небольшая или наоборот?
17. В каком случае скорость одной и той же реакции в большей степени зависит от температуры: при проведении её с катализатором или без катализатора?
18. Что такое активированный комплекс, энергия активации? Изобразите энергетическую диаграмму реакции, идущей с образованием активированного комплекса.
19. Сущность катализа. Механизм гомогенного и гетерогенного катализа. Понятие о ферментативном катализе.
20. При взаимодействии SO2 и O2 концентрация последнего уменьшилась за 1 час на 0,25 моль/л. Как изменится при этом концентрация SO2 и чему равна средняя скорость реакции?
Ответ: уменьшится на 0,5 моль/л; 8,33.10−3 моль/л  с.
с.
21. При синтезе аммиака к данному моменту времени прореагировало 0,9 моль/л водорода, а его начальная концентрация равна 1,4 моль/л. Определите концентрацию оставшегося водорода и прореагировавшего азота.
Ответ: 0,5 и 0,3 моль/л.
22. Найдите константу скорости реакции 2А + В ® С, зная, что при концентрациях А и В, соответственно равных 0,5 и 0,6 моль/л, её скорость составляет 0,018 моль/(л  мин). Ответ: 0,12 л2/моль2
мин). Ответ: 0,12 л2/моль2  мин.
мин.
23. Гомогенная реакция идет по уравнению А + 2В ® С; константа её скорости при данной температуре равна 0,4 л2/моль2  с, а начальные концентрации составляют: 0,3 моль/л вещества А и 0,5 моль/л вещества В. Вычислите скорость этой реакции при той же температуре в начальный момент и после того, как прореагирует 0,1 моль/л вещества А. Ответ: 0,03 и 0,0072 моль/л
с, а начальные концентрации составляют: 0,3 моль/л вещества А и 0,5 моль/л вещества В. Вычислите скорость этой реакции при той же температуре в начальный момент и после того, как прореагирует 0,1 моль/л вещества А. Ответ: 0,03 и 0,0072 моль/л  с.
с.
24. Для того, чтобы увеличить в 216 и 256 раз скорость реакции синтеза NH3, во сколько раз надо повысить в первом случае концентрацию H2, а во втором - давление? Ответ: увеличить в 6 и 4 раза.
25. Температурный коэффициент реакции равен 2,5. Как изменится её скорость: а) при повышении температуры от 800 до 1400С; б) при охлаждении реакционной смеси от 500 до 300С.
Ответ: а) увеличится в 244; б) уменьшится в 6,25 раза.
26. При 1500С некоторая реакция заканчивается за 16 мин. Принимая температурный коэффициент скорости реакции равным 2,5, рассчитайте, через какое время закончится эта реакция, если проводить её: а) при 2000С; б) при 800С? Ответ: а) 9,8 с; б) 162,77 час.
27. Во сколько раз увеличится скорость реакции, протекающей при 298 K, если энергию активации её уменьшить на 4 кДж/моль? Ответ: в 5 раз.
Лабораторные работы.
Работа 1. Зависимость скорости реакции от концентрации реагирующих веществ.
Реакция между серной кислотой и тиосульфатом натрия сопровождается выделением серы и раствор мутнеет:
Na2S2O3 + H2SO4 = Na2SO4 + S¯ + SO2 + H2O
Данная реакция состоит из следующих стадий:
Na2S2O3 + H2SO4 = Na2SO4 + H2S2O3 (I) (очень быстро)
H2S2O3 = H2SO3 + S¯ (2) (медленно)
H2SO3 = SO2 + H2O (3) (быстро)
Скорость суммарного процесса определяется медленной стадией - разложением тиосерной кислоты (2): u = k.C(H2S2O3)
Время от начала реакции до момента появления мути зависит от скорости этой реакции. Чем меньше концентрация Na2S2O3, тем больше будет этот промежуток времени (меньше скорость реакции). За скорость можно условно принять величину, обратную времени протекания реакции: u (усл.) = 1/t.
Выполнение эксперимента:
В три пробирки налейте по 3 мл раствора серной кислоты. В три другие налейте: в первую – 9 мл раствора Na2S2O3, во вторую – 6 мл раствора и 3 мл воды, а в третью – 3 мл раствора Na2S2O3 и 6 мл воды. Затем к каждому из подготовленных растворов прилейте по 3 мл раствора серной кислоты, встряхните и отметьте, через сколько секунд после приливания кислоты появится муть. Результаты запишите в журнал по следующей форме:
| № про-бир-ки | V(p-pa H2SO4)мл | V(p-pa Na2S2O3)мл | V(H2O) мл | Объём смеси, мл | Время появ-ления мути,с |
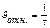 с-1
с-1
| Относит. С(Na2S2O3) |
| t1 = | 3C | ||||||
| t2 = | 2C | ||||||
| t3= | 1C |
Обработка результатов эксперимента
Выразите относительную скорость в виде десятичной дроби, а результаты эксперимента представьте в виде графика зависимости скорости реакции от концентрации. Для этого по горизонтальной оси отметьте три точки, отстоящие от начала координат на 1 с, 2 с и 3 с, где с - произвольно выбранный отрезок, соответствующий единице относительной концентрации. Из каждой точки восстановите перпендикуляр, длина которого пропорциональна величине относительной скорости реакции. Линия, соединяющая верхние концы перпендикуляров, будет выражать собой графическую зависимость скорости реакции от концентрации. Сформулируйте вывод, характеризующий результат эксперимента.
Работа 2. Зависимость скорости реакции от температуры.
Выполнение эксперимента.
Налейте в три пробирки по 6 мл раствора Na2S2O3, а в другие три - по 6 мл раствора H2SO4 и разделите их на три пары по пробирке с растворами тиосульфата и серной кислоты в каждой паре. Растворы первой пары пробирок слейте при комнатной температуре (лучше раствор Na2S2O3 к раствору H2SO4), одновременно включите секундомер и отметьте время появления мути. Растворы второй пары нагрейте на 100С, а третьей пары - на 200С выше комнатной температуры. Для этого поместите соответствующую пару пробирок в химический стакан с водой и нагрейте последний до требуемой температуры. За температурой следите по термометру, опущенному в воду. Сливайте по-парно содержимое пробирок и отмечайте, через сколько секунд появится муть. Результаты запишите в журнал по форме:
| № пробирок | V(р-ра H2SO4), мл | V (р-ра Na2S2O3), мл | t0 С | Время появления мути, с | uотн = 1/t, с-1 |
| ком. t0C | t1= | ||||
| +100 | t2= | ||||
| +200 | t3= |
Обработка результатов эксперимента.
Результаты выразите в виде графика, аналогично работе №1. По горизонтальной оси отметьте три точки, соответствующие трём значениям температур (t0ком., +100, +200). Сделайте вывод о том, как зависит скорость изучаемой реакции от температуры.
Работа 3. Зависимость скорости реакции от концентрации катализатора.
Ионы Сu2+ повышают скорость разложения тиосерной кислоты.
Выполнение эксперимента.
В три пробирки налейте из бюретки по 1 мл раствора Na2S2O3, затем в одну из них прибавьте 1 мл раствора катализатора (раствор СuSO4) и 3 мл воды; во вторую - 2 мл раствора катализатора и 2 мл воды; в третью - 3 мл раствора катализатора и 1 мл воды. Таким образом, во всех трех пробирках будет по 5 мл раствора с одинаковой концентрацией Na2S2O3, но с разной концентрацией СuSO4.
Рассчитайте концентрацию Na2S2O3 и ионов Сu2+ в приготовленных растворах.
В три другие пробирки налейте по 5 мл раствора H2SO4. Затем попарно смешайте приготовленные растворы Na2S2O3 и H2SO4. По секундомеру отметьте время от момента смешивания до помутнения раствора. Полученные результаты запишите в журнал по форме:
| № пробирок | Концентрация ионов Сu2+, моль/л | Время появления мути, с | uотн = 1/t, с–1 |
Обработка результатов эксперимента.
Рассчитайте условную скорость реакции при различных концентрациях Сu2+. Постройте график зависимости скорости реакции от концентрации катализатора. На основании полученной зависимости сделайте вывод о влиянии ионов Сu2+ на скорость разложения тиосерной кислоты.
ЗАНЯТИЕ 9
Тема: Химическое равновесие.
Химическое равновесие устанавливается в системах, в которых протекают обратимые химические реакции. Количественно оно характеризуется константой равновесия (K).
Для гомогенной реакции общего вида: аА + вВ ↔ сС + dD
Kс =  , где
, где
[A], [B], [C], [D] - равновесные молярные концентрации веществ A, B, C и D.
Для гетерогенной реакции вида:
1) A(г) + 2B(ТВ) ↔ AB2(ж) Kс = 
2) А(г) + 2В(ж) ↔ АВ2(ж) Kс = 
3) А(ж) + 2В(тв) ↔ АВ2(ж) Kс = 
Таким образом, концентрация твёрдого вещества (всегда), жидкого (в реакциях с газами) не входит в выражение константы равновесия, как и в кинетическое уравнение химической реакции.
Константа равновесия, равная отношению констант скоростей прямой (k1) и обратной (k2) реакции зависит от температуры и от природы реагирующих веществ, но не зависит от их концентрации:
K =  .
.
На состояние химического равновесия оказывают влияние концентрация реагирующих веществ, температура, а для газов - и давление. При изменении одного из этих параметров равновесие нарушается и концентрации всех реагирующих веществ изменяются до тех пор, пока не установится новое равновесие, но уже при других значениях равновесных концентраций. Такой переход называется сдвигом или смещением химического равновесия.
О направлении сдвига равновесия судят по принципу Ле Шателье, в соот-ветствии с которым увеличивается скорость той реакции (прямой или обрат-ной), которая ослабляет внешнее воздействие. Действительно, если увеличить, например, концентрацию [С], то должна уменьшиться концентрация [D], и
увеличиться концентрация [А] и [В], т.е. это приведёт к смещению равновесия в сторону исходных веществ.
Задачи с решениями.
1. При состоянии равновесия в системе N2(г) + 3H2(г) ↔2NH3(г); DН = -92,4кДж концентрации веществ равны: [N2] = 3моль/л; [H2] = 9моль/л; [NH3] = 4моль/л. Определите: а) константу равновесия реакции; б) исходные концентрации N2 и H2; в) в каком направлении сместится равновесие с ростом температуры; с уменьшением объёма реакционного сосуда?
Решение:
а) Kс =  = 0,0073.
= 0,0073.
Kс << 1, т.е. равновесие смещено влево, преобладает обратная реакция.
б) исходная концентрация вещества складывается из прореагировавшей и равновесной:
C(N2) = C¢(N2) + [N2]
C(H2) = C¢(H2) + [H2]
Из уравнения реакции видно, что для образования 2 моль NH3 расходуется 1 моль N2 и 3 моль Н2. Т.к. в момент равновесия [NH3] = 4 моль/л, то С¢(N2) = 2 моль/л; C¢(H2) = 6 моль/л.
C(N2) = 3 + 2 = 5 (моль/л),
C(H2) = 9 + 6 = 15 (моль/л).
в) при увеличении температуры равновесие сместится влево, в сторону эндотермической реакции; при уменьшении объёма реакционного сосуда увеличивается давление и равновесие смещается вправо, в сторону уменьшения числа молей газовой смеси.
Ответ: Kс = 0,0073; 5 моль/л N2, 15 моль/л Н2.
2. Константа равновесия реакции FeO(K) + CO(г) 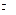 Fe(K) +CO2(г) при некоторой
Fe(K) +CO2(г) при некоторой
температуре равна 0,5. Найдите равновесные концентрации CO и CO2, если начальные концентрации составляли: C(CO2) = 0,05 моль/л; C(CO2) = 0,01 моль/л.
Решение: Kс =  = 0,5.
= 0,5.
Пусть х моль СО прореагировало, тогда по уравнению реакции из х моль СО получилось х моль СО2.
[CO] = C(CO) - C'(CO) = (0,05 - х) моль/л
[CO2] = C(CO2) - C'(CO) = (0,01 + х) моль/л
Kс = 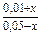 = 0,5
= 0,5
(0,01 + х) = 0,5(0,05 - х); 0,01 + х = 0,025 - 0,5х; 1,5х = 0,015;
х = 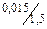 = 0,01
= 0,01
[CO] = 0,05 - 0,01 = 0,04 (моль/л)
[CO2] = 0,01 + 0,01 = 0,02 (моль/л)
Ответ: [CO] = 0,04 M, [CO2] = 0,02 M.
3. При отравлениях арсенатами в крови обнаруживают 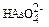 ионы, способные замещать
ионы, способные замещать 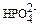 ионы в процессе метаболизма. Рассчитайте равновесную кон-центрацию
ионы в процессе метаболизма. Рассчитайте равновесную кон-центрацию 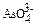 ионов в водном растворе, если [
ионов в водном растворе, если [ 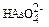 ] = 10-4 моль/л, а константа равновесия для реакции
] = 10-4 моль/л, а константа равновесия для реакции 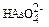 ↔ H++
↔ H++ 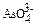 при 250 равна 10-12.
при 250 равна 10-12.
Решение:
1) По закону действующих масс: Kс = 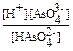 = 10-12.
= 10-12.
2) По уравнению реакции: 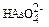 ↔ H+ +
↔ H+ + 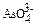
[ 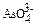 ] = [H+] и пусть равно х моль/л, тогда Kс =
] = [H+] и пусть равно х моль/л, тогда Kс = 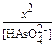 = 10-12.
= 10-12.
x = 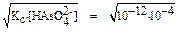 = 10-8 моль/л.
= 10-8 моль/л.
Ответ: 10-8 моль/л.
4. Чему равна массовая доля водорода и йода, превращающихся в йодоводород, если они взяты в реакцию по 1 моль каждый, а константа равновесия при температуре опыта равна 4?
Решение:
Составим таблицу: H2 + I2 ↔ 2HI
Взято, моль/л 1 1
К моменту равновесия прореагировало х х
Осталось 1-х 1-х
Образовалось 2х
Если равновесные концентрации водорода и йода составляют 1 - х, а йодоводорода 2х моль/л, то
Kс = 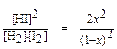 = 4, х = 0,5 (моль/л).
= 4, х = 0,5 (моль/л).
Таким образом, массовые доли Н2 и I2, превратившихся в HI, равны и составляют 50%.
Ответ: 50%.
5. Для реакции 2 CO2 ↔ 2CO + O2 при 20000С состав равновесной смеси выражается объёмными долями: 85,2% CO2, 9,9%CO и 4,9%O2, а общее давление в системе составляет 101,3 кПа. Чему равна константа равновесия этой реакции при данной температуре, выраженная через:
а) парциальные давления реагирующих веществ (Kp),
б) их молярные концентрации (Kс)?
Решение:
Парциальное давление газа равно общему давлению, умноженному на объёмную долю газа в смеси, поэтому:
а) р(CO2) = 101,3.0,852 = 86,3 (кПа)
б) p(CO) = 101,3.0,099 = 10,0 (кПа)
в) p(O2) = 101,3.0,049 = 4,9 (кПа)
Kp =  = 0,067.
= 0,067.
Для данной реакции Dn = 3-2= 1. Тогда Kc =  =3,6.
=3,6.
Ответ: Kp = 0,067; Kc = 3,6.
6. Какими способами в системе: 2SO2 + O2 ↔ 2SO3 - DH можно смещать равновесие в сторону большего выхода SO3 при заданной концентрации SO2?
Решение:
По принципу Ле Шателье это достигается:
а) повышением концентрации О2;
б) уменьшением концентрации SO3 (удаления из сферы реакции);
в) повышением давления;
г) понижением температуры до такого ее значения, при котором скорость реакции еще достаточна для относительно быстрого достижения равновесия.
Вопросы и задачи для самоподготовки.
1. Какие реакции называют: а) необратимыми; б) обратимыми; в) прямыми; г) обратными? Приведите соответствующие примеры.
2. Одинаковы или различны значения констант скоростей для прямой и обратной реакции? Объясните.
3. Как изменяются скорости прямой и обратной реакции? Чем обусловлено и в какое состояние приводит данную систему?
4. Что называют химическим равновесием? Почему оно является ди-намическим? Какие концентрации реагирующих веществ называют равновесными?
5. Что называют константой химического равновесия? Зависит ли эта величина от природы реагирующих веществ, их концентрации, температуры, давления?
6. Объясните, почему числовое значение константы равновесия определяет глубину превращения исходных веществ в продукты реакции.
7. Почему в выражение для константы равновесия не входят концентрации веществ, находящихся в твердой фазе?
8. Какими параметрами характеризуется химическое равновесие? Перечислите.
9. Какой процесс называют смещением (сдвигом) химического равновесия.
10.На конкретных примерах покажите, как смещается равновесие системы под влиянием изменения: а) концентрации одного из реагирующих веществ,б) температуры, в) давления.
11.Скорость какой химической реакции (экзо- или эндотермической) больше увеличивается при нагревании равновесной системы?
12. Влияет ли катализатор на положение равновесия и почему? Зависит ли константа равновесия от катализатора?
13. Для какой реакции - прямой или обратной - энергия активации больше, если прямая реакция идет с выделением теплоты?
14. Если при данной температуре константа скорости прямой реакции имеет большее значение, чем константа скорости обратной, то какая из них будет экзотермической?
15. Напишите выражение Kр для следующих реакций:
а) 2NО(г)+О2(г) ↔2 NО2(г)
б) СH3СООН(р) ↔СН3СОО- (р)+ Н+(р)
в) МgСО3(к) ↔ МgО(к)+ СО2(г)
г) [НgJ4]2- (р) ↔Нg2+(р)+ 4I- (р)
д) Н2О(ж) ↔ Н+(р)+ ОН- (р)
е) 3Fe(к)+ 4Н2О(ж) ↔ Fe3О4(к)+ 4Н2(г)
16. При 4500С константа равновесия реакции Н2 + I2↔ 2НI равна 50,0. Чему равна константа равновесия реакции диссоциации НI при той же температуре? Ответ: 0,02.
17. Найдите значение константы равновесия для гомогенной реакции А + В ↔ С + D, если исходные концентрации веществ А и В были равны по 0,8 моль/л, а равновесная концентрация вещества С равна 0,6моль/л. Ответ: 9.
18. Какое значение имеет константа равновесия Kр реакции: 2НI(г) ↔ Н2(г) + I2(г) при 4480С, если парциальные равновесные давления газов при этой температуре составляют: p(HI) = 40,5 кПа, р(H2) = 75,2кПа, р(I2) = 0,436 кПа? Ответ: 0,02.
19. В системе РСI5(г) ↔ РСI3(г) + СI2(г) равновесиe при 500 K установилось, когда исходная концентрация РСI5, равная I моль /л, уменьшилась до 0,46 моль/л. Найдите значение Kс этой реакции при указанной температуре. Ответ: 0,634.
20. Рассчитайте константу равновесия реакции: 4НСI (г)+ О2 (г) ↔ 2СI2(г) + 2Н2О(г), если начальные количества веществ были 2,4 моль НСI и 1,2 моль О2, а к моменту наступления равновесия осталось непрореагировавшим 0,8 моль хлороводорода. Объём реакционного сосуда равен 4 л. Ответ: 0,625.
21.Определите константу равновесия реакции: N2(г)+ 3Н2(г) ↔ 2NH3(г), если при некоторой температуре в реакционный сосуд, объёмом 10 л введено 0,05 моль N2 и 0,52 моль Н2, а к моменту установления равновесия образовалось 0,04 моль аммиака. Ответ: 54,8.
22. При 6500С константа равновесия системы СО2(г)+Н2(г) ↔ СО(г)+Н2О(г) равна единице. В начальный момент концентрации СО2 и Н2 были соответственно равны 0,2 и 0,8 моль/л. Вычислите равновесные концентрации всех реагирующих веществ.
Ответ: 0,04; 0,64; 0,16; 0,16 моль/л.
23. Для реакции FeO(к) + CO(г) ↔ Fe(к) + CO2(г) константа равновесия при 10000С равна 0,5. Начальные концентрации СО и СО2 были соответственно равны 0,05 и 0,01 моль /л. Найдите их равновесные концентрации. Ответ: 0,04 и 0,02 моль/л.
24. Найдите константу равновесия реакции N2O4  2NO2, если начальная концентрация N2O4 составляла 0,08 моль/л, а к моменту наступления равновесия диссоциировало 50% N2O4. Ответ: 0,16.
2NO2, если начальная концентрация N2O4 составляла 0,08 моль/л, а к моменту наступления равновесия диссоциировало 50% N2O4. Ответ: 0,16.
25. Будет ли влиять на равновесную концентрацию СО2 в системе СаСО3(к) ↔ СаО(к) + СО2(г) введение дополнительного количества: а)СО2, б) СаСО3?
Ответ: а) да; б) нет.
26. Какие условия будут способствовать большему выходу SO3 по реакции SO2 + 1/2О2 ↔ SO3; DН0298 = -98,9 кДж/моль? Какая масса SО2 израсходуется при образовании SO3 массой 10 г? Ответ: 8 г.
27. В какую сторону сместится равновесие реакции:
а) 2Н2S(г) ↔2H2(г) + S2(к) ; DН = 40,13 кДж
б) N2O4(ж) ↔2NO2(г); DН = 66,55 кДж
в) СО(г) + Н2О(г) ↔СО2(г) + Н2(г); DН = -40,96кДж
1) при повышении температуры;
2) при повышении давления?
28. В какую сторону будет смещаться равновесие при повышении температуры в системе:
а) N2 (г) + 3H2 (г) ↔ 2NH3 (г), DH0298 = -92,4 кДж
б) 2CO2 (г) Обсуждений еще не было, будьте первым... ↓↓↓
![]() 2016-09-16
2016-09-16![]() 863
863![]() Обсуждений (0)
Обсуждений (0)
Обсуждение в статье: Образец билета тестированного контроля. по теме: Химическая термодинамика и термохимия

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

