 |
Главная |
Смещение химического равновесия. Состояние химического равновесия сохраняется при данных неизменных условиях любое
|
из
5.00
|
Состояние химического равновесия сохраняется при данных неизменных условиях любое время. При изменении условий состояние равновесия нарушается, так как при этом скорости противоположных процессов изменяются в разной степени. Спустя некоторое время система снова приходит в состояние равновесия, но уже отвечающее новым, изменившимся условиям.
Смещение равновесия в зависимости от изменения условий определяется принципом Ле Шателье: “Если на систему, находящуюся в равновесии, оказывают воздействие извне путем изменения какого-либо из условий, определяющих положение равновесия, то оно смещается в направлении того процесса, протекание которого ослабляет эффект произведенного воздействия”.
Иными словами: “Если изменить условия, при которых система находилась в равновесии, то оно смещается в сторону той реакции, которая противодействует произведенному изменению”.
Изменение температуры оказывает влияние на сдвиг химического равновесия для процессов, сопровождающихся тепловыми эффектами. Если прямая реакция для данной системы экзотермическая, то обратная - эндотермическая и наоборот. Повышение температуры приводит к смещению равновесия в сторону эндотермической реакции, идущей с поглощением теплоты. Понижение температуры в системе смещает равновесие в сторону экзотермической реакции, идущей с выделением теплоты. В общем случае:
 (Экзотермическая реакция)
(Экзотермическая реакция)
повышение температуры
-¾¾¾¾¾¾¾¾¾¾¾¾`
понижение температуры
¾¾¾¾¾¾¾¾¾¾¾®
 (Эндотермическая реакция)
(Эндотермическая реакция)
повышение температуры
¾¾¾¾¾¾¾¾¾¾¾¾¾®
понижение температуры
¾¾¾¾¾¾¾¾¾¾¾¾¾
Увеличение концентрации одного из исходных веществ приводит к смещению равновесия вправо, т.е. в сторону большего выхода продукта. Этого эффекта можно добиться и при выведении полученных веществ из сферы реакции, т.к. это приводит к уменьшению скорости обратной реакции и возрастанию скорости прямой реакции.
В общем случае:
при увеличении концентрации веществ А и В
¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾®
при уменьшении концентрации веществ Д и F
¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾®
при уменьшении концентрации веществ А и В
¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾
при увеличении концентрации веществ Д и F
¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾
Изменение давления (путем уменьшения или увеличения объема) может нарушить равновесие в системе, содержащей газообразные вещества. Рассмотрим влияние давления на равновесие в системе.
2NO(г) + Cl2(г) ⇄2NOCl(г)
Первоначальная скорость прямой и обратной реакций определяется уравнениями: 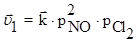 ;
;  .
.
Если в системе увеличить давление в 2 раза, то новые скорости прямой и обратной реакций определяются уравнениями:


Таким образом, в результате увеличения давления скорость прямой реакции возросла в 8 раз, а обратной - только в 4 раза. Равновесие в системе нарушится - прямая реакция будет преобладать над обратной. После того, как скорости через какой-то промежуток времени сравняются, вновь установится равновесие, но количество NOCl в системе возрастет (его парциальное давление увеличится) - равновесие сместится вправо.
Неодинаковое изменение скоростей прямой и обратной реакций связано с тем, что в левой и правой частях уравнение различно число молекул газов. Давление газа есть результат ударов его молекул о стенки сосуда; при прочих равных условиях давление газа тем выше, чем больше молекул заключено в данном объеме газа. Поэтому реакция, протекающая с увеличением числа молекул газов (обратная в данном случае), приводит к возрастанию давления, а реакция, протекающая с уменьшением числа молекул газов (прямая в данном случае), приводит к уменьшению давления.
Таким образом, при увеличении давления в системе равновесие сдвигается в сторону уменьшения числа молекул газов, т.е. в сторону понижения давления; при уменьшении давления в системе равновесие сдвигается в сторону возрастания числа молекул газов, т.е. в сторону увеличения давления.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример 1. При нагревании NO2 в закрытом сосуде до некоторой температуры равновесие реакции 2NO2(г)⇄ 2NO(г)+O2(г) установилось при следующих равновесных концентрациях (моль/л):  ,
, 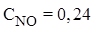 ,
, 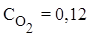 . Найти константу равновесия.
. Найти константу равновесия.
Решение: Для данной гомогенной системы

Значит, равновесие смещено в сторону продуктов реакции.
Пример 2. В системе FeO(к) + CO(г) ⇄ Fe(к) + CO2(г) равновесные концентрации равны (моль/ л):  ,
,  .Найти константу равновесия.
.Найти константу равновесия.
Решение: Для данной гетерогенной системы: 
Равновесие смещено в сторону продуктов реакции.
Пример 3. Равновесие реакции N2(г) + O2(г) ⇄2NO(г) установилось при равновесных концентрациях (моль/л):
 ,
,  ,
,  . Найти исходную концентрацию O2.
. Найти исходную концентрацию O2.
Решение:  должна быть больше равновесной на величину, необходимую для получения 0,8 молей NO, т.е. продукта реакции.
должна быть больше равновесной на величину, необходимую для получения 0,8 молей NO, т.е. продукта реакции.
Исходная концентрация NO равна нулю. Исходя из уравнения реакции, получаем:
на 2 моль NO по уравнению реакции расходуется 1 моль О2 ,
на 0,8 моль/л NO - х моль/л О2 .

Отсюда: 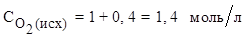
Пример 4. Для процесса 2H2(г) + O2(г) ⇄ 2H2O(ж) рассчитать DG и константу равновесия (Т=298 К). Концентрация каких веществ (исходных или продуктов) преобладает в равновесной смеси?
Решение:
 определяем по
определяем по 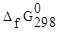 веществ (5):
веществ (5):

Прямая реакция может идти самопроизвольно, т.к. DG < 0. Следовательно, в равновесной смеси преобладают продукты взаимодействия. Зная  , определим константу равновесия:
, определим константу равновесия:


 ,
,
т.е.  , что подтверждает преобладание продуктов реакции.
, что подтверждает преобладание продуктов реакции.
Пример 5. В каком направлении сместится равновесие в системах:
а) CO(г) +Cl2(г) ⇄ COCl2(г)
б)H2(г) + I2(г) ⇄ 2HI(г)
при понижении давления?
Решение:
а) Протекание прямой реакции приводит к уменьшению общего числа молекул газов, т.е. к уменьшению давления в системе. Поэтому понижение давления вызывает смещение равновесия влево.
б) Протекание реакции не сопровождается изменением числа молекул газов и не приводит к изменению давления. В этом случае изменение давления не вызовет смещение равновесия.
Пример 6. В какую сторону сместится равновесие в системе:
2H2S(г) ⇄ 2H2(г) + S2(г)
при повышении давления в 3 раза?
Решение: Скорость прямой реакции при повышении давления в 3 раза увеличится в 9 раз, а обратной реакции в 27 раз:




Поэтому повышение давления в 3 раза приведет к смещению равновесия влево, т.е. в сторону меньшего давления.
Пример 7. В каком направлении сместится равновесие систем:
а)CO(г) + Cl2(г) ⇄ COCl2(г) (D Н = - 566 кДж)
б) N2(г) + O2(г) ⇄ 2NO(г)(D Н = + 180 кДж)
при понижении температуры?
Решение: В системе а) равновесие при понижении температуры сместится вправо, т.к. прямая реакция экзотермическая, идет с выделением теплоты. В системе б) равновесие сместится влево, т.к. прямая реакция эндотермическая, идет с поглощением теплоты.
Пример 8. Укажите, какими изменениями концентраций реагирующих веществ и продуктов реакции можно сместить вправо равновесие:
CO2(г) + C(к) ⇄ 2CO(г)
Решение: В данной гетерогенной системе в левой части уравнения стоит одна газообразная молекула, в правой - две, т.е. больше. Для того, чтобы равновесие реакции сместилось вправо, необходимо увеличить концентрацию СО2 и уменьшить концентрацию СО.
Пример 9. Какими изменениями условий можно сместить вправо равновесие системы: CaCO3(к) ⇄ CaO(к) + CO2(г) (DН>0)- реакция эндотермическая
Решение: Равновесие можно сместить вправо:
1) повышением температуры, т.к. прямая реакция эндотермическая, идет с поглощение теплоты;
2) уменьшением давления, т.к. газообразные молекулы есть только в правой части системы, и давление в ней будет больше;
3) уменьшением концентрации СО2.
Таким образом, изменяя условия, можно смещать химическое равновесие в нужном направлении, что и делается в производственной практике. Например, синтез аммиака 3H2(г) + N2(г) ⇄ 2NH3(г) ведется при повышенном давлении (до 1000 атм) при постоянном подводе исходных веществ Н2 и N2 и отводе продукта реакции NH3.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Какие реакции относятся к обратимым?
2. Какое состояние системы называется химическим равновесием?
3. Понятие о равновесных концентрациях.
4. Константа равновесия, ее зависимость от различных факторов.
5. Решить задачу: равновесие реакции 2N2(г) + O2(г) ⇄ 2N2O(г)
установилось при равновесных концентрациях (моль/л):
 ;
;  ;
;  . Вычислить константу равновесия и рассчитать исходную концентрацию О2
. Вычислить константу равновесия и рассчитать исходную концентрацию О2
(Ответ: 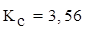 ;
;  ).
).
6. Сформулировать принцип Ле Шателье.
7. В какую сторону сместятся равновесия систем:
Fe3O4(к) + 4H2(г) ⇄ 3Fe(к) + 4H2O(г) (DH>0)
4NH3(г) + 5O2(г) ⇄ 4NO(г) +6H2O(г)(DH< 0)
а) при понижении температуры?
б) при повышении давления?
в) при увеличении концентрации Н2О?
8. Для процесса 3H2(г) + N2(г) ⇄ 2NH3(г) при Т = 315 К константа
равновесия 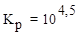 . Вычислить
. Вычислить  данной реакции и
данной реакции и
указать, возможна ли она (Ответ:  . Возможна).
. Возможна).
|
из
5.00
|
Обсуждение в статье: Смещение химического равновесия. Состояние химического равновесия сохраняется при данных неизменных условиях любое |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

