 |
Главная |
Константы устойчивости комплексных соединений
|
из
5.00
|
| Комплексное соединение | β | lgβ | Комплексное соединение | β | lgβ |
| Ag(NH3)2+ | 1,7 . 107 | 7,22 | FeOH+ | 3,2 . 104 | 4,50 |
| Cd(NH3)42+ | 5,5 . 106 | 6,74 | FeOH2+ | 8,5 . 1011 | 11,81 |
| Cu(NH3)42+ | 5,6 . 1011 | 11,75 | NiOH+ | 1,3 . 104 | 4,10 |
| Ni(NH3)42+ | 4,7 . 107 | 7,67 | HgOH+ | 4,0 . 1010 | 10,60 |
| Ni(NH3)62+ | 2,0 . 108 | 8,31 | PbOH+ | 2,0 . 106 | 6,30 |
| Zn(NH3)42+ | 7,8 . 108 | 8,89 | ZnOH+ | 1,0 . 105 | 5,00 |
| HgBr2 | 9,6 . 1017 | 17,98 | ZrOH3+ | 2,0 . 1014 | 14,30 |
| HgBr3- | 5,0 . 1020 | 20,70 | AlOH2+ | 1,0 . 109 | 9,00 |
| HgBr42- | 2,7 . 1022 | 22,23 | BiOH2+ | 50,0 | 1,70 |
| HgCl2 | 1,7 . 1013 | 13,23 | CdOH+ | 8,0 . 103 | 3,90 |
| HgCl3- | 1,5 . 1014 | 14,20 | CoOH+ | 2,0 . 104 | 4,30 |
| HgCl42- | 2,0 . 1015 | 15,30 | CrOH2+ | 1,2 . 1010 | 10,07 |
| AlF4- | 1,3 . 1019 | 19,10 | CuOH+ | 2,0 . 106 | 6,30 |
| MgC2O4 | 5,7 . 102 | 2,76 | AlEDTA- | 4,0 . 1016 | 16,60 |
| Mg(C2O4)22- | 1,7 . 104 | 4,24 | CaEDTA2- | 1,0 . 1014 | 14,00 |
| Ag(CN)2- | 0,9 . 1021 | 20,96 | CdEDTA2- | 2,9 . 1016 | 16,46 |
| Hg(CN)42- | 0,3 . 1042 | 41,40 | CoEDTA2- | 2,0 . 1016 | 16,30 |
| Cd(CN)42- | 0,1 . 108 | 7,12 | CuEDTA2- | 6,3 . 1018 | 18,80 |
| Cu(CN)43- | 0,2 . 1031 | 30,30 | HgEDTA2- | 5,0 . 1021 | 21,70 |
| Fe(CN)64- | 1,0 . 1037 | 37,00 | NiEDTA2- | 4,2 . 1018 | 18,62 |
| Fe(CN)63- | 1,0 . 1044 | 44,00 | PbEDTA | 1,1 . 1018 | 18,04 |
| FeSal+ | 2,8 . 1017 | 17,44 | ZnEDTA2- | 3,1 . 1016 | 16,50 |

Сотрудники кафедры биохимии и биофизики МГЭУ имени А.Д. Сахарова(2011 год)
| Таблица математических формул курса общей и неорганической химии | |||
| Стехиометрические законы | |||
| Закон эквивалентов для масс и растворов реагирующих веществ | nэкв.(А1) = nэкв.(А2) = … nэкв.(Аi) m(А1 )/ Mэкв.(А1) = m(А2 )/ Mэкв.(А2) = … m(Аi )/ Mэкв.(Аi) Сэкв. (А1 ) . V(А1) = Сэкв. (А2 ) . V(А2) = … Сэкв. (Аi ) . V(Аi), где Сэкв. – нормальная концентрация вещества в растворе, V – объем раствора | ||
| уравнение Клапейрона-Менделеева | pV= (m / M) RT, где m - масса газа; M - молекулярная масса; p - давление; V - объем; T - абсолютная температура (°К); R - универсальная газовая постоянная (8,314 Дж/(моль · К) или 0,082 л атм/(моль · К)) | ||
| Электронная структура атома и химическая связь | |||
| двойственная природа электромагнитного излучения и элементарных частиц | λ = с/ν ,где λ – длина волны, с – скорость света, ν – частота излучения; энергия фотона: Е = hν; для любой частицы: λ = h/(m . v) | ||
| Значения, которые могут принимать квантовые числа | Главное: n = 1,2,3…. ∞ Орбитальное: ℓ = 0,1,2,… n -1 Магнитное: m = -ℓ, -(ℓ-1)…0…(ℓ+1), ℓ Спиновое s = +1/2, -1/2 | ||
| дипольный момент связи и молекулы | µ = l × q | ||
| Порядок связи в двухатомных молекулах в методе МО |  ; ;
| ||
| Химическая термодинамика | |||
| Первый закон (начало) термодинамики | Q = ΔU + A/ | ||
| Тепловой эффект химической реакции (следствие закона Гесса) | DrH0298 = ∑vi · DfH0298,i - ∑vj ·DfH0298,j прод. исход. где DrH0298 — теплота реакции, r — первая буква слова rеасtiоп, νi, и νj — количества (молей) веществ, вступивших в реакцию, и продуктов реакции. Размерность энтальпии реакции — кДж | ||
| Второй закон (начало) термодинамики. Энтропия обратимых и необратимых процессов и смешения | DS =  DS > DS >  ; S = k·1пW ; S = k·1пW
| ||
| Энергия Гиббса – связь первого и второго законов термодинамики | DG = DН-ТDS Если DrG <0, то возможно самопроизвольное протекание прямой реакции Если DrG >0, то возможно самопроизвольное протекание обратной реакции Амакс. = DrG максимально-возможная работа, совершенная за счет тепла, выделившегося в результате химической реакции равна изменению энергии Гиббса реакции | ||
| Третий закон термодинамики | При абсолютной температуре Т = 00 К энтропия идеального кристалла равна нулю S = 0 | ||
| Химическая кинетика | |||
| Скорость химической реакции | V =  - скорость гомогенной химической реакции; - скорость гомогенной химической реакции;
 - скорость гетерогенной химической реакции - скорость гетерогенной химической реакции
| ||
| Зависимость скорости элементарной химической реакции: аА + bВ = dD + еЕ от концентраций реагирующих веществ | V = k·[А]a · [В]b, где k— константа пропорциональности, называемая константой скорости химической реакции,[А], [В] — концентрации веществ А и В, выраженные в единицах моль/л, а, b — стехиометрические коэффициенты | ||
| правило Вант-Гоффа зависимости скорости химической реакции от температуры |  гдеV1—скорость реакции при температуре T1, V2 — скорость при температуре Т2. γ температурный коэффициент скоростиреакции гдеV1—скорость реакции при температуре T1, V2 — скорость при температуре Т2. γ температурный коэффициент скоростиреакции
| ||
| уравнение Аррениуса зависимости скорости химической реакции от температуры |  Еа -энергия активации реакции Еа -энергия активации реакции
| ||
| константа равновесия для обратимой гомогенной реакции: аА + bВ = сС +dD | 
| ||
| Связь константы равновесия реакции Кc с величиной изменения стандартного изобарно-изотермического потенциала (энергии Гиббса) Dr G0T реакции | Dr G0T = -RТ lпКc | ||
| Растворы | |||
| 5.1 | Способы выражения концентрации растворов | ||
| Молярная концентрация | СМ = 
| ||
| Молярная концентрация эквивалента (нормальная концентрация) | Cэкв. = 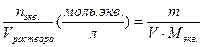
| ||
| Массовая доля | w(X) = m (X)/m(раствора) | ||
| Титр раствора | Т = 
| ||
| Молярная доля вещества | χ (Аi) =  ; процентах: χ (Аi) = ; процентах: χ (Аi) =  . 100% . 100%
| ||
| • Моляльная концентрация | •  Моляльная концентрация – это химическое количество вещества, растворенное в одном килограмме растворителя:
• Cm = Моляльная концентрация – это химическое количество вещества, растворенное в одном килограмме растворителя:
• Cm =
| ||
| 5.2 | Связь различных способов выражения концентрации растворов | ||
| Молярность - массовая доля (СМ - ω) | СМ = 
| ||
| Моляльность – массовая доля (Cm – ω) | Cm = ω.1000/M(1 – ω) =  В случае процентного выражения массовой доли:
Cm = ω%.1000/M(100 – ω%) = В случае процентного выражения массовой доли:
Cm = ω%.1000/M(100 – ω%) = 
| ||
| Молярность – нормальность (СМ– Сэкв.) | Cэкв. = Z.CM | ||
| 5.3 | Коллигативные свойства растворов | ||
| закон Генри (растворимость газа в жидкости) | ωВ = kВ · pB где ωВ – массовая доля газа в насыщенном растворе, рВ – парциальное давление газа над раствором, kВ – коэффициент пропорциональности, называемый константой Генри, характеризующий растворимость данного газа в данном растворителе | ||
| Парциальное давление насыщенного пара компонента раствора (закон Рауля) | Р = Р0· χ, где Р – парциальное давление пара компонента, Р0 – давление пара над чистым компонентом, χ – мольная доля компонента в растворе Для бинарного раствора: (Р0 – Р)/Р0 = χВ, где χВ = (1 – χ)– мольная доля растворенного вещества, (Р0 – Р)/Р0 – относительное понижение парциального давления пара пара растворителя над раствором | ||
| Повышение температуры кипения и понижение температуры замерзания раствора по сравнению с чистым растворителем(законы Рауля) | ΔТкип. = ЭТ· Сm, где ΔТкип. – повышение температуры кипения раствора по сравнению с температурой кипения чистого растворителя, Сm – моляльная концентрация раствора, ЭТ – эбулиоскопическая постоянная, зависящая только от природы растворителя, но не зависящая от природы растворенного вещества ΔТзам. = КТ. Сm, где ΔТзам. – понижение температуры замерзания раствора по сравнению с температурой замерзания чистого растворителя, Сm – моляльная концентрация раствора, КТ – криоскопическая постоянная, зависящая только от природы растворителя, но не зависящая от природы растворенного вещества | ||
| Осмотическое давление (закон Вант- Гоффа) | ПОСМ. = СМRT Или ПОСМ. = nRT/V | ||
| 5.4 | Ионная сила и рН растворов | ||
| Ионная сила растворов | μ = 
| ||
| рН и рОН растворов | рН = -lg[H+], рОН = -lg[ОH-] | ||
| 5.5 | Расчет рН растворов разных электролитов | ||
| Сильной кислоты | pH = -lg[H+] = -lgСн, где Сн или Сэк., СN –нормальная концентрация кислоты. | ||
| Сильного основания | рН = 14 + lg[OH-] = 14 + lgСo, где Сo или Сэк., СN – нормальная концентрация основания | ||
| слабой кислоты | рН= 0,5 рКк – 0,5 lgCк = -lg  = 0,5 рКк + 0,5 pCk = = 0,5 рКк + 0,5 pCk =  рКк + рКк +  рСк, где Cк - молярная концентрация слабой кислоты, pCк = -lgCк рСк, где Cк - молярная концентрация слабой кислоты, pCк = -lgCк
| ||
| cлабого основания | 7) рН = 14 – рОН = 14 – (-lg  ), так как рОН = -lg ), так как рОН = -lg 
| ||
| Гидролиз соли слабой кислоты и сильного основания | pH = 7 + 0,5 pKк + 0,5 . lgCсоли = 14 – рОН = 14 + lg 
| ||
| Гидролиз соли сильной кислоты и слабого основания | pH = 7 – 0,5 pKосн. – 0,5 . lgCсоли = -lg 
| ||
| Кислой буферной смеси | рН= -lg[H+] =-lg  = -lgKk – lg(Ck/Cсоли) = рКк – lg(Ck/Cсоли) = рКк – lgCk + lgСсоли. = -lgKk – lg(Ck/Cсоли) = рКк – lg(Ck/Cсоли) = рКк – lgCk + lgСсоли.
| ||
| Основной буферной смеси | рН = 14 + lg 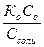 = 14 – рКо + lgCo/Ccоли = 14 – рКо + lgCo – lgCcоли = 14 – рКо + lgCo/Ccоли = 14 – рКо + lgCo – lgCcоли
| ||
| Произведение растворимости | ПР (АmBn) = [A]m · [B]n | ||
| Окислительно-восстановительные реакции | |||
| Уравнение Нернста. Электродвижущая сила (э.д.с.) гальванического элемента (ε). Зависимость константы равновесия окислительно-восстановительной реакции от э.д.с. элемента | Е(Ox/Red) = Е°(Ox/Red) +  , где
Е(Ox/Red) - искомый потенциал окислительно-восстановительной системы (в вольтах)
Е°(Ox/Red) - ее стандартный потенциал
R – универсальная газовая постоянная (8,324 Дж/моль∙К)
T – абсолютная температура
F – постоянноя Фарадея (96485 Кл/моль)
n – количество электронов передаваемых от окисленной формы к восстановленной форме
a(Ox) и a(Red) активности окисленной и восстановленной формы соответственно
или: Е = Е0 + (0,059/n) . lg ([Ox]/[Red])
э.д.с. (ε)= Екатода - Еанода
RTln Kр = nFε0 или , где
Е(Ox/Red) - искомый потенциал окислительно-восстановительной системы (в вольтах)
Е°(Ox/Red) - ее стандартный потенциал
R – универсальная газовая постоянная (8,324 Дж/моль∙К)
T – абсолютная температура
F – постоянноя Фарадея (96485 Кл/моль)
n – количество электронов передаваемых от окисленной формы к восстановленной форме
a(Ox) и a(Red) активности окисленной и восстановленной формы соответственно
или: Е = Е0 + (0,059/n) . lg ([Ox]/[Red])
э.д.с. (ε)= Екатода - Еанода
RTln Kр = nFε0 или 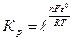
| ||
| Комплексные соединения | |||
| константа диссоциации (нестойкости) комплекса: [CoCl4]2- ↔ Co2+ + 4Cl- | 
| ||
| Константа образования (устойчивости) комплекса: Co2+ + 4Cl- ↔ [CoCl4]2- | 
| ||
|
из
5.00
|
Обсуждение в статье: Константы устойчивости комплексных соединений |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |
Популярное:
Почему двоичная система счисления так распространена?: Каждая цифра должна быть как-то представлена на физическом носителе...
Как построить свою речь (словесное оформление):
При подготовке публичного выступления перед оратором возникает вопрос, как лучше словесно оформить свою...
Почему люди поддаются рекламе?: Только не надо искать ответы в качестве или количестве рекламы...

©2015-2024 megaobuchalka.ru Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. (444)
Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

