 |
Главная |
Катализаторы не влияют на смещение химического равновесия
|
из
5.00
|
Принцип Ле-Шателье: система, находящаяся в состоянии устойчивого химического равновесия, при внешнем воздействии (изменении температуры, давления, концентрации реагирующих веществ и т. п.) стремится вернуться в состояние равновесия, компенсируя оказанное воздействие
16) Химическая кинетика. Скорость химической реакции: определение, факторы, влияющие на скорость реакции. Влияние температуры на скорость химических реакций. Энергия активации.
Химическая кинетика — раздел химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.
Скорость химической реакции- величина, характеризующая изменении концентрации веществ, участвующих в химической реакции.
Например для реакции
 скорость можно выразить так:
скорость можно выразить так:

Факторы, влияющие на скорость реакции:
Природа реагирующих веществ;
Влияние температуры на скорость химических реакций: правило ВАНТ-ГОФФА -при повышении температуры на 10 градусов скорость реакции увеличивается в 2-4 раза.
Энергия активации— Это разность энергий, при которых начинается химическая реакция.
18) Осмос. Осмотическое давление. Законы Рауля. Понижение Т замерзания и повышение Т кипения растворов. Эбулиоскопия и криоскопия.
Осмос- самопроизвольный переход растворител через полу-проницаемую мембрану из области, где концентрация растворителя больше, в область, где конц. р-ля меньше.
Давление, которое оказывает растворитель на перегородку, называется осмотическим.
 *RT
*RT
С-молярная концентрация, Т-t по Кельвину, R-газовая постоянная
Законы Рауля:
- Парциальное давлениенасыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.

- Повышение температуры кипениябесконечно разбавленных растворов нелетучих веществ не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора
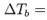 Е*СmЕ-эбулиоскопическая постоянная, Сm-моляльная концентрация в-ва
Е*СmЕ-эбулиоскопическая постоянная, Сm-моляльная концентрация в-ва
- Понижение температуры кристаллизации бесконечно разбавленных растворов не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора.
 *СmК-криоскопическаяconst для данного в-ва
*СmК-криоскопическаяconst для данного в-ва
Криоскопия —метод исследования растворов, в основе которого лежит измерение понижения температуры замерзанияраствора по сравнению с температурой замерзания чистого растворителя.
Эбулиоскопия —метод исследования растворов, основанный на измерении повышения их температуры кипения по сравнению с чистым растворителем.
19) Диссоциация воды. Ионное произведение воды. Водородный показатель. Среды водных растворов электролитов. Индикаторы
 ;
;  , где [ ] - концентрация;
, где [ ] - концентрация;  - const(K)
- const(K)
Это и есть ионное произведение воды которое показывает, что произведение концентрации ионов есть величина постоянная.
Для чистой воды температура 25̊ 

pH=  - водородный показатель (характеризует концентрацию ионов водорода и кислотность среды)
- водородный показатель (характеризует концентрацию ионов водорода и кислотность среды)
pH=7 – нейтральная
pH>7 - щелочная 
pH<7 - кислая 
Кислотно-основные индикаторы (органические вещества) позволяют качественно определять рН среды(Метиловый оранжевый, Лакмус, Фенолфталеин).
20) Гидролиз солей. Типы солей по их отношению к гидролизу. Степень гидролиза. Факторы, влияющие на гидролиз
Гидролизом называется взаимодействие ионов соли с молекулами воды, приводящее к смещению ионного равновесия воды за счет образования слабого электролита. В результате гидролиза соли в растворе появляется некоторое избыточное количество ионов Н+ или ОН-, придающее раствору кислые или основные свойства, что обнаруживают с помощью индикаторов
Раствор соли, образованной сильным основанием и сильной кислотой, гидролизу не подвергается, рН = 7.
Соль, образованная сильной кислотой и катионом слабого основания, при гидролизе проявляет кислую реакцию раствора (гидролиз по катиону): CuCl2 + Н2О = CuOHCl + HCl, Cu2+ + Н2О = CuOH+ + Н+
Соль, образованная сильным основанием и анионом слабой кислоты, при гидролизе имеет щелочную реакцию (гидролиз по аниону): Na2CO3 + Н2О = NaHCO3 + NaOH, CO32− + H2O = HCO3− + OH−
У хорошо растворимых солей, образованных слабыми кислотами и слабыми основаниями, гидролиз протекает одновременно по катиону ипо аниону: Al2S3 + 6H2O = 2Al(OH)3 + 3H2S, 2Al3+ + 3S2− + 6Н2О = 2Al(OH)3(осадок) + ЗН2S(газ)
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр). α = (Сгидр/Собщ)•100 %
где Сгидр — число молей гидролизованной соли, Собщ — общее число молей растворённой соли.
Чем выше степень гидролиза соли выше, тем слабее кислота или основание.
Является количественной характеристикой гидролиза.
Факторы:константа гидролиза, концентрация, температура
21)Окислительно-восстановительные реакции. Степень окисления. Окислитель. Восстановитель. Процесс окисления. Процесс восстановления. Правила определения степени окисления
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называется окислительно-восстановительными.

Степенью окисления называется формальный заряд атома в молекуле, вычисленный исходя из предположения, что все связи атомов в молекуле ионные.
1.Окислением называется процесс отдачи электронов атомом, молекулой или ионом. При окислении степень окисления повышается.
2.Востановлением называется процесс присоединения электронов атомами, ионом или молекулой при восстановлении степень окисления понижается.
3.Атомы, ионы или молекулы, отдающие электроны, называются восстановителями.Во время реакции они окисляются. Атомы или ионы, присоединяющие электроны, называются окислителями. Во время реакции они восстанавливаются
 -окисление; ок-ль
-окисление; ок-ль  .
.
4.Окисление всегда сопровождается восстановлением. Восстановление всегда связанно с окислением. Число отдаваемых восстановителем электронов равно числу принимаемых электронов.
Для вычисления степени окисления элемента в соединении следует исходить из следующих положений:1) степени окисления элементов в простых веществах принимаются равными нулю;
2) алгебраическая сумма степеней окисления всех атомов в соединении (с учетом числа атомов), равна нулю;
3) постоянная степень окисления в соединениях проявляют щелочные металлы (+1), металлы главной подгруппы II группы, цинк (+2), алюминий (+3) и кадмий (+2);
4) водород проявляет степень окисления +1 во всех соединениях, кроме гидридов металлов NaH, CaH2 и т.п., где его степень окисления равна -1;
5) степень окисления кислорода в соединениях равна -2, за исключением пероксидов (-1) и фторида кислорода OF2 (+2).
22) Типы окислительно-восстановительных реакций
Все окислительно-восстановительные процессы можно разделить на три типа: межмолекулярные, внутримолекулярные и диспропорционирования.
В межмолекулярных реакциях окислительные функции выполняют одни вещества, а восстановительные – другие. Например, в реакции H2S + Cl2 = S + 2HCl электроны от восстановителя – молекулы сероводорода – переходят к окислителю – молекуле Cl2.
В реакциях внутримолекулярногоокисления-восстановления одна часть молекулы – окислитель, другая – восстановитель. Простейшими примерами могут служить реакции термического разложения вещества: 
Реакции диспропорционирования (самоокисления-самовосстановления) протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента. Они характерны для соединений или простых веществ, состоящих из промежуточных степеней окисления данного элемента: 
Важнейшие окислители и восстановители
| окислители | восстановители |
| Металлы,водород, уголь | Перманганат калия(KMnO4) |
| Окись углерода (II) (CO) | оксид марганца (IV) (MnO2) |
| Сероводород (H2S) | хромат калия (K2CrO4) |
| оксид серы (IV) (SO2) | Азотная кислота (HNO3) |
| сернистая кислота H2SO3 и ее соли | Серная кислота (H2SO4) конц |
| Катионы металлов в низших степенях окисления: SnCl2, FeCl2, MnSO4, Cr2(SO4)3 | Оксид меди(II) (CuO), оксид свинца(IV) (PbO2), оксид серебра (Ag2O) |
| Азотистая кислота HNO2, аммиак NH3 | Хлорид железа(III) (FeCl3) |
| оксид азота(II) (NO) | Бертоллетова соль (KClO3) |
| Катод при электролизе | Анод при электролизе |
23) Электрохимия. Понятие об электродном потенциале. Факторы, влияющие на значение потенциала электрода. Двойной электрический слой.
Процессы взаимного превращения химической и электрической форм энергии называют электрохимическими. Электрохимические процессы подразделяют на процессы превращения химической энергии в электрическую (гальванический элемент) и электрической энергии в химическую (электролиз).
Электро́дныйпотенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита). Характеризует химическую активность металла в растворе.
Факторы: природа (чем активнее металл, тем большим потенциалом он обладает), концентрация ионов металла (чем больше концентрация ионов, тем меньше знак потенциала), температура (чем больше температура, тем меньше потенциал)
Двойной электрический слой (межфазный) (ДЭС) — слой ионов, образующийся на поверхности частиц в результате адсорбции ионов из раствора, диссоциации поверхностного соединения или ориентирования полярных молекул на границе фаз. Ионы, непосредственно связанные с поверхностью, называются потенциалоопределяющими. Заряд этого слоя компенсируется зарядом второго слоя ионов, называемых противоионами.
24)Стандартный электро́дСтандартный электродный потенциал
Стандартный электро́д (водородный) — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах.
Водородный электрод (ВЭ) представляет собой пластинку или проволоку из металла, хорошо поглощающего газообразный водород (обычно используют платину или палладий), насыщенную водородом (при атмосферном давлении) и погруженную в водный раствор, содержащий ионы водорода. Потенциал пластины зависитот концентрации ионов Н+ в растворе.
Водородный электрод является эталоном, относительно которого ведется отсчет электродного потенциала определяемой химической реакции. При давлении водорода 1 атм., концентрации протонов в растворе 1 моль/л и температуре 298 К потенциал ВЭ принимают равным 0 В. При сборке гальванического элемента из ВЭ и определяемого электрода, на поверхности платины обратимо протекает реакция:
2Н+ + 2e− = H2 то есть, происходит либо восстановление водорода, либо его окисление — это зависит от потенциала реакции, протекающей на определяемом электроде.
Стандартный электродный потенциал- это потенциал, измеренный в стандартных условиях по отношению к стандартному электроду.
Электродный потенциал зависит от: природы металла: чем выше активность металла, тем легче он растворяется и тем отрицательней его потенциал, и от активности иона.
25) Ряд стандартных электродных потенциалов и следствия из него. Типы электродов.
(ряд активности металлов, ряд напряжений)
Разность потенциалов стандартного водородного электрода и какого-нибудь другого электрода, измеренная при стандартных условиях, называется стандартным электродным потенциалом и обозначается E°
1стВосстановленная форма 2стЧисло отданных електронов 3стОкисленная форма 4стСтандартный электродный потенциал, В
Li 1e Li+ -3,05
K 1e K+ -2,925
Rb 1e Rb+ -2,925
Cs 1e Cs+ -2,923
Ba 2e Ba2+ -2,91
Sr 2e Sr2+ -2,89
Ca 2e Ca2+ -2,87
Na 1e Na+ -2,71
Mg 2e Mg2+ -2,36
Al 3e Al3+ -1,66
Mn 2e Mn2+ -1,18
Zn 2e Zn2+ -0,76
Cr 3e Cr3+ -0,74
Fe 2e Fe2+ -0,44
Cd 2e Cd2+ -0,40
Co 2e Co2+ -0,28
Ni 2e Ni2+ -0,25
Sn 2e Sn2+ -0,14
Pb 2e Pb2+ -0,13
Fe 3e Fe3+ -0,04
H2 2e 2H+ 0,00
Cu 2e Cu2+ 0,34
Cu 1e Cu+ 0,52
2Hg 2e Hg2 2+ 0,79
Ag 1e Ag+ 0,80
Hg 2e Hg2+ 0,85
Pt 2e Pt2+ 1,20
Au 3e Au3+ 1,50
· Типы электродов.
· Электроды 1 рода :представляет собой пластинку, изготовленную из простого вещества (металла или полупроводника) и погруженную в раствор, содержащий его ионы.
Ме электроды 
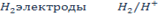
· Электроды 2 рода :представляют собой металл, покрытый слоем его малорастворимого соединения (соли, оксиды, гидроксиды) и погруженный в раствор, содержащий анионы, одноименные с анионами труднорастворимого соединения.
Хлорсеребряный электрод Ag, AgCl / KCl
Каломельный электрод Hg, 
· Окислительно-восстановительные :чем выше  , тем более сильным окислителем является ион высшей степени окисления
, тем более сильным окислителем является ион высшей степени окисления
26) Определение ЭДС гальванического элемента. Уравнение Нернста
Устройства, в которых энергия химической реакции выделяется в виде электрической, называют гальваническими элементами.
Ур-е Нернста:
 E0 - стандартный электронный потенциал;
E0 - стандартный электронный потенциал;  - валентность металла
- валентность металла
ЭДС г\эл: ЭДС=Ек-Еа. Катод это электрод с большим значением электрического потенциала. Анод это электрод с меньшим значением электрического
27)Гальванический элемент Даниэля-Якоби.. Электродвижущая сила гальванического элемента.
Гальванический элемент это прибор для превращения химической энергии в электрическую. При замкнутой цепи в гальваническом элементе протекаю следующие процессы: 1. Реакция окисления цинка:  . Процесс окисления называется анодным, а электрод анодом и заряжен отрицательно. 2.Реакция восстановления катионов меди:
. Процесс окисления называется анодным, а электрод анодом и заряжен отрицательно. 2.Реакция восстановления катионов меди: 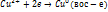 Процесс восстановления называют катодным, а электрод катодом и заряжен положительно. 3. Движение электронов по внешнему проводнику. 4.Движение ионов в растворе: анионов к аноду и катионов к катоду.
Процесс восстановления называют катодным, а электрод катодом и заряжен положительно. 3. Движение электронов по внешнему проводнику. 4.Движение ионов в растворе: анионов к аноду и катионов к катоду.
Схема г\эл: 


(27)Концентрационный гальванический элемент.
Это элемент построенный из электродов одного и того же металла, погруженных в растворы собственных солей с разной концентрацией катионов металла.
Cu/Cu
CuSO4 CuSO4

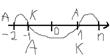
(27)Гальванический элемент с одним электролитом.


_____________________________________

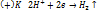
28) Электролиз расплавов и водных растворов. Последовательность процессов на катоде и аноде.
Электролиз - это окислительно-восстановительный процесс протекающий при прохождении электрического тока через раствор или расплав электролита. При электролизе происходит превращение электрической энергии в химическую. Ячейка для электролиза называется электролизером, состоит из двух электродов и электролита. Электрод, на котором идет реакция восстановления(катод) подключен к отрицательному катоду источника тогда, катод заряжен отрицательно. Электрод на котором протекает реакция окисления(анод) подключен к положительному источнику тока.
Электролиз расплавов.
NaCl 800̊ C

(+)A;  |1
|1
 |2
|2
__________________________

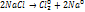
Эта реакция протекает несамопроизвольно для нее энергия поступает от внешнего источника тока.
Расплав KOH:

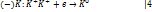
_________________________________


(28)Электролиз водных растворов электролитов. Последовательность восстановительных процессов на катоде. Последовательность окислительных процессов на аноде.
Электролиз водных растворов электролитов: под действием электрического тока электролизу подвергаются молекулы воды и электролита.

 1
1
____________________________________


Последовательность восстановительных процессов на катоде:
1. Катионы металлов со стандартным электродным потенциалом, большим, чем у водорода, расположены в ряду напряжений после него: Cu2+, Hg22+, Ag+, Pt2+, ..., до Pt4+. При электролизе они почти полностью восстанавливаются на катоде и выделяются в виде металла.2. Катионы металлов с малой величиной стандартного электродного потенциала (металлы начала ряда напряжений Li+, Na+, K+, Rb+, ..., до Al3+ включительно). При электролизе на катоде они не восстанавливаются, вместо них восстанавливаются молекулы воды.
3. Катионы металлов со стандартным электродным потенциалом меньшим, чем у водорода, но большим, чем у алюминия (Mn2+, Zn2+, Cr3+, Fe2+, ..., до H). При электролизе эти катионы, характеризующиеся средними величинами электроноакцепторной способности, на катоде восстанавливаются одновременно с молекулами воды.На катоде легче всего разряжаются катионы того металла, которому отвечает наиболее положительный потенциал. Так, например, из смеси катионов Cu2+, Ag+ и Zn2+ при достаточном напряжении на клеммах электролизера вначале восстанавливаются ионы серебра (E0=+0,79 В), затем меди (E0=+0,337 В) и, наконец, цинка (E0=–0,76 В).
Последовательность окислительных процессов на аноде:
На аноде могут образовываться следующие продукты:
а) при электролизе растворов, содержащих анионы F-, SО42- , NO3-, РO43-, ОН- выделяется кислород;
б) при окислении галогенид-ионов выделяются свободные галогены ;
в) при окислении анионов органических кислот происходит процесс:
2RCOO- - 2е → R-R + 2СО2.
2. При электролизе растворов солей , содержащих ионы , расположенные в ряду напряжений левее Аl3+, на катоде выделяется водород; если ион расположен правее водорода, то выделяется металл.
3. При электролизе растворов солей, содержащих ионы, расположенные между Аl3+ и Н+ на катоде могут протекать конкурирующие процессы как восстановления катионов, так ивыделения водорода.
29)Электролиз с нерастворимыми (инертнами) и растворимыми анодами.
Анодные процессы зависят от природы электролита и материала, из которого сделан анод.
В зависимости от природы анода различают растворимые (активные) инерастворимые (инертные) аноды. В случае электролиза с растворимым анодом происходит окисление анода с образованием соответствующих ионов металла. Анод изготовлен из того металла, ионы которого присутствуют в растворе. Например, если проводить электролиз раствора сульфата меди (II) с медными электродами, то на катоде будет идти восстановление ионов Cu2+ из раствора: Cu2+ + 2e →Cu0, а анод будет окисляться, посылая ионы Cu2+ в раствор: Cu0 - 2e→Cu2+.
В результате происходит перенос ионов Cu2+ с анода на катод. Электролиз с растворимым анодом применяется для очистки металлов.
Если анод изготовлен из инертного материала (графита, угля, платины и др.), то на его поверхности происходит окисление либо кислотных остатков, либо молекул воды. При электролизе водных растворов солей бескислородных кислот, а также растворов щелочей на аноде происходит окисление кислотных остатков (Cl–, Br–, J–, S2–, OH–):
2Сl– - 2e→Cl2
4OH– - 4e → 2H2O + O2
При электролизе водных растворов солей кислородсодержащих кислот и HF анионы (SO42– , NO3–, PO43– , F– и др.) не окисляются, а на аноде происходит окисление молекул воды с образованием кислорода:
2Н2О - 4e→ О2 + 4Н+
30)Закон Фарадея. Выход по току. Применение электролиза.
Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
 где: m — масса осаждённого на электроде вещества в граммах; Q — полный электрический заряд, прошедший через вещество; F = 96 485,33(83) Кл·моль−1 — постоянная Фарадея; M — молярная масса вещества (Например, молярная масса воды H2O = 18 г/моль); z — валентное число ионов вещества (число электронов на один ион).
где: m — масса осаждённого на электроде вещества в граммах; Q — полный электрический заряд, прошедший через вещество; F = 96 485,33(83) Кл·моль−1 — постоянная Фарадея; M — молярная масса вещества (Например, молярная масса воды H2O = 18 г/моль); z — валентное число ионов вещества (число электронов на один ион).
Выходом по току в гальванотехнике называют выраженное в процентах отношение количества фактически пропущенного через электролит заряда Qf к теоретически необходимому Qt для осуществления фактически наблюдаемого массопереноса mf.

Иногда выход по току рассчитывается как отношение массы при фактическом массопереносе mf к теоретическому массопереносу mt, рассчитанному по 1-му закону Фарадея:

Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации). Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
31) Металлы. Общие свойства металлов. Ряд активности металлов и следствия из него.
Металлы- это элементы, проявляющие в своих соединениях только положительные степени окисления, и в простых веществах которые имеют металлические связи. Металлическая связь - это химическая связь в металлах, осуществляемая за счет валентных электронов металла, относительно свободно перемещаться по всему образцу металла (электронный газ). В узлах кристаллической решетки в твердом состоянии находятся положительно заряженные ионы металла (часть атомов остается в нейтральном состоянии).
Свойства:
· Пластичность - способность изменять форму при ударе, вытягиваться в проволоку, прокатываться в тонкие листы. В ряду - Au, Ag, Cu, Sn, Pb, Zn, Fe уменьшается.
· Блеск, обычно серый цвет и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл квантами света.
· Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. В ряду - Ag, Cu, Al, Fe уменьшается. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение "электронного газа".
· Теплопроводность. Закономерность та же. Обусловлена высокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность - у висмута и ртути.
· Твердость. Самый твердый - хром (режет стекло); самые мягкие - щелочные металлы - калий, натрий, рубидий и цезий - режутся ножом.
· Плотность. Она тем меньше, чем меньше атомная масса металла и чем больше радиус его атома (самый легкий - литий (r=0,53 г/см3); самый тяжелый - осмий (r=22,6 г/см3).Металлы, имеющие r < 5 г/см3 считаются "легкими металлами".
· Температуры плавления и кипения. Самый легкоплавкий металл - ртуть (т.пл. = -39°C), самый тугоплавкий металл - вольфрам (t°пл. = 3390°C).Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже - низкоплавкими.
· Все металлы являются восстановителями. Для металлов главных подгрупп восстановительная активность (способность отдавать электроны) возрастает сверху вниз и справа налево.
Ряд активности:Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Zn→Cr→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
Металлы от Li до Al активные, после Al до H средней активности, после Н малоактивные. Чем выше металл тем химически активнее. Все металлы стоящие до водорода вытесняют водород из без кислородных кислот HCl и H2SO4(р). Более активные металлы вытесняют менее активные металлы из растворов их солей.
32)Взаимодействие металлов с щелочами. Взаимодействие металлов с кислотами. Взаимодействие металлов с водой.
Со щелочами реагируют те металлы оксиды и гидроксиды которых обладают амфотерными свойствами (Al,Zn,Sn,Cr,Pb,Be,.... .)

С водой взаимодействую металлы оксиды и гидроксиды которых растворимы в воде.(щелочные и щелочноземельные металлы)

33)Коррозия металлов. Классификация коррозийных процессов.
Коррозия- самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. В общем случае это разрушение любого материала, будь то металл или керамика,дерево или полимер. Причиной коррозии служит термодинамическая неустойчивость конструкционных материалов к воздействию веществ, находящихся в контактирующей с ними среде. Пример — кислородная коррозия железа в воде:

Гидроксид железа Fe(OН)3 и является тем, что называют ржавчиной.
Коррозионные процессы классифицируют по механизму взаимодействия металлов с внешней средой; по виду коррозионной среды и условиям протекания процесса; по характеру коррозионных разрушений; по видам дополнительных воздействий, которым подвергается металл одновременно с действием коррозионной среды.
34)Химическая коррозия. Электрохимическая коррозия. Коррозия под действием блуждающих токов.
Химическая коррозия — это процесс взаимодействия металла с коррозионной средой, при котором окисление металла и восстановление окислительного компонента среды протекают единовременно в одном акте. Продукты взаимодействия пространственно не разделены.
Электрохимическая коррозия — это процесс взаимодействия металла с коррозионной средой (раствором электролита), при котором ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала.
Блуждающие токи или токи, рассеянные в проводящей среде, возникают в результате различных природных явлений или создаются промышленными электрическим установками, использующими проводящею среду (землю, морскую воду) в качестве токопровода.
Источниками естественных блуждающих токов являются вариации магнитного поля Земли, грозовые разряды, перемещения земных пород и другие природные явления. Максимальная напряженность естественных электрических полей не превышает 150мВ/км, поэтому очевидно, что они не представляют практической коррозионной опасности.
Промышленные блуждающие токи создаются линиями электротранспорта, заземлителями постоянного тока, системами катодной защиты и другими электрическими установками. Они могут быть очень значительными по величине и наносить серьезный ущерб металлическим сооружениям, находящимся в зоне их действия.
Интенсивность коррозии объектов в поле блуждающих токов определяется напряженностью поля, удельным сопротивлением среды, состоянием изоляционного покрытия объекта, взаимным расположением объекта и источника тока.
35)Защитные покрытия(катодные, анодные, металлические, неметаллические, химические).
Металлические защитные покрытия наносятся на поверхности (металл, стекло, керамика, пластмассы и др.) для защиты их от коррозии, придания твердости, электропроводности, износостойкости и в декоративных целях.
По способу защиты металлические защитные покрытия разделяют на катодные и анодные. Характер такой защиты от коррозии обусловлен тем, что металлопокрытие, по отношению к покрываемому изделию, может быть анодом или катодом (зависит от электрохимической характеристики металла покрытия).Электрохимическую защиту от коррозии осуществляют только анодные покрытия. На поверхности защищаемого изделия, при наличии влаги в окружающей среде, образуются замкнутый гальванический элемент. Металл с более электроотрицательным электрохимическим потенциалом (покрытие) будет играть роль анода, при этом подложка - катод.Вследствии работы гальванического элемента металл, являющийся анодом, будет под воздействием окружающей среды постепенно разрушаться, этим самым защищая изделие.При защите от коррозии с помощью анодных покрытий важным аспектом можно считать то, что металлопокрытие будет защитным даже при наличии на нем пор и царапин. Хорошим примером анодного покрытия является цинковое покрытие не железе.Защита от коррозии катодными покрытиями осуществляется реже, так как катодное покрытие защищает изделие лишь механически. Катодное защитное покрытие имеет более положительный электродный потенциал. При этом основной металл изделия является анодом и при подводе к нему влаги начнется интенсивное его растворение. Именно поэтому катодное покрытие должно быть сплошным, без малейших признаков пор и, желательно, равномерное, относительно большой толщины. Примером катодного покрытия служит оловянный или медный сплошный слой на железе.
Неметаллические защитные покрытия применяются для изоляции металлических изделий, их защиты от воздействия внешней среды (влаги), придания красивого вида.Неметаллические защитные покрытия принято разделять на лакокрасочные, полимерные, покрытия резинами, смазками, силикатными эмалями, пастами.
(35)Воздействие на среду с целью снижения ее коррозийной активности.
Наиболее агрессивные среды – вода и почва. Снижение коррозионной угрозы для стали, железа, латуни заключается в удалении растворённых в воде O2 и СО2. Физически это осуществляется продувкой инертным газом, химически – обработкой восстановителем или пропусканием через слой стальных стружек. Так же зачастую требуется очистить воду от возбудителей локальной коррозии, например, хлоридов. Так же добавляют небольшие объёмы ингибиторов коррозии, соединений, которые её замедляют (фосфаты, силикаты, бензоат натрия – анодные ингибиторы ингибиторы; сульфаты цинка, бикарбонат натрия – катодные ингибиторы). Анодные и катодные ингибиторы эффективнее использовать вместе. Ещё один важный класс ингибиторов – пассиваторы. Они смещают электродный потенциал металла в положительную область и таким образом делают его пассивным. Чаще всего это благородные металлы либо окислители пероксидного типа. Если район промышленный, важным фактором при развитии самопроизвольного разрушения металла являются показатели выбросов в среду сажи, SO2,CO2, H2S, NH3 и т.п. Самый опасный из них – SO2. На поверхности металла под воздействием влажной среды он переходит в серную кислоту. Единственный способ снижения агрессивности такой среды – устранение выбросов, очистка воздуха.
(35)Изменение состава или структуры металла, ведущие к повышению их коррозийной стойкости.
Леги́рование — добавление в состав материалов примесей для изменения (улучшения) физических и/или химических свойств основного материала. Легирование является обобщающим понятием ряда технологических процедур, различают объёмное (металлургическое) и поверхностное (ионное, диффузное и др.) легирование.
В разных отраслях применяются разные технологии легирования.
В металлургии легирование производится в основном введением в расплав или шихту дополнительных веществ (например, в сталь — хрома, никеля, молибдена), улучшающих механические, физические и химические свойства сплава. Для изменения различных свойств (повышения твёрдости, износостойкости, коррозионной стойкости и т. д.) приповерхностного слоя металлов и сплавов применяются также и разные виды поверхностного легирования. Легирование проводится на различных этапах получения металлического материала с целями повышения качества металлургической продукции и металлических изделий.
(35)Электрохимическая защита: протекторная, катодная, анодная, электродренажная.
Электрохимическая защита основана на том, что, сдвигая потенциал металла пропусканием внешнего тока, можно изменять скорость его коррозии. Однако для наиболее распространенного вида коррозии металлов с кислородной деполяризацией в условиях ограниченного доступа кислорода наложение внешнего катодного тока эффективно для предотвращения коррозии.
|
из
5.00
|
Обсуждение в статье: Катализаторы не влияют на смещение химического равновесия |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

