 |
Главная |
Материальный и тепловой баланс абсорбции
|
из
5.00
|
При составлении материального баланса концентрации компонента в газовой и жидкой фазах выражают в относительных концентрациях: Y, кг/кг, инертного газа, Х, кг/кг, растворителя:
 и
и  , (5)
, (5)
где Mк, Muн,,Мр – молекулярные массы растворяемого компонента, инертного газа и растворителя.
Уравнение материального баланса имеет следующий вид:
 , (6)
, (6)
где М – количество поглощаемого компонента в единицу времени; Gин – расход газовой фазы, проходящей через аппарат; Lo – расход абсорбента; Yн, Yк, Хк, Хн– концентрации компонента в газовой и жидкой фазе соответственно.
На практике конечную концентрацию компонента в растворе необходимо максимально увеличивать, т. к. это позволяет снизить расход абсорбента, а конечную концентрацию компонента в газе максимально понижать, увеличивая тем самым полноту извлечения. При этом следует учитывать, что при приближении к максимальной возможной конечной концентрации раствора и максимальному извлечению компонента из газа, т. е. к равновесному состоянию системы, движущая сила процесса стремится к нулю.
Это приводит к уменьшению скорости процесса, увеличению размеров аппарата и неоправданным затратам. Поэтому на практике не допускают равновесных состояний, а конечные концентрации компонента в газовой и жидкой фазах определяют технико-экономическими расчетами.
 На рис. 1 представлена противоточная схема процесса абсорбции.
На рис. 1 представлена противоточная схема процесса абсорбции.
Особый интерес для оценки энергетических затрат представляет тепловой баланс процесса. Теплота, выделяемая при абсорбции, существенно влияет на температуру процесса, поэтому необходимо учитывать зависимость равновесного состояния от температуры.
Тепловой баланс абсорбера может быть записан уравнением
 , (7)
, (7)
где tн, tк, θн, θк – температуры жидкости и газа на входе в аппарат и на выходе; сг и сж – удельные теплоемкости жидкости и газа; Qт – тепловые потери и охлаждение абсорбента; Qабс– теплота, выделяющаяся при абсорбции.
При отсутствии отвода теплоты (Qт = 0) и допущении, что все выделившееся в результате абсорбции тепло остается в абсорбере, т. е. при условии tн = tк, нагрев становится максимальным, тогда
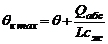 , (8)
, (8)
 , (9)
, (9)
где Ф – теплота растворения газа.
Теплота при абсорбции паров веществ равна сумме теплоты парообразования и теплоты растворения жидкого целевого компонента в поглотителе Фж. Если жидкая фаза – идеальный раствор, то Фж=0. Проводя расчеты, необходимо сравнить предельные значения насыщения поглотителя, достигаемые при температурах θн и θкmax.
Составляя тепловой баланс, допускают, что теплота абсорбции полностью идет на нагрев абсорбента. Учитывая, что теплоемкость газа значительно меньше теплоемкости жидкости, можно пренебречь также изменением температуры газовой фазы, и тепловой баланс абсорбера примет следующий вид:
 , (10)
, (10)
где Lн, Lк – расход жидкой фазы на входе и выходе из аппарата, кг/с, с учетом количества поглощенного вещества; сни ск – удельная теплоемкость жидкой фазы на входе и выходе из абсорбера, Дж/(кг×оС).
Удельная теплоемкость рассчитывается по правилу аддитивности. При незначительных изменениях концентрации абсорбтива в газовой фазе можно пренебречь изменением массы абсорбента и удельной теплоемкости жидкой фазы и принять: Lн=Lк =L и сн=ск=С.
Qабс рассчитывают по формуле:
 , (11)
, (11)
где qабс – удельная теплота абсорбции, Дж/кг, жидкой фазы.
Тепловой баланс следует представить так:
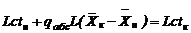 , (12)
, (12)
тогда
 , (13)
, (13)
где с – средняя удельная теплоемкость жидкой фазы, Дж/кг, которая определяется как среднее арифметическое величин сн и ск..
При незначительном изменении температуры жидкой фазы (tн=tк) абсорбцию можно считать изотермической. Сильное изменение температуры жидкости вызывает смещение равновесного состояния системы, что следует учитывать при построении равновесной линии. Увеличение температуры жидкой фазы приводит к уменьшению движущей силы процесса. Для сохранения стабильных характеристик процесса в таких случаях необходимо поддерживать постоянную температуру абсорбента путем отвода теплоты, выделяющейся в процессе в специальных охлаждающих устройствах.
Кинетика абсорбции
Процесс абсорбции (рис. 2) характеризуют тремя стадиями:
– подходом молекул абсорбируемого компонента из основной массы газа непосредственно к поверхности раздела фаз;
– растворением молекул газа в поверхностном слое жидкости;
 – переходом растворенных молекул из поверхностного слоя в основную массу жидкости.
– переходом растворенных молекул из поверхностного слоя в основную массу жидкости.
Движущая сила первой стадии – разность концентраций абсорбируемого компонента в основной массе газа у и в газе, непосредственно контактирующем с жидкостью  , причем
, причем  . Этот переход компонента имеет диффузионную природу, его скорость выражается уравнением
. Этот переход компонента имеет диффузионную природу, его скорость выражается уравнением
 , (14)
, (14)
где  – количество поглощаемого компонента, переносимого в единицу времени из газа к поверхности жидкости;
– количество поглощаемого компонента, переносимого в единицу времени из газа к поверхности жидкости;  – коэффициент массоотдачи в газовой фазе;
– коэффициент массоотдачи в газовой фазе; 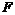 – площадь поверхности соприкосновения фаз (поверхность жидкости).
– площадь поверхности соприкосновения фаз (поверхность жидкости).
Вторая стадия процесса абсорбции (растворение) идет с высокой скоростью и не влияет на суммарную скорость процесса, лимитируемую наиболее медленной стадией. Принимают, что на поверхности раздела фаз существует состояние равновесия и выполняется равенство
 . (15)
. (15)
Движущая сила третьей стадии – разность концентраций растворенного газа в поверхностном слое  и в основной массе жидкости х, аналогично первой стадии скорость процесса описывается выражением
и в основной массе жидкости х, аналогично первой стадии скорость процесса описывается выражением
 , (16)
, (16)
где М2 – количество поглощаемого компонента, переносимого в единицу времени с поверхности жидкости в основную ее массу, кг/(м2×с);  – коэффициент массоотдачи в жидкой фазе, кг/(с×м2×мол. доля).
– коэффициент массоотдачи в жидкой фазе, кг/(с×м2×мол. доля).
Для установившегося процесса справедливо М1=М2=М. В противном случае (М1  М2) концентрация абсорбируемого компонента будет возрастать или уменьшаться на границе раздела фаз до тех пор, пока не будет достигнуто равновесие и М1=М2 .
М2) концентрация абсорбируемого компонента будет возрастать или уменьшаться на границе раздела фаз до тех пор, пока не будет достигнуто равновесие и М1=М2 .
При равновесии, учитывая уравнения (14) и (15), получим
 , (17)
, (17)
 . (18)
. (18)
Сложим левые и правые части этих уравнений и получим уравнение массопередачи
 . (19)
. (19)
В уравнении (19) у – mх = у – у/ =  у – разность концентраций компонента в газе и соответствующей равновесной концентрации – движущая сила процесса. При у®у/
у – разность концентраций компонента в газе и соответствующей равновесной концентрации – движущая сила процесса. При у®у/  у
у  0 система газ–жидкость приближается к состоянию равновесия.
0 система газ–жидкость приближается к состоянию равновесия.
В формуле (19) множитель  представляет коэффициент массопередачи, кг/(с×м2×мол. доля).
представляет коэффициент массопередачи, кг/(с×м2×мол. доля).
Выражение (19) целесообразно представить в следующем виде:
М = КyF(у – mх) = КyF(у – у/). (20)
Коэффициент массопередачиКy характеризует скорость процесса. Численно он равен количеству газа, абсорбируемому жидкостью в единицу времени на площади поверхности контакта 1 м2 при разности концентраций у – у/ =1.
Общее сопротивление массопередачи–  .
.
Для газов с малой растворимостью величина m достаточно велика. В этом случае в выражении (19) величиной  можно пренебречь, и тогда
можно пренебречь, и тогда  , при этом
, при этом
 . (21)
. (21)
У малорастворимого газа различие в концентрациях у поверхности и в основном потоке невелико, следовательно, можно принять, что у  у /
у /  mx. Тогда уравнение (22) запишем как
mx. Тогда уравнение (22) запишем как
 . (22)
. (22)
При малой растворимости газа, как это следует из (22), скорость абсорбции определяется скоростью массоотдачи в жидкой фазе. Для хорошо растворимых газов величина m мала. Поэтому в выражении (19) можно пренебречь величиной m/  по сравнению с 1/
по сравнению с 1/  . Тогда Ку»
. Тогда Ку»  и
и  .
.
В данном случае на скорость абсорбции преимущественно влияет скорость диффузии в газовой фазе.
Для повышения скорости абсорбции на практике зачастую достаточно интенсифицировать ту или иную стадию. У газов со средними значениями растворимости необходимо учитывать скорость первой и третьей стадии процесса.
|
из
5.00
|
Обсуждение в статье: Материальный и тепловой баланс абсорбции |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

