 |
Главная |
Реакции аминов с азотистой кислотой
|
из
5.00
|
Эта реакция нами почти не упоминалась, а потому есть все шансы встретить ее в ЕГЭ. Реакция используется для различения первичных, вторичных и третичных аминов. Запомните:
1) первичные и вторичные амины реагируют с азотистой кислотой (HNO2), а третичные амины – нет.
Первичные амины при этом превращаются в спирты и дают газ (NO), а вторичные амины превращаются в маслянистую желтоватую жидкость (нитрозосоединение). Надо знать уравнения этих реакций.
Разница между реакциями полимеризации и поликонденсации
Обе эти реакции приводят к образованию полимеров. Но:
1) при полимеризации образуется только один продукт – полимер и реакция идет за счет соединения мономеров раскрывающимися пи-связями (кратными связями). Пример: полимеризация алкенов (например, этилена в полиэтилен), алкинов;
2) при поликонденсации помимо полимера образуется также низкомолекулярный продукт (обычно – вода) и реакция НЕ за счет пи-связей, а за счет взаимодействия функциональных групп и других активных связей. Пример: поликонценсация моносахаридов в полисахариды (например, глюкозы в крахмал), поликонденсация аминокислот в полипептиды и белки, поликонценсация фенола и формальдегида в фенолформальдегидную смолу.
Некоторые вещества могут вступать в обе эти реакции. Например, формальдегид может полимеризоваться за счет пи-связей (получается полимер – параформ), а может поликонденсироваться с фенолом (получается фенолформальдегидная смола).
Еще про полимеризацию надо знать такой факт: возможна так называемая сополимеризация, когда соединяются не однотипные молекулы, а разные, и получается полимер, в котором чередуются элементарные звенья разных мономеров. Пример: бутадиен-стирольный каучук (совместный полимер бутадиена и стирола).
Свойства сложных эфиров
Как ни странно, свойства сложных эфиров вызывают сложность, хотя ничего здесь особенного нет. Просто эта тема мало отработана. В общем надо помнить, что эфиры подвергаются гидролизу (обратимо) и щелочному гидролизу (необратимо). То есть, например, идут такие реакции:
C3H7СOOC2H5 + H2O ↔ (кстати, что получится?)
C3H7СOOC2H5 + NaOH → (кстати, что получится?)
Свойства сложных эфиров
Почему-то именно в этом году в пробных ЕГЭ активно встречается реакция, которую раньше в экзаменационные задания не включали. Это реакция замещения гидроксогруппы в спиртах галогеном. Например:
C2H5ОН + PCl5 → C2H5Cl + POCl5 + HCl
Или: C2H5ОН + SOCl2 → C2H5Cl + SO2 + HCl
Эти реакции есть у нас в лекциях, но мы их не отрабатывали. В основе их лежит на самом деле вот эта реакция:
C2H5ОН +HCl → C2H5Cl + H2O
Просто PCl5 и SOCl2– более мощные галогенирующие агенты.
Разложение ацетатов
Почему-то составители ЕГЭ считают, что нужно знать, как разлагаются ацетаты. Хотя в учебниках этой реакции нет. Разные ацетаты разлагаются по-разному, но давайте запомним реакцию, которая попадается в ЕГЭ:
при термическом разложении ацетата бария (кальция) получается карбонат бария (кальция) и ацетон!!!
Ba(CH3COO)2 → BaCO3 + (CH3)2CO (t0)
Ca(CH3COO)2 → CaCO3 + (CH3)2CO (t0)
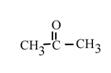
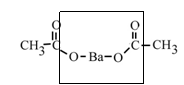 По сути, при этом происходит декарбоксилирование:
По сути, при этом происходит декарбоксилирование:
→ BaCO3 +
Ответы:
1.1. При совместном гидролизе солей, одна из которых гидролизуется по катиону, а другая – по аниону, гидролиз взаимно усиливается и идет до образования конечный продуктов гидролиза обеих солей: 2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 6NaCl
1.2. Аналогично: 2FeCl3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑ + 6NaCl
1.3. Последовательность реакций:
2Al + 3I2 = 2AlI3
AlI3 + 3NaOH = Al(OH)3 + 3NaI
Al(OH)3 + 3HCl = AlCl3 + 3H2O
2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3 +3CO2 + 6NaCl
2.1.
NO + H2O = не реагируют (так как несолеобразующий оксид)
BaO + H2O = Ba(OH)2 (реагируют, так как получается растворимый гидроксид)
CrO + H2O = (не реагируют, так как гидроксид хрома (II) нерастворим)
SO2 + H2O = H2SO3 (реагируют, так как получается растворимый гидроксид)
SiO2 + H2O = (не реагируют, так как гидроксид кремния (IV), то есть кремниевая кислота - нерастворима)
Mn2O7 + H2O = 2HMnO4 (реагируют, так как получается растворимый гидроксид – марганцевая кислота)
2NO2 + H2O = HNO2 + HNO3
3.1. При гидролизе бинарных соединений получается гидроксид первого элемента и водородное соединение второго элемента. В случае гидрида вторым продуктом будет просто водород:
NaH + H2O = NaOH + H2↑
MgH2 + 2H2O = Mg(OH)2 + 2H2↑
3.2
Na3N + 4HCl → 3NaCl + NH4Cl
PBr3 + 6NaOH → Na3PO3 + 3NaBr + 3H2O
4.1 При пропускании аммиака через растворы многоосновных кислот могут получаться средние или кислые соли, в зависимости от того, какой из реагентов в избытке:
NH3 + H2SO4 = NH4HSO4 (кислота в избытке)
2NH3 + H2SO4 = 2 (NH4)2SO4 (аммиак в избытке)
4.2
Cr2(SO4)3 + 6NH3 + 6H2O = 2Cr(OH)3↓ + 3(NH4)2SO4
(Фактически это та же реакция, что и:
Cr2(SO4)3 + 6NH4OН = 2Cr(OH)3↓ + 3(NH4)2SO4,
но формулу NH4OН сейчас писать не принято).
4.3
3CuO + 2NH3 = 3Cu + N2 + 3H2O
4.4
CuSO4 + 4NH3 = [Cu(NH3)4 ]SO4
(Хотя на самом деле сначала пойдет такая реакция:
CuSO4 + 2NH3 + 2H2O = Cu(OH)2↓ + (NH4)2SO4 (так как аммиак действует как щелочь)
А потом: Cu(OH)2↓ + 4NH3 = [Cu(NH3)4](OH)2)
В общем, в любом случае при достаточном количестве аммиака получится комплекс и ярко-синее окрашивание!
5.1
K3[Al(OH)6] + 6HBr = 3KBr + AlBr3 + 6H2O
K3[Al(OH)6] + 3HBr = 3KBr + Al(OH)3↓ + 3H2O
Na2[Zn(OH)4] + 2CO2 = 2NaHCO3 + Zn(OH)2↓
K[Al(OH)4] = KAlO2 + 2H2O↑ (t0)
[Ag(NH3)2]Cl + 2HNO3 = 2NH4NO3 + AgCl↓
6.1
2СuSO4 + 4KI = 2CuI + I2 + 2K2SO4 (двухвалентная медь восстанавливается до одновалентной)
Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O
KNO2 + NH4I = KI + N2 + 2H2O
H2O2 + 2KI = I2 + 2KOH
7.1
Fe3O4 + 4H2SO4 (разб) = FeSO4 + Fe2(SO4)3 + 4H2O
так как разбавленная серная кислота не является сильным окислителем, то идет обычная обменная реакция.
2Fe3O4 + 10H2SO4 (конц) = 3Fe2(SO4)3 + SO2 + 10H2O
так как концентрированная серная кислота является сильным окислителем, то железо +2 окисляется до железа +3.
Fe2(SO4)3 + H2S = 2FeSO4 + S + H2SO4
так как сероводород является восстановителем, то железо +3 восстанавливается до железа +2.
8.1
NaHSO4 + NaOH = Na2SO4 + H2O
Na2SO4 + NaOH – не реагируют
NaHSO4 + Ba(OH)2 = BaSO4 + NaOH + H2O
Na2SO4 + Ba(OH)2 = BaSO4 + 2NaOH
8.2
Сu + 2H2SO4 (конц) = CuSO4 + SO2 + 2H2O
CuO + H2SO4 = CuSO4 + H2O
8.3
Сu + HCl – не реагируют
CuO + 2HCl = CuCl2 + H2O
8.4
ZnS + 2HCl = ZnCl2 + H2S↑
ZnO + 2HCl = ZnCl2 + H2O
8.5
Cu2O + 3H2SO4 = 2CuSO4 + SO2 + 3H2O (тут дело в том, что, поскольку кислота концентрированная, то она доокисляпет Cu+1 до Cu+2.
CuO + H2SO4 = CuSO4 + H2O
9.1
Казалось бы, при разложении нитрата железа (II) должны получиться оксид железа (II), оксид азота (IV) и кислород. Но хитрость в том, что поскольку в оксиде железа (II) железо имеет не высшую степень окисления, а в реакции выделяется кислород, то железо будет окисляться до +3 и получится оксид железа (III):
Fe(NO3)2 → Fe2O3 + NO2 + O2
В этой реакции сразу два восстановителя – железо и кислород. С коэффициентами будет так:
4Fe(NO3)2 = 2Fe2O3 + 8NO2 + O2
9.2
В этой реакции ничего особенного нет, кроме того, что часто забывают, что медь относится еще к тем металлам, при разложении которых получается оксид металла, а не сам металл:
2Cu(NO3)2 = 2CuO + 4NO2 + O2
А вот все металлы, которые за медью, при разложении своих нитратов будут давать уже просто металл.
10.1
Правильные ответы: а,б,в,д (в кумоле вообще нет гидроксильной группы, это арен).
10.2
Правильные ответы: в (в стироле вообще нет гидроксильной группы, это арен).
10.3
Правильные ответы: нет правильного ответа (в толуоле вообще нет гидроксильной группы, это арен. Фенол недостаточно кислотный. Могла бы реагировать какая-нибудь карбоновая кислота.).
|
из
5.00
|
Обсуждение в статье: Реакции аминов с азотистой кислотой |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

