 |
Главная |
ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ
|
из
5.00
|
J OH OH
Применение алкенов:Алкены широко используются в полимерной промышленности, для получения спиртов и др. органических веществ. Алкены являются важнейшим химическим сырьем. Алкены нашли применение в различных отраслях народного хозяйства.Алкены применяются в качестве исходных продуктов в производстве полимерных материалов (пластмасс, каучуков, пленок) и других органических веществ.Получение в лаборатории: СН3-СН2-OH→ СН2=СН2+ HOH
6. Гомологический ряд алкинов. Химические свойства и применение алкинов. Получение алкинов.
Алкины – это непредельные углеводороды, молекулы которых содержат тройную связь.формула – CnH2n-2.
CH4 метин С7Н16 гептин угол-180.длина 0,120нм
С2Н6 этин С8Н18 октинХим.свой:гидротация:СH≡CH +HOH → CH2 = CH+OH; CH3-C = O
С3Н8 пропин С9Н20 нонин гидрирование: СH≡CH +2H2→СН3-СН3 ↓
С4Н10 бутин С10Н22 декинH
С5Н12 пентин
С6Н14 гексин
Применение алкинов. Наибольшее распространение в промышленности получил самый простой алкин – этин.Из алкинов особое значение имеет ацетилен. Получение алкинов:СaС2+2HOH=Ca(OH)2+C2H2↓
7. Химические свойства и применение алкинов. Получение алкинов.
Хим.свой:гидротация:СH≡CH +HOH → CH2 = CH+OH; CH3-C = O
гидрирование: СH≡CH +2H2→СН3- СН3 ↓
H
Получение алкинов:СaС2+2HOH=Ca(OH)2+C2H2↓
8. Гомологический ряд аренов. Гомологи бензола, их номенклатура, общая формула. Физические свойства аренов. Химические свойства аренов. Ориентация в реакциях электрофильного замещения. Ориентанты I и II рода.
Арены— циклические органические соединения, которые имеют в своём составе ароматическую систему.Формула С6Н6. Гомологи:
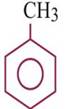 ТУЛОЛ
ТУЛОЛ 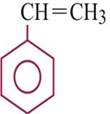 СТИРОЛ
СТИРОЛ 
Физ.свой:Первые члены ряда – жидкости без цвета с характерным запахом. Они хорошо растворяются в органических растворителях, но нерастворимы в воде. Бензол токсичен, но имеет приятный запах. Легче воды.Огнеопастны.Хим.свой: горение: 2С6Н6+O2→6O2+3H2O
Галогинирование: сl
 +3Сl2→cl
+3Сl2→cl  cl(по всей)
cl(по всей)
ClПравила ориентации при электрофильном замещении в бензольном кольце основаны на взаимном влиянии атомов в молекуле. Если в незамещенном бензоле С6Н6 электронная плотность в кольце распределена равномерно, то в замещенном бензоле С6Н5Х под влиянием заместителя Х происходит перераспределение электронов и возникают области повышенной и пониженной электронной плотности. Это оказывает влияние на легкость и направление реакций электрофильного замещения. Место вступления нового заместителя определяется природой уже имеющегося заместителя.Ориентанты 1-го рода, повышая электронную плотность в бензольном кольце, увеличивают его активность в реакциях электрофильного замещения по сравнению с незамещенным бензолом.Особое место среди ориентантов 1-го рода занимают галогены, проявляющие электроноакцепторные свойства: -F (+M<–I), -Cl (+M<–I), -Br (+M<–I).Являясь орто-пара-ориентантами, они замедляют электрофильное замещение. Причина - сильный –I-эффект электроотрицательных атомов галогенов, понижащий электронную плотность в кольце. Ориентанты 2-го рода (мета-ориентанты) направляют последующее замещение преимущественно в мета-положение.К ним относятся электроноакцепторные группы:--NO2 (–M, –I); -COOH (–M, –I); -CH=O (–M, –I); -SO3H (–I); -NH3+ (–I); -CCl3 (–I).Ориентанты 2-го рода уменьшают электронную плотность в бензольном кольце, особенно в орто- и пара-положениях. Поэтому электрофил атакует атомы углерода не в этих положениях, а в мета-положении, где электронная плотность несколько выше.
9. Применение и получение аренов. Природные источники ароматических углеводородов.
Получение аренов:в промышленности получают из каменного угольной смолы.,нефть. Примение:Бензол и его гомологи применяются как химическое сырье для производства лекарств, пластмасс, красителей, ацетона, фенола, формальдегидных пластмасс, ядохимикатов. Широко используются как растворители.
| Природные источники ароматических углеводородов:В промышленности ароматические углеводороды получают путем сухой перегонки каменного угля, а также из нефти. |
10. Нефть. Нахождение в природе, состав и физические свойства нефти. Природный и попутный нефтяной газы. Экологические аспекты добычи, переработки и использования горючих ископаемых.
Нефть - полезное ископаемое, представляющее из себя маслянистую жидкость.Нахождение в природе.Залежи нефти находятся в недрах Земли на разной глубине, где нефть заполняет свободное пространство между некоторыми породами. Если она находится под давлением газов, то поднимается по скважине на поверхность Земли. По запасам нефти наша страна занимает одно из ведущих мест в мире.Состав:нефть состоит из углеводородов, которые с химической точки зрения представляют собой соединения атомов углерода и водорода.Физ.свой.нефть – маслянистая жидкость от светло-бурого до черного цвета с характерным запахом. Она немного легче воды и практически в ней не растворяется. Так как нефть – смесь различных углеводородов, то у нее нет определенной температуры кипения.Особенности природного газа:1. Основная составная часть природного газа – метан..3. Обычно чем выше молекулярная масса углеводорода, тем меньше его содержится в природном газе.4. Состав природного газа различных месторождений неодинаков. 5. В качестве горючего природный газ имеет большие преимущества перед твердым и жидким топливом.6. Природный газ широко используется на тепловых электростанциях, в заводских котельных установках, различных промышленных печах.Способы применения природного газа:1. Использование природного газа в домашнем хозяйстве.2. В настоящее время он начинает применяться в автотранспорте, что позволяет экономить бензин, 3. Из метана получают водород, ацетилен, сажу.Попутный нефтяной газ (особенности); 2) особое название он получил потому, что находится в залежах вместе с нефтью 3) при извлечении нефти на поверхность он вследствие резкого падения давления отделяется от нее.Способы применения попутного нефтяного газа:1. попутный газ тут же на промысле сжигался.2. В настоящее время его все в большей степени улавливают, так как он, как и природный газ, представляет собой хорошее топливо и ценное химическое сырье.3. Возможности использования попутного газа даже значительно шире, чем природного. Ценная фракция перегонки нефти-это бензин.
11. Строение и классификация спиртов. Химические свойства алканолов. Способы получения спиртов.
Спирты-органические соединения содержащие один или несколько гидроксильных групп. Классификация: одноатомные-метанол, этаноли многоатомные-этандиол, инозит.Физическиесвойства:простейшие спирты—бесцветные жидкости с характерным запахом, высокими температурами кипения, хорошо растворимые в воде.Химические свойства: 1)окислительные: CH3 -C2H5OH – ОН+2Na →2 CH3 – CH2-ONa+ Н2 ↑2)восстановительные: CH3CH2OH+ [O] →H3C-CHO+ Н2ОПолучение спиртов: гидратация алкенов: CH2= CH2+ HOH→ CH3- CH2 -OH
Применение спиртов: CH3OH- растворитель; С2 H5 OH- растворитель, в медицине, для получения алкогольных напитков;
12. Многоатомные спирты. Фенол.
Многоатомные спирты (полиспирты, полиолы) — органические соединения класса спиртов, содержащие в своём составе более одной гидроксильной группы.Особенности строения многоатомных спиртов:
1) содержат в молекуле несколько гидроксильных групп, соединенных с углеводородным радикалом;
2) если в молекуле углеводорода заменены гидроксильными группами два атома водорода, то это двухатомный спирт;
3) простейшим представителем таких спиртов является этиленгликоль
4) во всех многоатомных спиртах гидроксильные группы находятся при разных атомах углерода;
5) для получения спирта, в котором хотя бы две гидроксильные группы находились бы при одном атоме углерода, проводилось много опытов, но спирт получить не удалось: такое соединение оказывается неустойчивым.
Физические свойства многоатомных спиртов:
1) важнейшие представители многоатомных спиртов – это этиленгликоль и глицерин;
2) это бесцветные сиропообразные жидкости сладковатого вкуса;
3) они хорошо растворимы в воде;
4) эти свойства присущи и другим многоатомным спиртам, например этиленгликоль ядовит.Хим.свой.:2 CH3OH+Na→2 CH3ONa+H2
CH3OH+HCl→ CH3Cl+H2O
13. Фенол.
Фенолы – производные ароматических углеводородов, в молекулах которых гидроксильные группы непосредственно связаны с бензольным кольцом.
Формула фенола С6Н5ОН
 Фенол является слабой кислотой. В этом состоит главное отличие фенолов от спиртов, которые являются неэлектролитами. Раствор фенола в воде называют карболовой кислотой.Физическиесвойства:Фенол— бесцветное кристаллическое вещество на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 °C смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком.Применение фенолов.Фенолы применяются в производстве синтетических смол, пластмасс, полиамидов и других полимеров, лекарственных препаратов, красителей, поверхностно-активных веществ, антиоксидантов, антисептиков, взрывчатых веществ.
Фенол является слабой кислотой. В этом состоит главное отличие фенолов от спиртов, которые являются неэлектролитами. Раствор фенола в воде называют карболовой кислотой.Физическиесвойства:Фенол— бесцветное кристаллическое вещество на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 °C смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком.Применение фенолов.Фенолы применяются в производстве синтетических смол, пластмасс, полиамидов и других полимеров, лекарственных препаратов, красителей, поверхностно-активных веществ, антиоксидантов, антисептиков, взрывчатых веществ.
14. Гомологические ряды альдегидов и кетонов. Изомерия и номенклатура альдегидов и кетонов. Физические свойства карбонильных соединений. Химические свойства альдегидов и кетонов. Применение и получение карбонильных соединений.
Альдегиды— класс органических соединений, содержащих карбонильную группу –СОН/ Название альдегидов происходит от названия углеводородных радикалов с добавлением суффикса -аль Общая формула предельных альдегидов СnH2n+1COH Химические свойстваАльдегиды способны к восстановлению, основной продукт восстановления — первичные спирты.Окисление. Альдегиды легко (значительно легче, чем спирты) окисляются в соответствующие карбоновые кислоты.*Реакция «серебряного зеркала». Альдегид + Ag2O (в аммиачном растворе) = Кислота + 2AgПолучение уксусного альдегида:2 CH2=CH2 + O2 → 2 CH3CHOCHCН + H2O → CH3CHO Применение уксусного альдегида:Применяют уксусный альдегид для получения уксусной кислоты, бутадиена, некоторых органических веществ, альдегидных полимеров.Мед.знач.9% раствор формальдегида в воде называют формалинымкотрыйпримен. для концервации и хранения анатомических препаратах для дезинфекции в моргах.
15. Гомологический ряд предельных одноосновных карбоновых кислот. Химические свойства карбоновых кислот. Способы получения карбоновых кислот.
Карбоновые кислоты - производные углеводородов, которые содержат в молекуле одну или несколько карбоксильных групп –СООН
Первые представители гомологического ряда предельных одноосновных карбоновых кислот это метановая (муравьиная), этановая (уксусная) кислоты. СН3СООН –уксусная, НСООН – муравьиная.Из всех карбоновых кислот уксусная находит наиболее широкое применение: в химической промышленности для получения искусственных волокон, пластмасс, негорючей кинопленки, красителей, медикаментов. Мед.знач.мур. кисл-та обладает раздражающий действием на кожи при лечение равматизма, может вызвать ожог кожи. Изовалерьяноваякисл-та оказыв. успокоив. Действия настойки валерьяны и валедолы.
16. Сложные эфиры. Строение и номенклатура сложных эфиров, межклассовая изомерия с карбоновыми кислотами. Способы получения сложных эфиров. Химические свойства и применение сложных эфиров. Жиры.
Сложжными эфирами называют производные карбоновых кислот в которых атом водорода карбоксильной группы замещен на углеводородный радикал.Получение и строение сложных эфиров:1) сложные эфиры образуются при взаимодействии кислот со спиртами. В общем виде получение их может быть выражено уравнением:
 2) реакции кислот со спиртами, ведущие к образованию сложных эфиров, называются реакциями этерификации (лат. aether – эфир)3) они проводятся в присутствии сильных минеральных кислот, при этом ионы водорода оказывают каталитическое действие;4) названия сложных эфиров образуются из названий соответствующих кислот и спиртов, например: а) метиловый эфир уксусной кислоты СН3СООСН3; б) этиловый эфир муравьиной кислоты НСООС2Н5;5) атом водорода функциональной группы в кислотах является подвижным, поэтому в спиртах при реакции этерификации водород должен отщепляться от молекулы кислоты, гидроксильная группа при этом отщепляется от молекулы спирта.Физические свойства сложных эфиров: сложные эфиры одноосновных карбоновых кислот – это обычно жидкости с приятным запахом (этиловый эфир муравьиной кислоты – запах рома, бутиловый эфир масляной кислоты – запах ананаса и т. д.).Нахождение сложных эфиров в природе.1. Синтетические сложные эфиры в виде фруктовых эссенций используются наряду с другими душистыми веществами в производстве фруктовых вод, кондитерских изделий.2. Также сложные эфиры используются при изготовлении духов и одеколонов.3. Некоторые из сложных эфиров (например, этиловый эфир уксусной кислоты) служат растворителями.Химические свойства сложных эфиров:
2) реакции кислот со спиртами, ведущие к образованию сложных эфиров, называются реакциями этерификации (лат. aether – эфир)3) они проводятся в присутствии сильных минеральных кислот, при этом ионы водорода оказывают каталитическое действие;4) названия сложных эфиров образуются из названий соответствующих кислот и спиртов, например: а) метиловый эфир уксусной кислоты СН3СООСН3; б) этиловый эфир муравьиной кислоты НСООС2Н5;5) атом водорода функциональной группы в кислотах является подвижным, поэтому в спиртах при реакции этерификации водород должен отщепляться от молекулы кислоты, гидроксильная группа при этом отщепляется от молекулы спирта.Физические свойства сложных эфиров: сложные эфиры одноосновных карбоновых кислот – это обычно жидкости с приятным запахом (этиловый эфир муравьиной кислоты – запах рома, бутиловый эфир масляной кислоты – запах ананаса и т. д.).Нахождение сложных эфиров в природе.1. Синтетические сложные эфиры в виде фруктовых эссенций используются наряду с другими душистыми веществами в производстве фруктовых вод, кондитерских изделий.2. Также сложные эфиры используются при изготовлении духов и одеколонов.3. Некоторые из сложных эфиров (например, этиловый эфир уксусной кислоты) служат растворителями.Химические свойства сложных эфиров:
1) взаимодействие их с водой. Например, при нагревании этилового эфира уксусной кислоты с водой в присутствии неорганической кислоты образуются уксусная кислота и этиловый спирт;
2) такая реакция называется гидролизом.
сложного эфира;
17. Химические свойства и применение сложных эфиров. Жиры.
Жиры – это сложные эфиры трёхатомного спирта глицерина и высших карбоновых кислот.
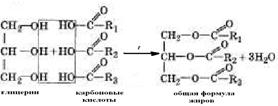 В состав жиров могут входить остатки предельных и непредел. кислот, содерж. четное число атомов углерода и неразветвлен.улгрод. скелет.Вследствие этого различают:1)жидкие жиры (масла), в составе которых остатки непредельных кислот;2)твёрдые жиры, в составе которых остатки предельных кислот.Реакция получения жиров называется этерификация, т.к. жиры это сложные эфиры . Благодаря низкой теплопроводности жиры играют важную роль в теплорегуляции животных организмов, предохраняя животных, особенно морских, от переохлаждения. Вследствие своей эластичности жиры играют защитную роль в коже позвоночных и в наружном скелете насекомых. Жиры необходимая составная часть пищи. Норма потребления взрослым человеком 80 - 100 г/сут.Гидролиз жиров в технике – источник получения карбоновых кислот, глицерина, мыла. Мыло также получают и при гидрировании жиров.В настоящее время для стирки в быту и для промывки шерсти и ткани в промышленности используют синтетические моющие средства (СМС). Они обладают более сильными моющим действием по сравнению с мылом.
В состав жиров могут входить остатки предельных и непредел. кислот, содерж. четное число атомов углерода и неразветвлен.улгрод. скелет.Вследствие этого различают:1)жидкие жиры (масла), в составе которых остатки непредельных кислот;2)твёрдые жиры, в составе которых остатки предельных кислот.Реакция получения жиров называется этерификация, т.к. жиры это сложные эфиры . Благодаря низкой теплопроводности жиры играют важную роль в теплорегуляции животных организмов, предохраняя животных, особенно морских, от переохлаждения. Вследствие своей эластичности жиры играют защитную роль в коже позвоночных и в наружном скелете насекомых. Жиры необходимая составная часть пищи. Норма потребления взрослым человеком 80 - 100 г/сут.Гидролиз жиров в технике – источник получения карбоновых кислот, глицерина, мыла. Мыло также получают и при гидрировании жиров.В настоящее время для стирки в быту и для промывки шерсти и ткани в промышленности используют синтетические моющие средства (СМС). Они обладают более сильными моющим действием по сравнению с мылом.
18. Понятие об углеводах. Классификация углеводов. Моно-, ди- и полисахариды, представители каждой группы углеводов. Биологическая роль углеводов, их значение в жизни человека и общества
Особенности углеводов:
1) углеводы – это органические соединения, состав которых обычно выражается общей формулой Сn (Н2О)m, (n и m > 4);
2) существуют также соединения, которые относятся к углеводам, состав которых не соответствует общей формуле, например сахар рамноза С6Н12O5;
3) углеводы являются очень распространенными природными соединениями;
4) углеводы входят в состав растений и живых организмов.
5) содержание углеводов в растениях составляет до 80 % массы сухого вещества, в организмах человека и животных – до 20 %;
6) они играют важную роль в физиологических процессах.Моносахариды– это простейшие углеводы. Они не подвергаются гидролизу – не расщепляются водой на более простые углеводы. Моносахариды представляют собой бесцветные кристаллические вещества, растворимые в воде и сладкие на вкус (фруктоза – самый сладкий сахар)Важнейшими моносахаридами являются альдопентозы: рибоза и дезоксирибоза, которые входят в состав нуклеиновых кислот; ксилоза (древесный сахар), который является составной частью ксиланов, содержащихся в древесине, лузге подсолнуха, соломе. Из альдогексоз самыми распространенными являются глюкоза и фруктоза. 
В природе моносахариды образуются в зеленых растениях в результате фотосинтеза, который представляет собой процесс химического связывания или «фиксации» углекислого газа и воды за счет использования энергии солнечных лучей растениями.Главным источником получения моносахаридов, имеющих практическое значение, являются полисахариды. Так, глюкозу получают в большом количестве гидролизом крахмала:(С6H10O5)n + nН2О -> nС6Н12O6.Химические свойства. Для моносахаридов характерны реакции, свойственные спиртам, альдегидам и кетонам, так как в молекулах простых сахаров содержатся гидроксильные и в скрытом виде карбонильные группы.
19. Глюкоза, строение ее молекулы и физические свойства. Таутомерия. Химические свойства глюкозы
Строение молекулы
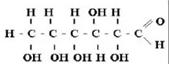
Глюкоза может существовать в виде циклов (α и β глюкозы). Глюкоза — конечный продукт гидролиза большинства дисахаридов и полисахаридов. Физические свойства:Белое кристаллическое вещество сладкого вкуса, растворимое в воде и органических растворителях.Получение:В промышленности глюкозу получают гидролизом крахмала и целлюлозы.Мед.знач.используется для изготовления лечеб. препаратов. для концервивание крови, внутривенное влияние.Применение:Глюкозу используют при интоксикации (например при пищевом отравлении или деятельности инфекции), вводят внутривенно струйно и капельно, так как она является универсальным антитоксическим средствомХим.сво. С6H1206=2C2H5OH+2CO2 C6H12O6=CH5-CH2-CH2-COOH+2CO2+2H2
20. Дисахариды. Строение дисахаридов. Полисахариды. Физические свойства крахмала, его нахождение в природе и биологическая роль. Химические свойства крахмала. Строение элементарного звена целлюлозы.
Дисахариды – это углеводы, которые при нагревании с водой в присутствии минеральных кислот или под влиянием ферментов подвергаются гидролизу, расщепляясь на две молекулы моносахаридов.Наиболее широко распространенным дисахаридом является сахароза (тростниковый или свекловичный сахар). Получают его из сахарного тростника или из сахарной свеклы. В молоке содержится 5 % лактозы – молочного сахара. Мальтоза содержится в прорастающем зерне и образуется при гидролизе зернового крахмала. Целлобиоза является промежуточным продуктом при ферментативном гидролизе целлюлозы.Строение. Молекула дисахарида состоит из двух молекул моносахаридов, соединенных гликозидной связью. В зависимости от того, какие атомы углерода участвуют в образовании гликозидной связи, молекула дисахарида может или не может содержать свободную карбонильную группу.Дисахариды можно разделить на две группы:невосстанавливающие и восстанавливающие. Невосстанавливающие сахара не имеют ОН-группы ни при одном аномерном центре, восстанавливающие – имеют свободную ОН-группу при аномерномцентре.Невосстанавливающие сахара называют гликозил-гликозидами; восстанавливающие – гликозил-гликозами.Сахароза состоит из остатков глюкозы и фруктозы, соединенных 1,2-гликозидной связью. Полисахариды-природные полимеры гидролиз.с обр. простых моносахаридов из которых состоит молкул полимеров. Например крахмал состоит из альфа глюкозы и целюлозы из беты глюкозы.
Получение крахмала:
1) крахмал широко распространен в природе;
2) он является для различных растений запасным питательным материалом и содержится в них в виде крахмальных зерен;
3) наиболее богаты крахмалом зерно злаков4) крахмал является одним из продуктов фотосинтеза;;
4) гидролиз крахмала – это его важное химическое свойство;
5) крахмал не дает реакции «серебряного зеркала», но ее дают продукты его гидролиза
.Применение крахмала:
1) крахмал является основным углеводом пищи человека – хлеба, круп, картофеля;
2) в значительных количествах крахмал перерабатывается на декстрины, патоку и глюкозу, которые используются в кондитерском производстве;
3) из крахмала, который содержится в картофеле и зерне злаков, получается этиловый спирт
21. Классификация и изомерия аминов. Химические свойства аминов.
Амины– это производные аммиака, в котором один, два или все три атома водорода замещены органическими радикалами.
Строение и свойства аминов.Известно много органических соединений, в которые азот входит в виде остатка аммиака, например: 1) метиламин СН3-NН2; 2) диметиламин СН3-NH-СН3; 3) фениламин (анилин) С6Н5-NН2; 4) метилэтиамин СН3-NН-C2H5.Все эти соединения относятся к классу аминов.
Сходство аминов с аммиаком не только формальное. Они имеют и некоторые общие свойства.1. Низшие представители аминов предельного ряда газообразны и имеют запах аммиака.4СН3-NH2 + 9O2 -> 4СO2 + 10Н2О + 2N2.2. Если амин растворить в воде и раствор испытать лакмусом, то появится щелочная реакция, как и в случае аммиака.3. Амины имеют характерные свойства оснований.4. Сходство свойств аминов и аммиака находит объяснение в их электронном строении.5. В молекуле аммиака из пяти валентных электронов атома азота три участвуют в образовании ковалентных связей с атомами водорода, одна электронная пара остается свободной.6. Электронное строение аминов аналогично строению аммиака.
7. У атома азота в них имеется также неподеленная пара электронов. В неорганической химии к основаниям относятся вещества, в которых атомы металла соединены с одной или несколькими гидроксильными группами. Но основания – понятие более широкое. Свойства их противоположны свойствам кислот.8. Амины называются еще органическими основаниями.9. Являясь основаниями, амины взаимодействуют с кислотами, при этом образуются соли.Хим.свой:2СH3-NH2+O2=2CI2+5H2O+N2
22. Аминокислоты. Понятие об аминокислотах, их классификация и строение.
Аминокислоты-это органические соединения содержащие амино и карбоксильную группу и проявляющие амфотерные свойства.Физические свойства:Аминокислоты представляют собой бесцветные кристаллические вещества, хорошо растворимые в воде и малорастворимые в органических растворителях. Многие аминокислоты имеют сладкий вкус. Классификации: Физико-химическая – основана на различиях в физико-химических свойствах аминокислот. Биологическая классификация – по возможности синтеза в организме человека. Химическая классификация - в соответствии с химической структурой радикала аминокислоты (алифатические, ароматические). Простейшим представителем является аминоэтановая кислота H2N - CH2 - COOH
23. 23. Белки
Белки (протеины, полипептиды) — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа-аминокислот. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций дают большое разнообразие свойств молекул белков.
Структура белка..Молекулыбелков представляют собой линейные полимеры, состоящие из α -аминокислот (которые являются мономерами) и, в некоторых случаях, из модифицированных основных аминокислот (правда, модификации происходят уже после синтеза белка на рибосоме).
При образовании белка в результате взаимодействия α-аминогруппы (-NH2) одной аминокислоты с α-карбоксильной группой (-COOH) другой аминокислоты образуются пептидные связи.Последовательность аминокислот в белке соответствует информации, содержащейся в гене данного белка. Первичная структура — последовательность аминокислот в полипептидной цепи. Связь ковалентная полярная.
Вторичная структура - упорядочивание полипептидной цепи в форме спирали или складки, поддерживающееся водородными связями.
Третичная структура — пространственное строение полипептидной цепи. Состоит из элементов вторичной структуры, закрученной в глобулу или нити (глобулярные и фибриллярные белки). Поддерживают третичную структуру: дисульфидные мостики,водородные связи, гидрофильно-гидрофобные взаимодействия. Четверичная структура — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Функции белков в организме:1)Каталитическая функция2)Структурная функция3)Защитная функция4)Регуляторная, сигнальная функция4)Транспортная функция5)Запасная (резервная) функция белков.6)Двигательная
24. Нуклеиновые кислоты. Нуклеиновые кислоты как природные полимеры.Происхождения:
1) нуклеиновые кислоты – природные полимеры, они были обнаружены в ядрах клеток (лат. nucleus– ядро) еще в прошлом столетии, но долгое время их роль в жизни организмов была неизвестна ученым;2) несколько десятилетий назад было расшифровано строение нуклеиновых кислот и установлено, что они играют главную роль в хранении и передаче наследственной информации и обеспечивают синтез белков в клетке.Состав нуклеиновых кислот.Нуклеиновые кислоты подвергаются гидролизу, при этом получается не один продукт (как у крахмала или целлюлозы), а несколько (как у белков): а) углевод (пентоза); б) азотсодержащие гетероциклические соединения (пиримидиновые и пуриновые основания); в) ортофосфорная кислота.В организмах существуют два вида нуклеиновых кислот:
1) рибонуклеиновые (РНК);состав рнк 4 азот.основ:адемин(а)гуанин(г)тимил(т)цитозин(ц)
2) дезоксирибонуклеиновые (ДНК).Состав днк:4 азот. Основ:адемин(а)гуанин(г)урацил(у)цитозин(ц)
24. Ферменты. Значение ферментов в биологии и применение в промышленности. Лекарства. Понятие о лекарствах как химиотерапевтических препаратах.
Ферменты– это белковые молекулы, которые синтезируются живыми клетками. В каждой клетке насчитывается более сотни различных ферментов. Роль ферментов в клетке колоссальна. С их помощью химические реакции идут с высокой скоростью, при температуре, подходящей для данного организма.Значение ферментовФерменты применяются практически во всех областях человеческой деятельности, и такое широкое применение, в первую очередь, связано с тем, что они сохраняют свои уникальные свойства вне живых клеток.Такие ферменты как амилаза расщепляют крахмал и поэтому широко используются в пищевой промышленности. В пищевой промышленности используется протеиназа, расщепляющая белки, и липазы, расщепляющие жиры. Ферменты широко используются в косметической промышленности, входят в состав кремов, некоторые ферменты входят в состав стиральных порошков.Лекарства.
 Химиотерапевтическими средствами называются лекарственные средства, которые избирательно подавляют развитие и размножение микроорганизмов в организме человека.Все применяемые в современной медицине химиотерапевтические средства можно классифицировать на шесть основных групп: 1)антибиотики, 2)сульфаниламидные препараты 3)органические и неорганические соединения металлов, серы и других 4)препараты нитрофуранового ряда 5)противогрибковые препараты, 6)противопаразитарные препараты
Химиотерапевтическими средствами называются лекарственные средства, которые избирательно подавляют развитие и размножение микроорганизмов в организме человека.Все применяемые в современной медицине химиотерапевтические средства можно классифицировать на шесть основных групп: 1)антибиотики, 2)сульфаниламидные препараты 3)органические и неорганические соединения металлов, серы и других 4)препараты нитрофуранового ряда 5)противогрибковые препараты, 6)противопаразитарные препараты
ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ
1. Состав атомного ядра. Распределение электронов по энергетическим уровням, подуровням и орбиталям в соответствии с принципом наименьшей энергии, принципом Паули и правилом Гунда.
Состав атома выражается электронной оболочки в состав которого ходит электроны и ядро состоящий из протонов и нейтронов. Количество электронов=количество протонов=порядковому номеру элемента. Количество нейтронов= атомной массе-порядковой номер элемента.заряд ядра=порядковому номеру. Строение определяется положением элементов периодич. системе.Номер периода=количество количество электронных слов. Номер группы=количеству электронов на внешнем уровне в максимальной степени окисления.По принципу Паули в атоме не может быть двух и более электронов с одинаковым значением всех четырех квантовых чисел. Основываясь на принципе Паули можно установить максимальную емкость каждого энергетического уровня и подуровня.ПравилоГунда: в каждом подуровне электроны стремятся занять максимальное число свободных энергетических ячеек, чтобы суммарный спин имел наибольшее значение.
2. Открытие Периодического закона. Предпосылки: накопление фактологического материала, работы предшественников
Открытию Периодического закона предшествовало накопление знаний о веществах и их свойствах. По мере открытия новых химических элементов, изучения состава и свойств их соединений появлялись первые попытки классифицировать элементы по каким-либо признакам.Выдающийся шведский химик Й. Я. Берцелиус разделил все элементы на металлы и неметаллы на основании различий в свойствах образованных ими простых веществ и соединений (металлам соответствуют основные оксиды и основания, неметаллам — кислотные оксиды и кислоты).одной из предпосылок открытия Периодического закона послужили решения Международного съезда химиков в немецком городе Карлсруэ в 1860 г.Накопление фактологическогоматериалаКо времени открытия Периодического закона было известно 63 элемента и описаны свойства их многочисленных соединений
3. Периодический закон и строение атома. Изотопы. Современное понятие химического элемента. Современная формулировка Периодического закона. Периодическая система и строение атома.
Периодический закон открыт Д.И.Менделеевым в 1869 г.Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от величины зарядов ядер их атомов.Атом- сложная электромагнитная система, включающая элементарные частицы – нуклоны( протоны, нейтроны) и электроны.Ядро( протоны и нейтроны) определяют массу атома, заряд ядра и радиоактивные свойства. Электроныопределяют химические свойства. Изотопы– разновидности атомов одного и того же химического элемента, различающиеся массовыми числами, но имеющие одинаковый заряд ядра.Современная формулировка периодического закона Д. И. Менделеева такова: свойства химических элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда атомных, ядер. Она только базируется на новых данных, которые придают закону и системе научную обоснованность и подтверждают их правильность.
4. Валентные возможности атомов химических элементов.
Валентность – это количество ковалентных связей, которое образует атом в соединении с ковалентной связью.1) числом не спаренных электронов (одноэлектронных орбиталей);2) наличием свободных орбиталей; 3) наличием не поделенных пар электронов.Структура наружных энергетических уровней атомов химических элементов и определяет в основном свойства их атомов. Эти уровни называют валентными. Электроны этих уровней, а иногда и предвнешних уровней могут принимать участие в образовании химических связей. Такие электроны также называют валентными.
Валентность атома химического элемента определяется в первую очередь числом неспаренных электронов, принимающих участие в образовании химической связи.
5. Типы химических связей: ковалентная, ионная, металлическая и водородная.
1.Ионная-связь, которая возникает, когда одни атомы почти полностью отдают, а другие присоединяют валентные электроны: Na-1c-Na+. Это кристаллические вещества с высокими температурами плавления( NaF, KCL).2.Ковалентная –связь, возникающая за счёт образования общих электронных пар.1)неполярная- связь между атомами с одинаковой электроотрицательностью.Это газообразные, жидкие и твердые вещества(F2, Br,алмаз, графит).2)полярная -связь между атомами, электроотрицательность которых различается незначительно.Это жидкие и газообразные вещества( HF).3.Металлическая –связь, которую осуществляют относительно свободные электроны между ионами металлов в металлической кристаллической решётке. Это твёрдые вещества, ковкие, электро и теплопроводники.( Na,Al,Сu,сплавы).4.Водородная-связь между атомами водорода одной молекулы и элементом с высокой электроотрицательностью (О,N,F). Это жидкие и твёрдые вещества( HF,вода, спирты).
6. Комплексообразование. Понятие о комплексных соединениях.
Впервые понятие о комплексе, как о сложной частице, состоящей их внутренней и внешней сферы, было введено А. Вернером в 1892 году. Согласно этому определению, координационные (комплексные) соединения – это соединения, существующие как в кристаллическом состоянии, так и в растворах, особенностями которых являются наличие центрального иона или атома-акцептора электронов, окруженного лигандами-донорами электронов.Комплексные соединения-это химические вещества, в состав которых входят комплексные частицы.
Комплексная частица-сложная химическая частица, все или часть связей в которой образованы по донорно-акцепторному механизму.
Комплексообразователь –центральный атом комплексной частицы. Обычно комплексообразователь – атом металла. Комплексообразователь обычно положительно заряжен и в таком случае именуется металлоцентром.Заряд комплексообразователя может быть также отрицательным или равным нулю.Лиганды( Адденды) –атомы или изолированные группы атомов, располагающиеся вокруг комплексообразователя.
-в качестве лигандов могут выступать нейтральные молекулы(H2O, СО, NH3 Анионы(Cl-, OH-и др.), а также катион водорода Н+
Внутренняя сферакомплексного соединения – центральный атом со связанными с ним лигандами. То есть, собственно, комплексная частица.
Внешняя сферакомплексного соединения- остальные частицы, связанные с комплексной частицей ионной или межмолекулярнымисвязями, включая водородные.
7. Неорг
|
из
5.00
|
Обсуждение в статье: ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

