 |
Главная |
Классификация химических реакций в неорганической химии.
|
из
5.00
|
Классификация по составу исходных веществ и продуктов реакции.Реакции соединения — из нескольких веществ (простых или сложных) образуется сложное вещество:  Реакции разложения — сложное вещество превращается в несколько веществ (простых или сложных):
Реакции разложения — сложное вещество превращается в несколько веществ (простых или сложных):  Реакции замещения— из простого и сложного веществ образуется простое и сложное вещества:
Реакции замещения— из простого и сложного веществ образуется простое и сложное вещества:  Реакции обмена— из двух сложных веществ образуются два сложных вещества:
Реакции обмена— из двух сложных веществ образуются два сложных вещества: 
Классификация по изменению степени окисления.Окислительно-восстановительные реакции — в ходе реакции происходит изменение степеней окисления элементов:  Реакции ионного обмена — изменения степеней окисления не происходит:
Реакции ионного обмена — изменения степеней окисления не происходит:
Классификация во тепловому эффекту.
Экзотермические реакции — в ходе реакции выделяется тепло:

Эндотермические реакции — в ходе реакции поглощается тепло:  .Классификация химических реакций в органической химии:Гидрирование — присоединение водорода:
.Классификация химических реакций в органической химии:Гидрирование — присоединение водорода:  C2H5OH + HBr = C2H5Br + H2O
C2H5OH + HBr = C2H5Br + H2O
9. Вероятность протекания химических реакций. Тепловой эффект химических реакций.
Условия протекания химических реакций:1.Изменение температуры( нагревание/ охлаждение).2.Изменение давления(уменьшение/увеличение)3.Соприкосновение, перемещение 4.Измельчение5.Действие света. Электрического тока6.Применение катализаторов и ингибиторовТепловой эффект химической реакции – это количество теплоты (Q), которое выделяется или поглощается в химической реакции:Экзотермическая реакция- это когда тепло в реакции выделяется: (H2+ Cl2= 2HCl+ Q)Эндотермическая реакция – это когда тепло в реакции поглощается( N2+ O2= NO- Q)
10. Скорость химических реакций. Обратимость химических реакций.
Скоростью химической реакции называется изменение количества вещества за единицу времени в единице объема.
 Скорость реакции зависит от природы реагирующих веществ.При реакции металлов с соляной кислотой, чем левее расположен металл в раду напряжений, тем быстрее протекает реакция, а металлы, находящиеся правее водорода, не реагируют вообще:
Скорость реакции зависит от природы реагирующих веществ.При реакции металлов с соляной кислотой, чем левее расположен металл в раду напряжений, тем быстрее протекает реакция, а металлы, находящиеся правее водорода, не реагируют вообще:  Скорость реакции увеличивается при увеличении концентрации реагирующих веществ.Горение веществ в чистом кислороде происходит быстрее, чем в воздухе.Скорость реакции увеличивается при увеличении поверхности соприкосновения реагирующих веществ.
Скорость реакции увеличивается при увеличении концентрации реагирующих веществ.Горение веществ в чистом кислороде происходит быстрее, чем в воздухе.Скорость реакции увеличивается при увеличении поверхности соприкосновения реагирующих веществ.
Скорость реакции увеличивается с увеличением темпера-:Железо при обычной температуре реагирует с хлором очень медленно, при высокой же температуре протекает бурная реакция (железо горит в хлоре).Скорость многих реакций увеличивается в присутствии специальных веществ — катализаторов.Катализаторы увеличивают скорость реакции, но по окончании реакции остаются неизменными.Примеры каталитических реакций: 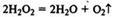
11. Химическое равновесие.
Химические реакцию( по направлению) имеют обратимые реакции(это химические реакции, которые протекают одновременно в противоположных направлениях) и необратимые (это химические реакции, протекающие в одном направлении). Если реакция обратима, то с течением времени скорости прямой и обратной реакции становятся одинаковыми, наступает состояние химического равновесия.При изменении условий протекания реакции (температуры, давления, концентрации участвующих в реакции веществ), скорости прямого и обратного процессов изменяются неодинаково, и химическое равновесие нарушается. Направление этого смещения подчиняется принципу ЛеШателье: при всяком внешнем воздействии на систему, находящуюся в состоянии химического равновесия, в ней протекают
12. Способы выражения концентрации растворов.
Концентрация- соотношение между количеством растворенного вещества и растворителя или количеством растворенного вещества и всего раствора.
Способы выражения концентрации растворов:1.Массовая доля(w)- отношение массы растворенного вещества к массе раствора2.Объемная доля( )- отношение объема растворенного вещества к объему раствора3.Молярная доля (X)- отношение числа молей растворенного вещества к сумме числа молей всех компонентов раствора.4.Молрная концентрация (молярность) (С моль/л)- число моль растворенного вещества в одном литре раствора.
5.Нормальная концентрация или молярная концентрация эквивалента (нормальность)(С моль ЭКВ/л)- число моль эквивалентов растворенного вещества, содержащихся в одном литре раствора.6. Титр (С мг/мл или г/мл)- масса растворенного вещества, содержащаяся в одном миллилитре раствора.7.Моляльность (С моль/кг)- число моль растворенного вещества, приходящееся на 1 кг растворителя
13. Теория электролитической диссоциации.
Электролитическая диссоциация — распад электролита на ионы под действием полярных молекул растворителя.Основы теории электролитической диссоциации – С.Аррениус, 1887г.:1. Электролиты при растворении в воде диссоциируют.2. Под действием электрического тока ионы движутся в растворе: положительно заряженные - к катоду, отрицательно заряженные — к аноду.3. Диссоциация – обратимый процесс.
Степень диссоциации — отношение числа распавшихся молекул к общему числу молекул растворенного вещества:  электролит сильный . В растворе практически нет молекул. Примеры: НСl; NaOH; KBrэлектролит слабый . В растворе много молекул и мало ионов. Примеры: H2 S; NH3 ; Fe(SCN)3 .Диссоциация кислот, щелочей и солей:Кислоты — электролиты, в растворах которых нет других катионов, кроме катионов водорода.Многоосновные кислоты диссоциируют ступенчато:
электролит сильный . В растворе практически нет молекул. Примеры: НСl; NaOH; KBrэлектролит слабый . В растворе много молекул и мало ионов. Примеры: H2 S; NH3 ; Fe(SCN)3 .Диссоциация кислот, щелочей и солей:Кислоты — электролиты, в растворах которых нет других катионов, кроме катионов водорода.Многоосновные кислоты диссоциируют ступенчато:
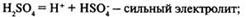
 Основания — электролиты, в растворах которых нет других анионов, кроме гидроксид-ионов.
Основания — электролиты, в растворах которых нет других анионов, кроме гидроксид-ионов. 
 Соли — электролиты, в растворах которых есть катионы металлов или ион аммония и анионы кислотных остатков.
Соли — электролиты, в растворах которых есть катионы металлов или ион аммония и анионы кислотных остатков.

14. Реакции обмена в водных растворах электролитов.
Многие химические реакции протекают в водных растворах. Если в этих реакциях участвуют электролиты, то следует учитывать, что они находятся в водном растворе в диссоциированном состоянии, то есть или только в виде ионов (сильные электролиты) и частично в виде молекул (слабые электролиты).Реакции в растворах электролитов протекают до конца если:1)образуется или растворяется осадок;2)выделяется газ;3)образуется малодиссоциирующее вещество(например, H2O-вода)
|
из
5.00
|
Обсуждение в статье: Классификация химических реакций в неорганической химии. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

