 |
Главная |
Основность органических соединений.
|
из
5.00
|
Органические кислоты
В органических соединениях в зависимости от природы элемента, с которым связан Н+, различают следующие кислоты:ОН – кислоты (карбоновые кислоты, фенолы, спирты), СН –кислоты (углеводороды и их производные), NH –кислоты (амины, амиды, имиды), SH –кислоты (тиолы).
Кислотным центром называется элемент и связанный с ним атом водорода.
Сила кислоты будет зависеть от стабильности аниона, т.е. от сопряженного основания, которое образуется при отрыве Н+ от молекулы. Чем стабильнее анион, тем выше кислотность данного соединения.
Стабильность аниона зависит от ряда факторов, которые способствуют делокализации заряда. Чем выше делокализация заряда, тем устойчивее анион, тем сильнее кислотные свойства.
Факторы, оказывающие влияние на степень делокализации:
1. Природа гетероатома в кислотном центре
2. Электронные эффекты атомов углеводородных радикалов и их заместителей
3. Способность анионов к сольватации.
Основность органических соединений.
Органические соединения, в состав молекулы которых входят атомы азота, кислорода, серы, могут выступать в роли оснований, присоединяя протон водорода за счет неподеленной пары электронов на внешнем энергетическом уровне. Гетероатом в молекуле органического вещества, присоединяющий протон, называется центром основности.
Основания по Бренстеду делятся на n – основания и π – основания.
n – Основания могут быть нейтральными или отрицательно заряженными частицами. К ним относятся:аммониевые (R3N, R=NH, RCN), оксониевые (RC(O)R, R-O-R), сульфониевые (R-S-R, RC(S)R).
π-основания (алкины, алкены, диены, арены) в них центром основности являются электроны π-связи.
Сила основания определяется стабильностью образующегося катиона (сопряженной кислоты). Чем стабильнее катион, тем сильнее основание.
5. 1) Классификация реакций по конечному результату:
В основе этой классификации лежит сопоставление числа, состава и строения исходных и конечных продуктов по уравнению реакции. В соответствии с конечным результатом различают следующие типы органических реакций:
· замещение;
· присоединение;
· отщепление (элиминирование);
· изомеризация (перегруппировка);
· разложение.
2) Классификация реакций по числу частиц, участвующих в элементарной стадии:
По этому признаку все реакции можно разделить на мономолекулярные и бимолекулярные, тримолекулярные.
· Мономолекулярные реакции – реакции, в которых участвует только одна молекула (частица):
А→В + . . .
К этому типу относятся реакции распада и изомеризации. Процессы электролитической диссоциации также соответствуют этому типу, например:
СН3 – СООН → CH3COO- + H+
· Бимолекулярные реакции - реакции типа
А + В→С + . . . ,в которых происходит столкновение двух молекул (частиц).
Это самый распространенный тип элементарных реакций.
· Тримолекулярные реакции – реакции типа
2А + В→С + . . . ,
в которых происходит столкновение трех молекул.
Тримолекулярные реакции встречаются довольно редко. Одновременное соударение большего числа частиц маловероятно.
3) Классификация реакций по механизму разрыва связей
В зависимости от способа разрыва ковалентной связи в реагирующей молекуле органические реакции подразделяются на радикальные и ионные реакции. Ионные реакции в свою очередь делятся по характеру реагента, действующего на молекулу, на электрофильные и нуклеофильные.
Разрыв ковалентной связи может происходить двумя способами, обратными механизмам ее образования.
Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим:

В результате гомолитического разрыва образуются сходные по электронному строению частицы, каждая из которых имеет неспаренный электрон. Такие частицы называются свободными радикалами.
Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим:

В результате образуются разноименно заряженные ионы – катион и анион. Если заряд иона сосредоточен на атоме углерода, то катион называют карбокатионом, а анион - карбанионом.
6. Алка́ны (также насыщенные алифатические углеводороды, парафины) — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.
Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp3-гибридизации
Алканы имеют низкую химическую активность. Это объясняется тем, что единичные связи C—H и C—C относительно прочны, и их сложно разрушить. Поскольку углеродные связи неполярны, а связи С—Н малополярны, оба вида связей малополяризуемы и относятся к σ-виду, их разрыв наиболее вероятен по гомолитическому механизму, то есть с образованием радикалов.
Реакции радикального замещения:
галогенирование (протекают на свету)

нитрования

Реакции горения (горят светлым не коптящим пламенем)
CnH2n+2 + O2 t→ nCO2 + (n+1)H2O
При каталитическом окислении алканы образуют спирты, альдегиды, карбоновые кислоты.
Вазелин используется в медицине, парфюмерии, косметике.
7.Непредельные углеводороды — углеводороды с открытой цепью, в молекулах которых между атомами углерода имеются двойные или тройные связи. К ним относятся алкены (соединения с двойной связью, гибридизация атома углерода при двойной связи sp2), алкины (соединения с тройной связью, гибридизация атома углерода при тройной связи sp), алкадиены (соединения с двумя двойными связями).
Непередельные углеводороды более реакционноспособные соединения по сравнению с предельными углеводородами, из-за наличия непрочной  связи.
связи.
Наиболее характерными реакциями для непредельных углеводородов являются реакции электрофильного присоединения«AdE». Среди них можно выделить: гидрирование, галогенирование, гидрогалоенирование, гидратация.
Примером таких реакций служит гидратация алкенов:

Присоединение молекул галогеноводородов и воды протекает по правилу Марковникова (водород присоединяется к наиболее гидрогенизированному атому углерода).
Качественные реакции на алкены: обесцвечивание бромной воды и раствора перманганата калия
CH2=CH2 + [O] + H2O 
| HO—CH2—CH2—OH этиленгликоль |
Этилен применяют как исходный материал для производства ацетальдегида и синтетического этилового спирта, полиэтилена.
Алкадиены с сопряженным связями используются для получения синтетических каучуков.
Ацетилен — ценный продукт для химической промышленности. Из него получают синтетический каучук, уксусный альдегид и уксусную кислоту, этиловый спирт.
8. В простейшем случае сопряженные системы —
это системы с чередующимися двойными и одинарными связями. Они могут быть открытыми и закрытыми. Открытая система имеется в диеновых углеводородах (УВ).
Закрытая система имеется в ароматических УВ.
Ароматичность
Это понятие, включающее различные свойства ароматических соединений. Условия ароматичности:
1) плоский замкнутый цикл;
2) все атомы С находятся в sp2-гибридизации;
3) образуется единая сопряженная система всех атомов цикла;
4) выполняется правило Хюккеля: в сопряжении участвуют 4n + 2 р-электронов, где n = 1, 2, 3…
Простейший представитель ароматических углеводородов – бензол. Он соответствует всем четырем условиям ароматичности. Правило Хюккеля: 4n + 2 = 6, n = 1.
Нафталин – ароматическое соединение 4n + 2 = 10, n = 2.
Основным типом реакций, характерным для ароматических углеводородов, являются реакции электрофильного замещения. К таким реакциям относится галогенирование, нитрование, сульфирование, алкилирование, ацилирование.
 + Cl2 –AlCl3®
+ Cl2 –AlCl3®  (хлорбензол) + H2O
(хлорбензол) + H2O
 + HNO3 –H2SO4®
+ HNO3 –H2SO4®  (нитробензол) + H2O
(нитробензол) + H2O
9.
СПИРТЫ(алкоголи) – класс органических соединений, содержащих одну или несколько группировок С–ОН, при этом гидроксильная группа ОН связана с алифатическим атомом углерода.
Классификация спиртов разнообразна и зависит от того, какой признак строения взят за основу.
1. В зависимости от количества гидроксильных групп в молекуле спирты делят на:
а) одноатомные (содержат одну гидроксильную ОН-группу), например, метанол СН3ОН, б) многоатомные (две и более гидроксильных групп), например, этиленгликоль
HO–СH2–CH2–OH, глицерин HO–СH2–СН(ОН)–CH2–OH.
2. По типу атома углерода, с которым связана группа ОН, спирты делят на:
а) первичные, у которых ОН-группа связана с первичным атомом углерода. Примеры первичных спиртов – этанол СH3–CH2–OH, пропанол СH3–CH2–CH2–OH.
б) вторичные, у которых ОН-группа связана с вторичным атомом углерода.

в) третичные, у которых ОН-группа связана с третичным атомом углерода.

3. По строению органических групп, связанных ОН-группой, спирты подразделяют на предельные (метанол, этанол, пропанол), непредельные, например, аллиловый спирт СН2=СН–СН2–ОН, ароматические (например, бензиловый спирт С6Н5СН2ОН), содержащие в составе группы R ароматическую группу.
Систематическая номенклатура спиртов. Углеводородную цепь нумеруют с того конца, к которому ближе расположена ОН-группа. Далее используют эту нумерацию, чтобы указать положение различных заместителей вдоль основной цепи, в конце названия добавляют суффикс «ол» и цифру, указывающую положение ОН-группы :

10.
Фенолами называют производные ароматических углеводородов, молекулы которых содержат одну или несколько гидроксильных групп, непосредственно соединенных с бензольным кольцом.
Названия фенолов составляют с учетом того, что для родоначальной структуры по правилам ИЮПАК сохранено тривиальное название "фенол". Нумерацию атомов углерода бензольного кольца начинают от атома, непосредственно связанного с гидроксильной группой (если она является старшей функцией), и продолжают в такой последовательности, чтобы имеющиеся заместители получили наименьшие номера.
Простейший представитель этого класса — собственно фенол, С6Н5ОН.
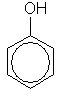
Фенол
1. Кислотность фенола существенно выше, чем у предельных спиртов; он реагирует как с щелочными металлами:
С6Н5ОН + Na → C6H5ONa + 1/2H2↑,
так и с их гидроксидами (отсюда старинное название "карболовая кислота"):
С6Н5ОН + NaOH → C6H5ONa + Н2О.
2.Реакции электрофильного замещения в феноле протекают значительно легче, чем в ароматических углеводородах. Поскольку ОН группа является ориентантом I рода, то в молекуле фенола увеличивается реакционная способность бензольного кольца в орто- и пара-положениях (при галогенировании, нитровании, поликонденсации и т.д.). Так, при действии бромной воды на фенол три атома водорода замещаются на бром, и образуется осадок 2,4,6-трибромфенола:

Это — качественная реакция на фенол.
11. Согласно тривиальной номенклатуре простые эфиры называют по радикалам, связанным с атомом кислорода, добавляя слово "эфир".

По номенклатуре ИЮПАК эфиры рассматривают как алкоксиалканы. Корень слова определяет самая длинная алкильная группа.

Простые эфиры относятся к числу малореакционноспособных веществ и стабильны по отношению ко многим реагентам, но они чувствительны по отношению к кислороду и легко образуют взрывчатые гидроперекиси, которые являются причиной взрыва при неосторожном обращении. В химическом отношении простые эфиры характеризуются высокой инертностью по отношению ко многим реагентам, особенно основной природы. Они не расщепляются металлоорганическими соединениями, гидридами и амидами щелочных металлов, а также комплексными гидридами бора и алюминия. Простые эфиры практически незаменимы в качестве растворителей при получении магнийорганических и других металлоорганических соединений, а также для реакций восстановления алюмогидридами и его производными.
12. Органические соединения, в молекуле которых имеется карбонильная группа >С=O, называются карбонильными соединениями, или оксосоединениями. Карбонильные соединения делятся на две большие группы — альдегиды и кетоны.
Альдегиды содержат в молекуле карбонильную группу, связанную с атомом водорода, т. е. альдегидную группу —СН=O. Кетоны содержат карбонильную группу, связанную с двумя углеводородными радикалами, т. е. кетонную группу.
В зависимости от строения углеводородных радикалов альдегиды и кетоны бывают алифатическими, алициклическими и ароматическими.
Для альдегидов часто используют тривиальные названия, соответствующие названиям кислот (с тем же числом углеродных атомов), в которые альдегиды переходят при окислении. По систематической номенклатуре названия альдегидов образуют, прибавляя окончание -аль к названию родоначального углеводорода с самой длинной углеродной цепью, включающей карбонильную группу, от которой и начинают нумерацию цепи. Названия ароматических альдегидов производят от родоначальной структуры ряда — бензальдегида С6Н5 —СН=О. Кетоны часто называют по наименованию радикалов, связанных с карбонильной группой, или по систематической номенклатуре: к названию предельного углеводорода добавляют суффикс -он и указывают номер атома углерода, связанного с карбонильным кислородом. Нумерацию начинают с ближайшего к кетонной группе конца цепи.
| O II CH3–CH2–CH2–C I H | O II CH3–CH–C I I H CH3 | O II CH3–CH2–C | –CH3 |
| масляный альдегид или бутаналь | изомасляный альдегид или 2-метил-пропаналь | метилэтилкетон или бутанон -2 |
Химические свойства альдегидов и кетонов обусловлены присутствием в их молекуле активной карбонильной группы, в которой двойная связь сильно поляризована в силу большой электроотрицательности кислорода (>С==О). Альдегиды и кетоны по-разному относятся к действию окислителей. Альдегиды легко (значительно легче, чем спирты) окисляются в соответствующие карбоновые кислоты. Для их окисления можно использовать такие мягкие окислители, как оксид серебра и гидроксид меди (II).
Одной из качественных реакций для обнаружения альдегидной группы является реакция “серебряного зеркала” — окисление альдегидов оксидом серебра.
Другая качественная реакция на альдегиды заключается в окислении их гидроксидом меди (II). При окислении альдегида светло-голубой гидроксид меди (II) превращается в желтый гидроксид меди (I) при комнатной температуре.
13.Карбоновые кислоты - органические вещества, молекулы которых содержат одну или несколько карбоксильных групп.
Карбоксильная группа  (сокращенно —COOH) - функциональная группа карбоновых кислот - состоит из карбонильной группы и связанной с ней гидроксильной группы.
(сокращенно —COOH) - функциональная группа карбоновых кислот - состоит из карбонильной группы и связанной с ней гидроксильной группы.
По числу карбоксильных групп карбоновые кислоты делятся на одноосновные, двухосновные и т.д.
По типу радикала карбоновые кислоты делятся на предельные (например, уксусная кислота CH3COOH), непредельные [например, акриловая кислота CH2=CH—COOH, олеиновая CH3—(CH2)7—CH=CH—(CH2)7—COOH] и ароматические (например, бензойная C6H5—COOH).
По номенклатуре ИЮПАК, к-ты называют, выбирая за основу наиб. длинную цепь, содержащую группу СООН, и добавляя к назв. соединения-основы окончание "овая" и слово "к-та"; атому С карбоксильной группы приписывают номер 1, напр. СН3(СН2)4СН(СН3)СООН - 2-метилгептановая к-та. Часто к назв. соединения-основы добавляют слова "карбоновая к-та", напр. С6Н11СООН - циклогексанкарбоновая к-та. При использовании этого способа наименования в алифатич. ряду атом С карбоксильной группы в нумерацию цепи не включается. Многие к-ты имеют тривиальные названия.
Химические свойства. Наличие карбоксильной группы предполагает ряд общих свойств карбоновых кислот. Это прежде всего кислотность. Карбоновые кислоты, как правило, слабые кислоты. Даже самые сильные из них (винная, щавелевая) сравнимы лишь со слабой неорганической сернистой кислотой. Для карбоновых кислот типичны обычные реакции неорганических кислот, например, в реакции со щелочами, карбонатами, оксидами образуются соли. Карбоновые кислоты обладают также особыми свойствами. Так, при отщеплении молекул воды они образуют ангидриды, например: 2СН3СООН ® Н2О + (СН3СО)2О (уксусный ангидрид). При действии PCl5 и других хлорирующих агентов образуются хлорангидриды: СН3СООН + PCl5 ® CH3COCl + POCl3 + HCl. В реакции этерификации (взаимодействие кислоты со спиртом) образуются сложные эфиры: СН3–СО–ОН + С2Н5–ОН ® Н2О + СН3–СО–О–С2Н5 (этилацетат). При действии аммиака на ангидриды, галогенангидриды, сложные эфиры, а также при нагревании аммониевых солей алифатических карбоновых кислот образуются амиды: CH3COONH4 ® Н2О + CH3CONH2 (ацетамид). При действии на алифатические кислоты хлора или брома при высокой температуре или при освещении происходит радикальная реакция замещения атома водорода на атом галогена: CH3COOH + Cl2 ®CH2ClCOOH + HCl.
14.АМИНЫ – класс соединений, представляющий собой органические производные аммиака, в котором один, два или три атома водорода замещены органическими группами.
Классификация аминов разнообразна и определяется тем, какой признак строения взят за основу.
В зависимости от числа органических групп, связанных с атомом азота, различают:
первичные амины – одна органическая группа у азота RNH2
вторичные амины – две органических группы у азота R2NH, органические группы могут быть различными R'R"NH
третичные амины – три органических группы у азота R3N или R'R"R"'N
По типу органической группы, связанной с азотом, различают алифатические СH3 – N< и ароматические С6H5 – N< амины, возможны и смешанные варианты.
По числу аминогрупп в молекуле амины делят на моноамины СH3 – NН2, диамины H2N(СH2)2NН2, триамины и т.д.
Отличительная способность аминов – присоединять нейтральные молекулы (например, галогеноводороды HHal, с образованием органоаммониевых солей, подобных аммонийным солям в неорганической химии. Для образования новой связи азот предоставляет неподеленную электронную пару, исполняя роль донора.
(C2H5)3N + HCl ® [(C2H5)3NH]Сl
C2H5NH2 + H2O ® [C2H5NH3]+ + OH–
Аминоспирты, аминоалкоголи — алифатические органические соединения, содержащие —NH2 и —ОН группы у разных атомов углерода в молекуле. Низшие аминоспирты представляют собой высококипящие маслянистые жидкости со свойствами оснований.
АМИНОФЕНОЛЫ — ароматические соединения, содержащие в молекуле аминогруппу и гидроксильную группу; бесцветные кристаллы. Амфотерные соединения.
15.Аминокисло́ты (аминокарбо́новыекисло́ты; АМК) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминныегруппы. Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы.
Все аминокислоты — амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2.
NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная соль глицина)
NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, то есть находятся в состоянии внутренних солей.
NH2 —CH2COOH  N+H3 —CH2COO-
N+H3 —CH2COO-
Качественные реакции на аминокислоты:
Биуретовая реакция: обусловлена формированием биуретового комплекса в результате соединения пептидной группировки белка с медью. Данная реакция определяет наличие в растворе исследуемого соединения пептидной связи. В белках и пептидах пептидная связь, как правило, находится в амидной форме, однако она переходит в иминольную форму, находясь в щелочной среде;
Нингидриновая реакция: качественная реакция на аминокислоты в результате которой аминокислота с нингидрином способствуют образованию продукта конденсации типа азометина за счет перегруппировки. В процессе реакции нингидрина с 2-аминоиндандионом происходит окислительноедезаминирование аминокислоты с образованием красителя, углекислоты и альдегида;
Ксантопротеиновая реакция: цветная качественная реакция на аминокислоты, определяющая наличие в белке гетероциклических и ароматических аминокислот. В результате добавления концентрированной щёлочи жёлтое окрашивание, которое дают растворы белка при кипячении с концентрированной азотной кислотой, переходит в оранжевое;
Реакция Милона: белки с раствором нитрата ртути в азотистой кислоте дают красное окрашивание. Данная реакция связана с наличием фенольной группировки;
Реакция с формальдегидом: при взаимодействии формальдегида с аминокислотами образуются относительно устойчивые карбиноламины — N-метилольные производные, которые содержат свободную карбоксильную группу. Данная реакция на аминокислоты лежит в основе количественного определения аминокислот с помощью метода Сёренсена (метод формального титрования).
16.Все природные α-аминокислоты, кроме глицина (NH2 - CH2 - COOH), имеют асимметрический атом углерода
(α-углеродный атом), а некоторые из них даже два хиральных центра, например, треонин. Таким образом, все аминокислоты могут существовать в виде пары несовместимых зеркальных антиподов (энантиомеров).
За исходное соединение, с которым принято сравнивать строение α-аминокислот, условно принимают D- и L-молочные кислоты, конфигурации которых, в свою очередь, установлены по D- и
L-глицериновым альдегидам.


Природные аминокислоты, входящие в состав белков, относятся к L-ряду. D-формы аминокислот встречаются сравнительно редко, они синтезируются только микроорганизмами и называются «неприрод-ными» аминокислотами. Животными организмами D-аминокислоты не усваиваются.
Аминокислоты существуют в виде диполярного иона, который образуется за счет отщепления протона от карбоксильной группы и присоединения его к аминогруппе. Диполярный ион часто называют внутренней солью.

Изоэлектрическая точка (pI) — кислотность среды (pH), при которой определённая молекула или поверхность не несёт электрического заряда. Амфотерные молекулы (цвиттер-ионы) содержат как положительные, так и отрицательные заряды, наличием которых определяется pH раствора. Заряд различных функциональных групп таких молекул может меняться в результате связывания или, наоборот, потери протонов H+.
17. Пепти́ды — семейство веществ, молекулы которых построены из двух и более остатков аминокислот, соединённых в цепь пептидными (амидными) связями —C(O)NH—. Обычно подразумеваются пептиды, состоящие из α-аминокислот, однако термин не исключает пептидов, полученных из любых других аминокарбоновых кислот.
Пептидная (амидная) связь — это вид химической связи, которая возникает вследствие взаимодействия α-аминогруппы одной аминокислоты и α-карбоксигруппы другой аминокислоты.

Уровни организации белковой молекулы
Первичной, самой простой структурой является полипептидная цепь, состоящая из остатков альфа-аминокислот. Вторичная структура, когда белковая нить закручена в виде спирали. Между группами -СООН, находящимися на одном витке спирали, и группами -NH2 на другом витке образуются водородные связи. Нить аминокислот (полипептид) далее свертывается, образуя клубок, или фибриллу или глобулу, для каждого белка специфичную. Таким образом, возникает сложная конфигурация, называемая третичной структурой. Связи, поддерживающие третичную структуру белка, также слабые. Они возникают, в частности, вследствие гидрофобных взаимодействий. Кроме гидрофобных сил, в поддержании третичной структуры белка существенную роль играют электростатические связи между электроотрицательными и электроположительными радикалами аминокислотных остатков. Третичная структура поддерживается также небольшим числом ковалентных дисульфидных -S-S-связей, возникающих между атомами серы серусодержащих аминокислот. Благодаря соединению нескольких молекул белков между собой образуется четвертичная структура.
Гидролиз белков протекает ступеньчато, конечным продуктом являются альфа-аминокислоты, при этом все структуры разрушаются.
Качественные реакции на белки:
Реакция с нингидрином используется для визуального обнаружения a-аминокислот: в пробирку наливают 1 мл 1%-го раствора глицина и 0,5 мл 1%-го раствора нингидрина. Содержимое пробирки осторожно нагревают до появления сине-фиолетового окрашивания;
Биуретовая реакция: со свежеприготовленным гидроксидом меди(II) все a-аминокислоты в мягких условиях дают хорошо кристаллизующиеся внутрикомплексные (хелатные) соли меди(II) синего цвета;
Ксантопротеиновая реакция, для обнаружения в составе белка ароматических a-аминокислот: при взаимодействии с концентрированной азотной кислотой образуют нитропроизводные, имеющие желтую окраску. В щелочной среде нитропроизводные этих a-аминокислот дают соли, окрашенные в оранжевый цвет.
18.Углеводы можно определить как альдегидные или кетонные производные полиатомных (содержащих более одной ОН-группы) спиртов или как соединения, при гидролизе которых образуются эти производные.
Согласно принятой в настоящее время классификации, углеводы подразделяются на три основные группы: моносахариды, олигосахариды и полисахариды.
Все моносахариды содержат асимметричные атомы углерода: альдотриозы – один центр асимметрии, альдо-тетрозы – 2, альдопентозы – 3, альдогексозы – 4 и т.д. Кетозы содержат на один асимметричный атом меньше, чем альдозы с тем же числом углеродных атомов. Следовательно, кетотриозадиоксиацетон не содержит асимметричных атомов углерода. Все остальные моносахариды могут существовать в виде различных стереоизомеров.
Общее число стереоизомеров для любого моносахарида выражается формулой N = 2n. Изомер глицеральдегида, у которого при проекции модели на плоскость ОН-группа у асимметричного атома углеродарасположена с правой стороны, принято считать D-глицеральдегидом, а зеркальное отражение – L-глицеральдегидом:

Все изомеры моносахаридов подразделяются на D- и L-формы (D-и L-конфигурация) по сходству расположения групп атомов у последнего центра асимметрии с расположением групп у D- и L-глицеральдегида. Природные гексозы: глюкоза, фруктоза, манноза и галактоза – принадлежат, как правило, по стереохимической конфигурации к соединениям D-ряда.
 D-глюкоза
D-глюкоза  D-фруктоза
D-фруктоза
Известно, что природные моносахариды обладают оптической активностью. Способность вращать плоскость поляризованного луча света.
Помимо открытых форм моносахариды могут существовать в циклических формах:

В растворах присутствуют как открытые, так и циклические формы моносахаридов.
19.Гексозы, C6H12O6, простые сахара — моносахариды, содержащие 6 атомов углерода; в природе встречаются в свободном виде — в виде глюкозидов входят в состав ди- и полисахаридов, эфиров фосфорной кислоты, гликопротеинов.

Рибоза и дезоксирибоза относятся к группе пентоз, входят в состав нуклеотидов РНК и ДНК, рибонуклеозидтрифосфатов и дезоксирибонуклеозидтрифосфатов и др. Дезоксирибоза (С5Н10О4) отличается от рибозы (С5Н10О5) тем, что при втором атоме углерода имеет атом водорода, а не гидроксильную группу, как у рибозы.

Глюкоза, или виноградный сахар (С6Н12О6), относится к группе гексоз, может существовать в виде α-глюкозы или β-глюкозы. Отличие между этими пространственными изомерами заключается в том, что при первом атоме углерода у α-глюкозы гидроксильная группа расположена под плоскостью кольца, а у β-глюкозы — над плоскостью.
 α-D-Фруктофураноза
α-D-Фруктофураноза  β-D-Фруктофураноза
β-D-Фруктофураноза
Фруктоза, или фруктовый сахар (С6Н12О6), относится к группе гексоз, может существовать в виде α-фруктозы или β-фруктозы.
20. Химические свойства моносахаридов.
1.Реакцииполуацетальногогидроксила. Моносахариды как в кристаллическом состоянии, так и в растворе в основном существуют в полуацетальных формах. Полуацетальный гидроксил отличается большей реакционной способностью и может замещаться другими группировками в реакциях со спиртами, карбоновыми кислотами, фенолами и т.д.

2.Реакциис участием карбонильной группы.Линейная форма в кристаллических препаратах моносахаридов и их растворах присутствует в незначительных количествах, но ее участие в таутомерном равновесии обеспечивает моносахаридам все свойства, присущие альдегидам (в альдозах) или кетонам (в кетозах).
Окисление моносахаридов. Обработка альдоз слабыми окислителями приводит к превращению альдегидной группы в положении атома С-1 в карбоксильную группу с образованием так называемых альдоновых кислот. Альдоновой кислотой может быть D-глюконовая кислота, которая образуется при окислении альдегидной группы D-глюкозы. D-галактоновая кислота – продукт окисления альдегидной группы D-га-лактозы.

В альдуроновых, или уроновых, кислотах окислена (с образованием карбоксильной группы) первичная спиртовая группа, а альдегидная группа остается неокислен-ной. Уроновая кислота, образующаяся из D-глюкозы, носит название D-глюку-роновой кислоты, а образующаяся из D-галактозы – D-галактоуроновой кислоты.

Восстановление моносахаридов. Моносахариды легко гидрируются по связи С—О и при этом превращаются в многоатомные спирты (сахароспирты). D-глюкоза, например, образует спирт сорбит, а D-манноза – маннит. Восстановление D-фруктозы приводит к эквимолекулярной смеси эпимеров – D-маннита и D-cop-бита, так как в результате гидрирования второй атом углерода становится асимметричным. Такого рода восстановление может осуществляться и ферментативным путем.
3.Реакции с участием спиртовых гидроксилов, проявляют свойства многоатомных спиртов, образуют простые и сложные эфиры.
21.Дисахариды – сложные сахара, каждая молекула которых при гидролизе распадается на две молекулымоносахаридов. Дисахариды наряду с полисахаридами являются одними из основных источников углеводов в пище человека и животных. По строению дисахариды – это гликозиды, в которых 2 молекулы моносахаридов соединены гликозидной связью.
Среди дисахаридов наиболее широко известны мальтоза, лактоза и сахароза.
Все дисахариды делятся на восстанавливающие, т.е. способные восстанавливать аммиачный раствор оксида серебра(I) и гидроксида меди(II), к ним относится мальтоза, лактоза и целлобиоза и невосстанавливающие, т.е. не способные восстанавливать аммиачный раствор оксида серебра(I) и гидроксида меди(II), к ним относится сахароза.
22.Полисахариды— общее название класса сложных высокомолекулярных углеводов, молекулы которых состоят из десятков, сотен или тысяч мономеров — моносахаридов, соединенных гликозидными связями. К ним относятся: крахмал, гликоген, клетчатка.
Крахмал.Состоит из остатков α - глюкозы. В состав крахмала входят две фракции: амилоза и амилопектин.
Цепь амилозы включает 200 – 1000 остатков α-глюкозы и имеет неразветвленное строение. Амилопектин состоит из разветвленных макромолекул, молекулярная масса которых достигает 1 - 6 млн. Амилоза и амилопектин гидролизуются под действием кислот или ферментов до глюкозы, которая служит непосредственным источником энергии для клеточных реакций, входит в состав крови и тканей, участвует в обменных процессах. Поэтому крахмал – необходимый резервный углевод питания.
Гликоген (животный крахмал). Состоит из остатков α-глюкозы, имеет более разветвленное строение и большую молекулярную массу, чем крахмал. В клетках животных служит основным запасным углеводом и основной формой хранения глюкозы.
Целлюлоза (клетчатка). Состоит из остатков β-глюкозы, имеет линейное строение( вид нити). В отличие от крахмала, содержит большее число структурных звеньев, имеет линейную структуру, нити соединены между собой водородными связями. Не имеет питательной ценности, структурный компонент клеточной стенки растений.
23.Полисахариды, в структуре которых характерно наличие двух или более типов мономерных звеньев, носят название гетерополисахаридов. К ним относятся гиалуроновая кислота, гепарин, хондроитинсульфат.
Гиалуроновая кислота представляет собой поли-(2-ацетамидо-2-дезокси-D-глюко)-D-глюкуроногликан, то есть полимер, состоящий из остатков D-глюкуроновой кислоты и D-N-ацетилглюкозамина, соединённых поочерёдно β-1,4- и β-1,3-гликозидными связями.
Гепарин, протеогликан соединительной ткани, обладающий антикоагулянтным и гиполипидемич. действием.
Гепарин относится к семейству гликозаминогликанов; его молекула представлена несколькими полисахаридными цепями, связанными с общим белковым ядром. Белковое ядро же включает в свой состав в основном остатки двух аминокислот: серина и глицина. В основе последних лежит цепочка из повторяющихся дисахаридов - α-D-глюкозамин и уроновая кислоты, соединенные 1-4 гликозидными связями. Большинств
|
из
5.00
|
Обсуждение в статье: Основность органических соединений. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

