 |
Главная |
Водородные соединения азота
|
из
5.00
|
Химия азота
Азот (лат. nitrogenium) в свободном состоянии газ без цвета и запаха. Азот – основной компонент атмосферы Земли (78,09% по объему или 75,6% по массе, всего около 4·1015 т). Мы живем в азотной атмосфере, умеренно обогащенной кислородом и в малых количествах другими химическими элементами.
В космосе он занимает 4-е место вслед за водородом, гелием и кислородом. В живых организмах его до 0,3% в виде соединений. Растения, получая азот из почвы в виде минеральных солей, используют его для синтеза белков, витаминов и других жизненно важных веществ.
Азот относится к органогенам, наряду с углеродом, водородом и кислородом – элементы, которые чаще всего содержатся в органических веществах. Все важнейшие части клеток (протоплазма и ядро) построены из белковых веществ. Без белка нет жизни, а без азота нет белка.
Свободный азот несколько легче воздуха. Он плохо растворим в воде. Прочность молекулы азота велика. Даже при 3300°С только одна из тысяч молекул N2 распадается на атомы. Поэтому свободный азот в обычных условиях инертен к подавляющему большинству веществ. Для того чтобы азот вступил в химическую реакцию, требуется предварительная активация его молекул путем нагревания, облучения, действие катализатора или другими способами.
Из металлов свободный азот реагирует в обычных условиях только с литием, образуя нитрид:
6 Li + N 2 = 2 Li 3 N
С Na, Ca, Mg реакция идет только при нагревании. С кислородом азот взаимодействует только в электрической дуге (или при грозовом разряде в атмосфере):
N 2 + O 2 = 2 NO
С водородом реакция идет при нагревании (t ≈ 450-5000С), под давлением и в присутствии катализатора
N 2 + 3 H 2 = 2 NH 3
Причина инертности молекулярного азота – крайне прочная ковалентная неполярная связь. Два атома в молекуле удерживаются одной σ - связью и двумя π- связями. Т.е. связи в молекуле азота неравноценны. На разрушение молекулы азота на атомы затрачивается довольно большое количество энергии:
N 2 = 2 N ∆ H 0 = 946 кДж/моль
Строение молекулы N2

Водородные соединения азота
С водородом азот образует два соединения: аммиак NH 3 и гидразин N 2 H 4 (H2N – NH2). Наибольшее значение имеет аммиак.
В лаборатории получают слабым нагреванием смеси хлорида аммония с гидроксидом натрия:
NH 4 Cl + NaOH = NaCl + NH 3 + H 2 O
Основным промышленным способом получения аммиака является синтез его из азота и водорода
N 2 + 3 H 2 ↔ 2 NH 3 ∆ Н0 = - 82,4
( Катализатор Pt ; t = 450 - 5000С; Р = 250 атм)
Равновесие обратимой реакции смещается вправо действием высокого давления ≈ 30МПа.
NH3 – бесцветный газ с резким характерным запахом, почти в 2 раза легче воздуха. Молекула NH3 поляризована – общие электронные пары сдвинуты к азоту. Кроме того, у атома азота остается неподеленной пара электронов. Это дополнительно увеличивает полярность и обуславливает многие свойства аммиака. Жидкий аммиак, подобно воде, хороший растворитель ионных соединений. Молекулы в жидком аммиаке ассоциированы за счет образования водородных связей.
Расположение связей в аммиаке тетраэдрическое, причем неподеленная пара электронов атома азота занимают одну из вершин тетраэдра.
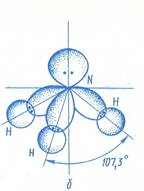
Аммиак – очень реакционно-способное вещество. Для него характерны реакции окисления и присоединения (благодаря неподеленной паре электронов). Наличие неподеленной пары определяет основные свойства аммиака, который может присоединять протон, образуя ион аммония NH 4 + .

NH3 очень хорошо растворим в воде, но максимальная концентрация ω(NH3)= 25%. В растворе имеют место равновесия:
NH3 + H2O ↔ NH3 • H2O NH3 • H2O ↔ NH4OH
NH 4 OH ↔ NH 4 + + OH – K д NH 4 OH = 1,8 • 10- 5
Основная масса NH3 в растворе находится в виде гидрата аммиака NH3 · H2O. Поэтому, хотя NH4OH диссоциирует почти нацело, его условно считают слабым основанием. Поскольку азот в NH3 имеет низкую степень окисления –3, аммиак является восстановителем в ряде реакций.
В кислороде аммиак горит без катализатора:
4 NH 3 + 3 O 2 = 2 N 2 + 6 H 2 O ,
а в присутствии катализатора платины
4 NH 3 + 5 O 2 = 4 NO + 6 H 2 O
При нейтрализации раствора аммиака кислотами образуются растворы солей аммония, содержащие ион NH4+.
NH3 + HCl = NH4Cl
NH3 + H2SO4 = (NH4)2SO4
В этих реакциях ион аммония подобен ионам одновалентных металлов.
NH3 всегда - восстановитель, окисляется до N2 или NO.
t
CuO + NH3 → Cu +N2 +H2O
На этом свойстве основано применение NH3 и его солей в процессе пайки металлов – снятие оксидной пленки с поверхности.
CuO + NH4Cl = Cu +N2 +HCl + H2O
Аммиак участвует в реакциях комплексообразования, где NH3 является лигандом – донором электронов.
CuSO4 + 4NH3 = [Cu(NH3)4]SO4 Кн = 10-13
Hg(NO2)2 + 4NH3 = [Hg(NH3)4](NO3)2 Кн = 10-20
Водные растворы NH3 используют для получения гидроксидов металлов.
Fe2(SO4)3 + NH3 + H2O = Fe(OH)3↓ + (NH4)2SO4
Соли аммония все растворимы в воде, разлагаются при температуре различным образом
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O
NH4NO2 = N2 + 2H2O
NH4NO3 = NO + 2H2O
NH4Cl = NH3 + HCl
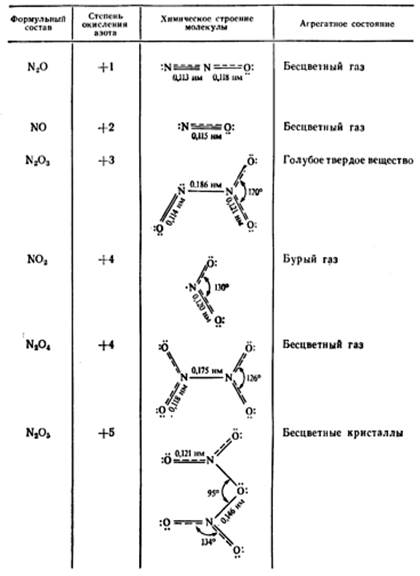
С оксидами азота связаны серьезные экологические проблемы. Увеличение их концентрации в атмосфере приводит к образованию азотной кислоты и соответсвенно кислотных дождей.
N2O3 взаимодействует с водой, образует неустойчивую азотистую кислоту HNO2, которая существует только в разбавленных растворах, так как легко разлагается
2 HNO 2 = N 2 O 3 + H 2 O .
HNO2 может быть более сильным восстановителем, чем HNO3, о чём свидетельствуют значения стандартных электродных потенциалов.
HNO 3 + 2 Н+ + 2е = HNO 2 + Н2О Е0 = + 0,93 В
HNO2 + Н + + 1 е = NO + H2O Е 0 = + 1,10 В
HNO2 + 1e = NO + H+ Е 0 = + 1,085 В
Ее соли нитриты – устойчивы. HNO2 - кислота средней силы (К ≈ 5 · 10–4). Наряду с кислотной диссоциацией в незначительной степени идет диссоциация с образованием NO+ и OH–.
Степень окисления азота в нитритах промежуточная (+3), поэтому в реакциях он может вести себя и как окислитель, и как восстановитель, т.е. обладает окислительно-восстановительной двойственностью.
Сильные окислители переводят NO2– в NO3–.
5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O
Сильные восстановители обычно восстанавливают HNO2 до NO.
2NaNO2 + 2KI + 2H2SO4 = Na2SO4 +2NO + I2 + K2SO4 +2H2O
Может происходить также процесс диспропорционирования, одновременного увеличения и уменьшения степени окисления атомов одного и того же элемента.
3 HNO 2 = HNO 3 + 2 NO + H 2 O
Нитриты обладают токсичностью: переводят гемоглобин в метгемоглобин, не способный переносить кислород и они служат причиной образования в продуктах питания нитрозааминов R2N–NO – канцерогенных веществ.
Важнейшее соединение азота – HNO 3
Азотная кислота – важнейший продукт основной химической промышленности. Идет на приготовление взрывчатых веществ, лекарственных веществ, красителей, пластических масс, искусственных волокон и др. материалов.
HNO3 – бесцветная жидкость с резким удушливым запахом, дымящая на воздухе. В небольших количествах образуется при грозовых разрядах и присутствует в дождевой воде.
N2 + O2 → 2NO
2NO + O2 → 2NO2
4NO2 + O2 + 2H2O → 4HNO3
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету или при нагревании процесса разложения
4 HNO 3 = 4 NO 2 + 2 H 2 O + O 2
HNO3 – очень опасное вещество.
Важнейшее химическое свойство HNO3 состоит в том, что она является сильным окислителем и поэтому взаимодействует почти со всеми металлами кроме Au, Pt, Rh, Ir, Ti, Ta, металлы Al, Fe, Co, Ni и Cr она «пассивирует». Кислота же в зависимости от концентрации и активности металла может восстанавливаться до соединений:
+4 +3 +2 +1 0 -3 -3
NO2 → HNO2 → NO → N2O → N2 → NH3 (NH4NO3)
и также образуется соль азотной кислоты.
Как правило, при взаимодействии азотной кислоты с металлами не происходит выделения водорода. При действии HNO3 на активные металлы может получаться водород. Однако атомарный водород в момент выделения обладает сильными восстановительными свойствами, а азотная кислота – сильный окислитель. Поэтому водород окисляется до воды.
Свойства концентрированной и разбавленной HNO 3
1) Действие концентрированной HNO3 на малоактивные металлы (Cu, Hg, Ag)
Cu + 4 HNO3 = Cu(NO3)2 + 2NO2 ↑ + 2H2O
2) Действие разбавленной HNO3 на малоактивные металлы
3Cu + 8 HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
3) Действие концентрированной кислоты на активные металлы
4Ca + 10HNO3 = 4Ca(NO3)2 + N2O↑ + 5H2O
4) Действие разбавленной HNO3 на активные металлы
4Ca + 10 HNO3 = 4Ca(NO3)2 + NH4NO3 + 3H2O
Образование продуктов зависит от концентрации, чем выше концентрация, тем менее глубоко она восстанавливается. Реагирует со всеми металлами, кроме Au, Pt, W. Концентрированная HNO3 не взаимодействует при обычных условиях с Fe, Cr, Al, которым она пассивирует, но при очень сильном нагревании реагирует с этими металлами.
Большинство неметаллов и сложных веществ восстанавливается HNO3 до NO (реже NO2).
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
S + HNO3 = H2SO4 + 2NO
HNO3 – сильная одноосновная кислота, образует только средние соли -нитраты, которые получают действием ее на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Их растворы обладают незначительными окислительными свойствами.
При нагревании нитраты разлагаются; нитраты щелочных металлов превращаются в нитриты и выделяется кислород.
2 KNO 3 = 2 KNO 2 + O 2
Состав других продуктов зависит от положения металла в РСЭП.
Левее Mg = MeNO2 + O2
MeNO3 = Mg – Cu = MeO + NO2 + O2
правее Cu = Me + NO2 + O2
|
из
5.00
|
Обсуждение в статье: Водородные соединения азота |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

