 |
Главная |
Описание установки и методика измерений
|
из
5.00
|
Установка (рис. 52) состоит из фотосопротивления, помещенного внутрь футляра с завинчивающейся насадкой 1, микроамперметра 2, источника света 3, оптической скамьи 4. Питание установки осуществляется непосредственно от сети переменного тока.

Рис. 52
Световой поток изменяется перемещением источника света вдоль оптической скамьи (см. методику измерений в работе № 61) и рассчитывается по формуле

где S – площадь окна фотосопротивления,
 - сила света источника
- сила света источника
Фототок отсчитывается по микроамперметру. Интегральную чувствительность  фотосопротивления определяем для каждого значения светового потока Ф.
фотосопротивления определяем для каждого значения светового потока Ф.
Порядок выполнения работы
1. Включают с помощью кнопки 5 электрическую цепь с фотосопротивлением (при открытом окошке фотосопротивления) и отмечают величину темнового тока IT ).
2. Включают с помощью кнопки 6 источник света и постепенно приближая его к фотосопротивлению, снимают величину фототока Iф = I /- IT (где I / - величина фототока, текущего через микроампер). Отсчеты производят, изменяя расстояние на 5 см. Результаты записывают в табл. 1.
3. Зная расстояние r от источника света до фотосопротивления, площадь окна фотосопротивления S и силу света  источника, определяют световой поток Ф.
источника, определяют световой поток Ф.
4. Строят графики зависимости силы фототока от светового потока Iф = f (Ф) и зависимость интегральной чувствительности от светового потока Ф.
5. Провести обработку полученных результатов следует так же, как это было рекомендовано в работе № 61.
Таблица 1
Темновой ток IT =
| r (см) | |||||||||||
| Iф (мкА) | |||||||||||
| Ф (лм) | |||||||||||
 (мкА/лм) (мкА/лм)
|
Контрольные вопросы
1. Каков механизм внутреннего фотоэффекта?
2. Каков механизм электропроводности полупроводников согласно зонной теории?
3. Фотосопротивление и его применение.
4. Что называется интегральной чувствительностью фотосопротивления?
5. Что такое темновой ток фотосопротивления?
6. Чем определяется красная граница внутреннего фотоэффекта?
Лабораторная работа №64
Изучение спектра атома водорода и определение постоянной Ридберга
Литература:
Детлаф А.А., Яворский Б.М. «Курс физики», М., «Высшая школа» 1999, глава 38.
Трофимова Т.И. «Курс физики», –М.: «Высшая школа»,2002,гл.27 §§208-212
Теоретическое введение.
Все современное учение о спектрах электромагнитного излучения базируется на квантовой теории. Впервые квантовые представления были введены в спектроскопию Бором, объяснившем в 1913 году спектр простейшего атома – атома водорода. Сформулированные Бором два постулата – о существовании стационарных состояний и о квантовых переходах с излучением – получили в дальнейшем всестороннее экспериментальное подтверждение на огромном опытном материале атомной физики и нашли глубокое теоретическое обоснование в квантовой механике и квантовой электродинамике.
Первый постулат (постулат стационарных орбит): атомная система может находиться только в некоторых состояниях, в которых не происходит излучения, хотя при этом все заряженные частицы в атоме движутся. Такие состояния называются стационарными состояниями атома.
Второй постулат (правило частот): любое испускание или поглощение энергии атомов происходит при переходе атома из одного стационарного состояния в другое. При переходе атома из стационарного состояния с энергией Wn в состояние с энергией Wm излучается или поглощается квант, частота которого определяется уравнением:
 (116)
(116)
где h – постоянная Планка (h = 6,626 · 10-34 Дж· с)
Для наглядного представления возможных энергетических состояний атомов используются энергетические диаграммы, на которых каждое стационарное состояние атома отмечается горизонтальной линией, называемой энергетическим уровнем. Все стационарные состояния являются стационарными лишь условно. Бесконечно долго каждый атом может находиться лишь в стационарном состоянии с минимальной энергией W 1 . Это состояние атома называется основным. Все остальные стационарные состояния атома с энергиями W 2 , W 3 , ….., Wn называются возбужденными состояниями атома (рис.53). Переходы атома из одного состояния в другое изображаются вертикальными линиями между соответствующими уровнями на диаграмме энергий, направление перехода обозначается стрелкой (рис.54).

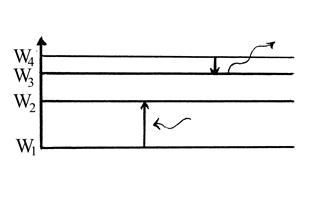
рис. 53 рис. 54
В результате соударения с другим атомом, с любой заряженной частицей или при поглощении фотона атом может перейти из стационарного состояния с меньшей энергией в стационарное состояние с большей энергией. Из любого возбужденного состояния атом самопроизвольно переходит в основное состояние или в другое возбужденное состояние с меньшей энергией. Этот переход сопровождается излучением фотонов. Время жизни атомов в возбужденных состояниях обычно не превышает 10-7 - 10-9 с.
Основное изменение, внесенное в физику атома постулатами Бора, заключалось в отказе от представлений о непрерывности изменения всех физических величин и в принятии идеи квантования значений физических величин, которыми описывается внутреннее состояние атома.
Рассмотрим элементарную боровскую теорию водородоподобного атома. Задолго до создания теории Бора, был известен ряд эмпирических формул, хорошо объясняющих закономерность в расположении линий в атомных спектрах целого ряда элементов, в частности, в спектрах атома водорода линии всех серий были представлены формулой Бальмера-Рица
 (117)
(117)
где R = 3,293 · 1015 с-1 – постоянная Ридберга.
Причем при переходе между определенными нижним уровнем ( m фиксировано) и последовательными верхними уровнями ( nменяется от m + 1 до ¥ ) получались соответствующие спектральные серии атомов водорода: m = 1 и n ≥ 2 – серия Лаймана; m = 2 и n ≥ 3 – серия Бальмера; m = 3 и n ≥ 4 – серия Пашена; m = 4 и n ≥ 5 – серия Брекета; m = 5 и n ≥ 6 – серия Пфундта; m = 6 и n ≥ 7 – серия Хамфри.
Для того, чтобы правильно объяснить наблюдающиеся в спектре закономерности, Бору пришлось ввести дополнительный постулат – правило квантования для круговых орбит, состоящее в том, что при движении по круговой орбите момент импульса электрона в атоме принимает дискретный ряд значений:
 ( n = 1, 2, 3…..) (118)
( n = 1, 2, 3…..) (118)
где  Дж ∙ с – постоянная Планка
Дж ∙ с – постоянная Планка
me – масса электрона
u – его скорость
r – радиус круговой орбиты
Согласно представлениям Бора, движение электронов вокруг ядра в стационарных состояниях определяется законами обычной механики, для описания же процессов перехода атома из одного состояния в другое эти законы не применимы, и следует воспользоваться квантовыми представлениями.
Квантование орбитального момента импульса электрона для случая круговых орбит приводит к квантованию значений радиуса возможных круговых стационарных орбит. Центростремительное ускорение при движении электрона по одной из стационарных орбит в атоме водорода определяется вторым законом Ньютона, где F – это кулоновская сила притяжения:



откуда
 (119)
(119)
С другой стороны, скорость движения электрона и радиус его круговой орбиты связаны условием ( 117 ). Из этих формул следует, что возможно движение электрона в атоме лишь по стационарным круговым орбитам, радиусы которых определяются выражением:
 (120)
(120)
Подставляя в последнее выражение значения n =1, n =2 и т. д., можно вычислить радиусы первой, второй и всех последующих стационарных круговых орбит электронов в атоме. Радиус первой орбиты, называемый радиусом Бора, равен:

что хорошо согласуется с размером атома, полученным на основе молекулярно-кинетической теории.
Потенциальная энергия W р электростатического взаимодействия электрона с ядром атома водорода определяется формулой:
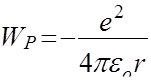 (121)
(121)
Кинетическая энергия электрона при движении по круговой орбите равна:
 (122)
(122)
Подставляя значение u из ( 119 ), получаем:
 (123)
(123)
Полная энергия системы W равна:
 (124)
(124)
Подставляя значение радиуса (120), получаем значение полной энергии атома водорода в стационарном состоянии:
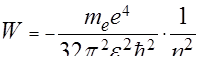 (125)
(125)
Целое число n = 1, 2, 3… называется главным квантовым числом. При переходе электрона со стационарной круговой орбиты радиусом rn на стационарную круговую орбиту rm изменение энергии атома равно:
 (126)
(126)
Частота кванта n mn , соответствующая этому переходу равна:
 (127)
(127)
Величина
 (128)
(128)
равна постоянной Ридберга. С учетом этой формулы (127) принимает вид:
 или
или  (129)
(129)
где

Формулу (129) называют обобщенной формулой Бальмера. Подставим значение m = 2, получим формулу Бальмера для видимой части спектра:
 или
или 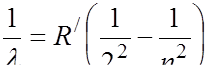 (130)
(130)
Эта формула будет использована нами в ходе выполнения работы. При m=3 получим формулу Пашена для инфракрасной части спектра. При m=1 получим серию в ультрафиолетовом участке спектра, которая называется серией Лаймана.
Расчет спектра водорода был серьезным успехом теории Бора. При этом удалось объяснить происхождение различных серий в спектре водорода. Серия Лаймана возникает, например, при переходе атома из второго, третьего и более высоких возбужденных состояний в первое основное состояние, серия Бальмера – при переходе из возбужденного состояния во второе, серия Пашена – при переходе на третий уровень.
На основании полученных по теории Бора результатов расчета на рис.55 приведена схема уровней энергии и переходов между ними у атома водорода. Уровни энергии, начиная с самого глубокого, образуют дискретную последовательность, соответствующую связанным состояниям электрона и сходящуюся к границе ионизации, соответствующей отрыву электрона от ядра. Выше границы ионизации получается непрерывная последовательность уровней энергии, соответствующая свободным состояниям электрона.

Рис.55
Наряду с дискретным спектром, для атома водорода получается и сплошной спектр при переходах, показанных на диаграмме жирными линиями, с дискретных уровней на непрерывные (и обратно) и с непрерывных уровней на непрерывные.
Теория Бора, хорошо описавшая спектр атома водорода, тем не менее очень далека от совершенства. И это объясняется ее внутренней логической противоречивостью: она не была ни последовательно классической, ни последовательно квантовой теорией. Последовательное объяснение всех атомных явлений дает квантовая механика и квантовая электродинамика.
Описание прибора и метода измерений.
В ходе выполнения работы используются следующие приборы и принадлежности: спектроскоп, ртутная лампа и водородная лампа.
Оптическая схема спектроскопа приведена на рис.56

Рис.56
Основными оптическими элементами спектроскопа являются: коллиматор 1, диспергирующая призма 4 и зрительная труба 6. Коллиматор состоит из объектива 2 и щели 3, установленной в фокальной плоскости этого объектива для того, чтобы свет, идущий через щель, падал на призму параллельным пучком. В призме свет разлагается на составляющие, которые выходят из нее под равными углами в зависимости от длины волны. Зрительная труба состоит из объектива 5 и окуляра 7. Пучки параллельных лучей, выходящих из призмы собираются объективом 5 в его фокальной плоскости и рассматриваются с помощью окуляра 7. Коллиматорный объектив и зрительная труба (камерный объектив) расположены под углом 900 друг к другу. Поворачивая призменный столик на различные углы относительно падающего пучка света, можно вывести для наблюдения различные участки длин волн этого излучения, проходящего через призму в минимуме угла отклонения. Наблюдаемый таким образом спектр, представляет собой множество дифракционных изображений щели коллиматора, окрашенных в различные цвета.
Для градуировки прибора используются линейчатый спектр ртути, получаемый с помощью ртутной лампы высокого давления ДРШ-1000. Длины волн линий ртути, их качественная цветовая оценка и интенсивность в десяти бальной шкале приведены в табл.1. Лампа укреплена в специальном держателе, установленном внутри кожуха, предназначенного для защиты глаз от сильного ультрафиолетового излучения лампы. Кожух с лампой укреплен на подставке, установленной на оптической скамье.
В качестве источника света, обеспечивающего излучение спектра водорода, используется стеклянная трубка с капилляром посередине, наполненная очищенным водородом при давлении около 1 мм.рт.ст. Капиллярная часть трубки укрепляется близко (и параллельно) к щели, ибо при включении высокого напряжения от индукционной катушки в капилляре происходит наибольшее свечение. Необходимо отметить, что при данной конструкции разрядной трубки наряду со спектром атомарного водорода, сериальные закономерности которого изучаются в работе, наблюдается полосатый спектр молекулярного водорода.
Так как характер обоих спектров различен, то несмотря на их перекрывание, нужные нам линии серии Бальмера хорошо наблюдаются.
ВНИМАНИЕ! Ртутная и водородная лампы включаются только под наблюдением лаборанта. Ртутную лампу не следует снимать со скамьи или перемещать по скамье.
Порядок выполнения работы.
Градуировка спектроскопа.
Градуировка спектроскопа заключается в нахождении графической зависимости между длиной волны выходящего светового потока и делениями шкалы барабана прибора. Для этого необходимо сделать следующее:
Включить ртутную лампу и осветительную систему прибора.
Наблюдая спектр лампы, сфокусировать треугольный индекс кольцом 8. Вращая барабан спектроскопа, просмотреть весь спектр, фокусируя спектральные линии винтом.
Подвести к индексу правую из трех фиолетовых линий. Провести отсчет по барабану спектроскопов, полученный результат занести в табл. 1. При проведении измерений следует иметь в виду, что для того, чтобы избежать влияния люфта барабана спектроскопа, спектральную линию нужно подводить к индексу всегда с одной и той же стороны – либо со стороны красной, либо со стороны фиолетовой частей спектра.
Выключить ртутную лампу.
Включить водородную лампу.
Надежно установить соответствующие линии, произвести отсчет их положений по шкале барабана и данные записать в табл.2.
Выключить водородную лампу и осветительную систему прибора.
Таблица 1.
| Окраска линий | Интенсивность | Длина волны (мкм) | Отсчет по барабану (деления шкалы) |
| Красная слабозаметная Красная Красная слабозаметная Желтая (яркая) Желтая (яркая) Светло-зеленая (яркая) Сине-зеленая (правая) Сине-фиолетовая (яркая) Сине-фиолетовая Сине-фиолетовая Фиолетовая (слабозаметная) Фиолетовая Фиолетовая (яркая) | 4 5 4 10 10 10 10 10 6 6 5 7 8 | 0,623 0,612 0,607 0,579 0,576 0,546 0,492 0,436 0,435 0,433 0,411 0,407 0,405 |
Таблица 2
| Окраска линий | n | Отсчет по барабану в делениях шкалы | Длины волн | R / м-1 | R / ср м-1 |
| Красная Зелено-голубая Фиолетовая | 3 4 5 |
|
из
5.00
|
Обсуждение в статье: Описание установки и методика измерений |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

