 |
Главная |
Смеси идеальных газов
|
из
5.00
|
Содержание
| Введение…………………………………………………………….……………….. | стр. |
| 1. Параметры состояния рабочего тела……………………………………………. | стр. |
| 2. Основные газовые законы……………………..………………............................ | стр. |
| 3. Смеси идеальных газов………………..…………………………………………. | стр. |
| 4. Теплоемкость газов……………….……………………...……….……………… | стр. |
| 5. Первый закон термодинамики…………..………….…………………………… | стр. |
| 6. Основные термодинамические процессы………………………………………. | стр. |
| 7. Второй закон термодинамики…………………………………………………… | стр. |
| 8. Круговые процессы……………………………………………………………… | стр. |
| 9.Истечение газов и паров. Дросселирование……………………………… | стр. |
| 10. Пары. Водяной пар……………………………………………………………… | стр. |
| 11.Влажный воздух…………………………………………………………………. | стр. |
| Заключение…………………………………………………………………………… | стр. |
| Список использованных источников и литературы……………………………….. | стр. |
| Приложения…………………………………………………………………………… | стр. |
Введение
Теплотехника — общетехническая наука, изучающая методы получения, преобразования, передачи и использования теплоты, а также принцип действия и конструктивные особенности тепло- и парогенераторов тепловых машин, агрегатов и устройств. Теоретическими разделами теплотехники, в которых исследуются законы превращения и свойства тепловой энергии, а также процессы распространения теплоты являются техническая термодинамика и теория теплообмена. В развитии теплотехники и её теоретических основ большая заслуга принадлежит российским учёным. Д. И. Менделеев провёл фундаментальные работы по общей теории теплоёмкостей и установил существование для каждого вещества критической температуры. М. В. Ломоносов создал основы молекулярно-кинетической теории вещества и установил взаимосвязь между тепловой и механической энергией.
Параметры состояния рабочего тела.
Задача № 4
Условие: Давление воздуха, измеренное ртутным барометром, равно 765 мм при температуре ртути 20°С. Выразить давление в барах.
Решение:
1). Показание барометра получено при температуре t = 20°С. Это показание необходимо привести к 0 ºС по уравнению:
Ро= Рt  (1 - 0,000172
(1 - 0,000172  t) (1.1)
t) (1.1)
где Р0- показание прибора, приведенное к 0°С, мм рт. ст.;
Рt- действительная высота ртутного столба при температуревоздуха t° С, мм рт. ст.;
0,000172 - коэффициент объемного расширения ртути.
Ро = 765  (1 - 0,000172
(1 - 0,000172  20) = 764,996 мм рт. ст.
20) = 764,996 мм рт. ст.
2). Зная, что 1 мм рт. ст. = 133,3 Па, определим давление воздуха в барах:
Р = Ро  133,3 = 764,996
133,3 = 764,996  133,3 = 101974 Па = 1,02 бар
133,3 = 101974 Па = 1,02 бар
Ответ: Р= 1,02 бар
Основные газовые законы.
Задача № 39
Условие: В цилиндрическом сосуде, имеющем внутренний диаметр 0,6 м и высоту 2,4 м, находится воздух при температуре 18°С. Давление воздуха составляет 7,65 бар. Барометрическое давление (приведенное к нулю) равно 764 мм рт. ст. Определить массу воздуха в сосуде.
Решение:
1). Определим абсолютное давление действующее в сосуде по формуле:
Рабс = Ратм + Ризб (2.1)
где Ратм— атмосферное или барометрическое давление, измеряемое
барометром;
Ризб– избыточное давление, измеряемое манометром.
Так как барометр показал давление Ро= 764 мм рт. ст. то:
Ратм= Ро  133,3 = 764
133,3 = 764  133,3 = 101841 Па = 1,018 бар;
133,3 = 101841 Па = 1,018 бар;
Из этого следует, что:
Рабс = 1,018 + 7,65 = 8,668 бар
2). Для дальнейшего решения задачи необходимо найти объем сосуда:
 = 0,67 м3 (2.2)
= 0,67 м3 (2.2)
3). Характеристическое уравнение для газа :
Рабс  V = m
V = m  R
R  T (2.3)
T (2.3)
где Рабс — абсолютное давление газа, Па;
V — объем газа, м3;
m — масса газа, кг;
R — газовая постоянная, Дж/(кг・К).
Значение газовой постоянной берем из таблицы (приложение А).
Получаем:
Rвоз= 287 Дж/(кг·К)
Следовательно, преобразив формулу (2.3) мы можем найти массу воздуха в сосуде:

Ответ: m= 6,95 кг
Задача № 55
Условие:По трубопроводу протекает 10 м3/с кислорода притемпературе 127°С и давлении 4 бар. Определить массовый расходгаза в секунду.
Решение:
1).Для нахождения массы кислорода протекающей через трубопровод воспользуемся преобразованной формулой (2.3):
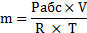
Значение газовой постоянной для кислорода берем из таблицы (приложение А).
Rкисл= 259,8 Дж/(кг·К)
Получаем:

Соответственно массовый расход газа за 1 секунду будет равен:
G = 38,4 кг/с
Ответ: G = 38,4 кг/с
Смеси идеальных газов.
Задача № 60
Условие: Определить газовую постоянную смеси газов, состоящей из1 м3генераторного газа и 1,5 м3воздуха, взятых при нормальных условиях, и найти парциальные давления составляющих смеси. Плотность генераторного газа принять равной 1,2 кг/м3.
Решение:
1). Определим объемные доли газов по формуле:
ri  (3.1)
(3.1)
гдеVi— приведенные объемы (объем каждого компонента отнесен к давлению и температуре смеси) компонентов газов, входящих в смесь м3;
Vсм.— общий объем газовой смеси, м3.
rг.г.= 
rвоз.= 
2). Определим парциональные давления составляющих смеси:
Рг.г. = Рсм 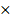 rг.г= 0,4Рсм
rг.г= 0,4Рсм
Рвоз.= Рсм 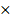 rвоз.= 0,6Рсм
rвоз.= 0,6Рсм
3).Найдем массы газов:
m = V 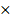 ρ(3.2)
ρ(3.2)
гдеρ- плотность газа, кг/м3, для воздуха ρ= 1,29 кг/м3
mг.г. = Vг.г  ρг.г= 1
ρг.г= 1  1,2 = 1,2 кг
1,2 = 1,2 кг
mвоз. = Vвоз.  ρвоз.= 1,5
ρвоз.= 1,5  1,29 = 1,935 кг
1,29 = 1,935 кг
mсм.=mг.г.+ mвоз. = 3,135 кг
4). Уравнение состояния газов для произвольного количества выглядит так:
Рабс  V = m
V = m  R
R  T (3.3)
T (3.3)
где Рабс — абсолютное давление газа, Па;
V — объем газа, м3;
m — масса газа, кг;
R — газовая постоянная, Дж/(кг・К).
Выразим из формулы (3.3) газовую постоянную:
 (3.4)
(3.4)
Мы знаем, что смесь газов находится в нормальных условиях т.е.:
Ратм= 101325 Па, Т= 2730 К
А также что: Рабс= Ратм , из этого следует что:
 Дж/(кг·К)
Дж/(кг·К)
Ответ: Rсм=295Дж/(кг·К)
Рг.г= 0,4Рсм
Рвоз= 0,6Рсм
Теплоемкость газов.
Задача № 75
Условие: Определить среднюю массовую теплоемкость углекислого газа при постоянном давлении в пределах 0 - 825оС, считая зависимость от температуры нелинейной.
Решение:
1). Среднюю массовую теплоемкость газа при постоянном давлении можно определить по формуле:
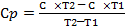 (4.1)
(4.1)
гдеС - средняя массовая теплоемкость углекислого газа при постоянном давлении при температуре 8250 С; С = 1,0852 кДж/кг·К
С - средняя массовая теплоемкость углекислого газа при постоянном давлении при температуре 00 С; С = 0,8148 кДж/кг·К
 = 1,174 кДж/кг·К
= 1,174 кДж/кг·К
Ответ: Сp = 1,174 кДж/кг·К
|
из
5.00
|
Обсуждение в статье: Смеси идеальных газов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

