 |
Главная |
Промышленные термические процессы
|
из
5.00
|
Теоретические разработки механизма термических процессов, происходящие при переработке нефти легли в основу технологического оформления ряда промышленных процессов.
8.6.1. Термический крекинг. К чисто термическому процессу относится термический крекинг, первая промышленная установка которого была пущена в 1912 г. с целью получения автобензина. Однако из-за постоянного ужесточения требований к качеству бензинов за последние 50 лет термический крекинг для этой цели уже не применяется, и классическая технология этого процесса перестала существовать. Эксплуатируемые в настоящее время установки «легкого» крекинга служат для получения вакуумного газойля и маловязкого котельного топлива. Современные крекинг-процессы включают, как правило, комплексную переработку тяжелого нефтяного сырья и содержат установки легкого крекинга (висбрекинга), при 400 – 450 оС, каталитического крекинга, гидроочистки, производства оксигенатов и т. д.
8.6.2. Промышленный пиролиз. Как уже упоминалось ранее, он предназначен для получения низших алкенов (этилена и пропилена), а также 1,3-бутадиена, стирола и некоторых других продуктов. Сырьем для процесса служат разнообразные нефтепродукты. В США – это главным образом газообразные углеводороды. В России, странах СНГ, Западной Европе, наряду с газообразными алканами, применяют бензиновые и керосино-газойлевые фракции. При пиролизе бензиновых фракций примерный состав продуктов процесса следующий, % масс.: метан 12 – 16; этилен 22 – 32; пропилен 10 – 17; фракция С4 5 – 12; арены С6 – С8 6 – 13; смолы 4 – 8. Кроме того, в процессе образуются водород, фракция С5 и др.
При пиролизе керосино-газойлевых фракций выход метана и этилена существенно снижается, пропилена почти не изменяется, но зато значительно возрастает доля жидких продуктов, в т. ч. смол, причем общее количество жидких продуктов может достигать 50 %.
Для повышения выхода низших олефинов из керосино-газойлевых фракций до уровня выхода из газообразных алкенов керосино-газойлевые фракции необходимо подвергнуть предварительной гидрообработке (гидроочистке, гидрокрекингу, гидродеароматизации). Эти виды каталитической обработки снижают количество ароматики в сырье, что приводит также к пониженному коксованию сырья.
8.6.3. Коксование. Промышленные процессы коксования проводят с использованием остаточного нефтяного сырья: мазута, полугудронов, гудронов, тяжелой пиролизной смолы, крекинг-остатков и др.
Промышленностью реализованы три различные технологии:
1) коксование в кубах; 2) замедленное коксование в необогреваемых камерах и 3) коксование в псевдоожижженом слое кокса-порошка.
Наибольшее распространение получил второй способ, который ведут при 480–520 оС и давлении 0,2–0,3 МПа. Продукты процесса – кокс, газ, бензин, легкий и тяжелый газойли. Соотношение продуктов процесса зависит от состава сырья, параметров процесса и аппаратурного оформления.
Контрольные вопросы
1. Дайте сравнительную характеристику устойчивости углеводородов различных классов с повышением температуры.
2. Объясните основные положения теории радикально-цепного механизма термических реакций углеводородов, согласно теории Н. Н. Семенова.
3. В чем суть стадии инициирования цепи? Дайте определение понятия  -связи на примерах алкена, алкина, циклоалкана, арена. В чем ее особенность по сравнению с другими связями С – С и С – Н?
-связи на примерах алкена, алкина, циклоалкана, арена. В чем ее особенность по сравнению с другими связями С – С и С – Н?
4. По каким механизмам могут образовываться радикалы? Приведите ряд стабильности различных радикалов по мере ее снижения.
5. Приведите реакции, в которые вступают радикалы. Укажите их тепловые эффекты.
6. Приведите реакции углеводородов, приводящие к обрыву цепи.
7. Приведите условия и механизм термических превращений алканов.
8. Приведите условия и механизм термических превращений циклоалканов.
9. Приведите условия и механизм термических превращений алкенов.
10. Приведите условия и механизм термических превращений алкадиенов и алкинов.
11. Приведите условия и механизм термических превращений аренов.
12. Объясните особенности процесса пиролиза углеводородов и его задачи.
13. Объясните особенности процесса коксования углеводородов и его задачи.
ТЕМА 9.
Термокаталитические реакции углеводородов
нефти и газа
В настоящее время доля каталитических процессов в нефтепереработке и нефтехимии составляет свыше 80 % от всей продукции. При этом следует отметить, что в новейших процессах их вклад еще больше – 90 %.
Основные каталитические процессы в нефтепереработке – это каталитический крекинг, каталитический риформинг, гидроочистка, гидрокрекинг, алкилирование, изомеризация и др.
Основные понятия о катализе и катализаторах
По механизму взаимодействия реагирующих веществ с катализатором и по типу промежуточных продуктов различают окислительно-восстановительные (гидрирующе-дегидрирующие) и кислотно-основные катализаторы.
Многие каталитические системы являются бифункциональными. Примером может служить катализатор риформинга, в котором платина несет окислительно-восстановительную функцию, а носитель платины – оксид алюминия – кислотно-основную. Кроме того, многие оксиды и сульфиды металлов обладают обеими этими функциями. Наибольшее место в нефтепереработке занимает гетерогенный катализ, осуществляемый с помощью активной поверхности твердых соединений.
9.1.1. Основные свойства катализаторов. Из химии известно, что одна и та же реакция может осуществляться на разных катализаторах и даже без них. Отличие заключается лишь в том, с какой скоростью протекает реакция в каждом таком случае. Например, если принять скорость гидрирования этилена по реакции Н2С = СН2 + Н2 = С2Н6 на хромовом катализаторе за единицу, то скорость на никелевом катализаторе составит 13, платиновом – 100, палладиевом – 1000, а на родиевом – 1800. Отсюда следует, что в данном случае родий (Rh) обладает наибольшей активностью.
Обычно каталитические процессы протекают по двум и более направлениям. В связи с этим перед катализатором ставится требование обеспечить протекание процесса с наибольшим выходом целевого продукта. Способность катализатора выполнять такую задачу и называется селективностью.
Стабильностью катализатораназывают способность его сохранять активность в течение длительного времени. В гомогенных процессах катализаторы, как правило, менее стабильны, чем в гетерогенных, т. к. в первых наблюдается разбавление катализатора продуктами процесса. Причины снижения активности гетерогенных катализаторов более разнообразны. Они связаны как с физическими, так и с химическими факторами. При длительном воздействии на катализатор повышенных температур и давлений может происходить рекристаллизация катализаторов, приводящая к снижению его удельной поверхности и числа активных центров. Для повышения стойкости к рекристаллизации в катализатор вводят структурообразующие добавки – промоторы. Например, в серебряный катализатор реакции:
Ag

 СН2 = СН2 + О2 СН2 – СН2 (9.1)
СН2 = СН2 + О2 СН2 – СН2 (9.1)
 О
О
в качестве промотирующей добавки вводят в микроколичествах фосфор, мышьяк или селен. Кроме того, физические изменения катализатора связаны с механическими воздействиями (например, алюмосиликатный катализатор каталитического крекинга истирается при движении по катализаторопроводам, а также за счет трения частиц друг о друга в псевдоожиженном слое).
Химические изменения катализатора связаны с хемосорбцией на его поверхности примесей, содержащихся в исходном сырье и/или некоторыми продуктами реакции. Такие вещества называют каталитическими ядами. Это могут быть соединения серы, азота, других гетероатомов, а также металлоорганика. Кроме того, со временем происходит закоксовывание катализатора, в результате чего его поверхность экранируется коксом, и активность катализатора снижается. Активность закоксованного катализатора может быть восстановлена путем обработки его кислородом воздуха или водяным паром.
9.1.2. Механизм действия окислительно-восстановительного катализатора. Специфика каталитических процессов заключается в том, что обмен электронами между реагирующими веществами протекает с участием электронов катализатора. Типичными катализаторами этого вида являются переходные металлы (Fe, Co, Ni, Ru, Rh, Pt, Re, Ir и др.) и полупроводники (Ge, P, Si, оксиды Ni, W, Mo и др.).
Активность переходных металлов заключается в незавершенности их d-орбиталей. Неспаренные электроны этой орбитали выступают как «свободная валентность» подобно свободному радикалу. Если адсорбирующаяся на поверхности металла молекула имеет свободные орбитали, то возникает донорно-акцепторная связь за счет перехода электрона из металла на вакантные уровни молекулы. Если поверхность металла обладает большим сродством к электрону, то электрон молекулы переходит к металлу. Между этими крайними случаями возможны промежуточные механизмы. Предположительно образующиеся поверхностные хемосорбированные вещества подобны комплексным веществам.
В случае полупроводниковых катализаторов свободные валентности (неспаренные электроны и электронные дырки) возникают из-за неполной координации атомов поверхности кристаллической решетки и различных дефектов самого кристалла. Например, узел кристалла, где отсутствует катион, ведет себя как отрицательный заряд, отталкивая электроны в ближайших к нему узлах, в силу чего эти электроны могут быть вытеснены из валентной зоны в зону проводимости. Появление электронов или дырок в зоне проводимости возможно также по причине наличия в кристалле примесей, обладающих электронно-донорными и электронно-акцепторными свойствами, а также нарушением стехиометрического состава. На поверхности кристалла электроны или дырки играют роль свободной валентности или активных центров.
Молекулы углеводорода, реагируя со свободными электронами (дырками) поверхности катализатора, подвергаются диссоциации. В результате диссоциации одна часть молекулы связывается с катализатором прочной двухэлектронной связью, а другая – слабой одноэлектронной. Эти связи могут взаимно переходить друг в друга. Нестабильность и высокая реакционная способность таких поверхностных соединений определяют высокую скорость их дальнейших превращений.
Каждая молекула может реагировать с данным активным центром по-разному. В одном элементарном каталитическом акте могут принимать участие группы из двух, трех и более центров (дублеты, триплеты, мультиплеты). Таким образом, активность катализатора зависит от числа свободных валентностей на поверхности металла.
9.1.3. Кислотно-основной катализ. Жидкие и твердые кислоты широко используют в нефтепереработке в качестве катализаторов. Их каталитические свойства связаны с образованием катионов, называемых карбкатионами или карбоний-ионами, которые являются промежуточными продуктами взаимодействия углеводородов с кислотами. Карбкатионы образуются при передаче протона от катализатора (кислота НХ) к молекуле ненасыщенного углеводорода:
 НХ + СН3СН = СНR CH3CH2CH+R + X-. (9.2)
НХ + СН3СН = СНR CH3CH2CH+R + X-. (9.2)
При высокой активности кислотного катализатора карбкатионы образуются также из алканов или циклоалканов путем гетеролитического разрыва связей в молекуле под воздействием катализатора (кислота Льюиса):
 CnH2n + 2 + L (CnH2n + 1)+ + LH-. (9.3)
CnH2n + 2 + L (CnH2n + 1)+ + LH-. (9.3)
Карбкатионы обладают очень высокой реакционной способностью. Константы скорости ионных реакций на несколько порядков выше аналогичных радикальных. В табл. 9.1 приведены значения стандартных теплот образования некоторых, наиболее характерных карбкатионов.
Анализ данных табл. 9.1 показывает, что наибольшей реакционной способностью обладает фенильный карбкатион +С6Н5, следовательно, он же имеет наименьшую стабильность. Другой вывод состоит в том, что третичные карбкатионы более стабильны, чем вторичные, а те, в свою очередь, стабильнее первичных карбкатионов.
Таблица 9.1
Стандартные теплоты образования карбкатионов
| Карбкатион | Теплота образования, кДж/моль | Карбкатион | Теплота образования, кДж/моль |
| +СН3 | СН3СН2СН+-СН3 | ||
| +С2Н5 | (СН3)3С+ | ||
| СН3СН2СН2+ | +С6Н5 | ||
| СН3(СН2)2СН2+ | +С6Н5СН2 |
Основные реакции карбкатионов, как и радикалов – мономолекулярный распад по  -правилу и бимолекулярные реакции замещения и присоединения. Отличие карбкатионов от радикалов – это их способность к реакциям изомеризации, что связано со снижением свободной энергии при переходе от первичных к вторичным и третичным карбкатионам.
-правилу и бимолекулярные реакции замещения и присоединения. Отличие карбкатионов от радикалов – это их способность к реакциям изомеризации, что связано со снижением свободной энергии при переходе от первичных к вторичным и третичным карбкатионам.
Наиболее рапространенные кислотные катализаторы – это алюмосиликаты, галогениды Al, B, Sb; Al2O3, сульфиды некоторых переходных металлов, а также ряд протонных кислот, например Н2SO4, H3PO4 и др. Эти кислоты применяют в процессах риформинга, каталитического крекинга, алкилирования, изомеризации и т. д..
Реакции карбкатионов
9.2.1. Изомеризацияможет протекать при переносе как гидрид-иона, так и метил-аниона:

 Реакция изомеризации протекает с небольшим тепловым эффектом (
Реакция изомеризации протекает с небольшим тепловым эффектом ( 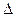 Н реакции (9.4) равен – 79 кДж/моль,
Н реакции (9.4) равен – 79 кДж/моль, 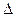 Н реакции (9.5) составляет – 59 кДж/моль).
Н реакции (9.5) составляет – 59 кДж/моль).
9.2.2. Распад по  -связи. Расщепление карбкатионов обычно идет по ослабленной
-связи. Расщепление карбкатионов обычно идет по ослабленной  -связи С – С. Эта реакция эндотермическая:
-связи С – С. Эта реакция эндотермическая:
+ +
 СН2(СН2)6СН3 СН2 = СН2 + СН2(СН2)4СН3 – 92 кДж/моль.(9.6)
СН2(СН2)6СН3 СН2 = СН2 + СН2(СН2)4СН3 – 92 кДж/моль.(9.6)
Вероятность распада по  -связи С – С снижается при переходе от первичного иона ко вторичному и третичному. Для распада вторичного октильного катиона требуется уже 176 кДж/моль энергии, вместо 92 кДж/моль для первичного катиона. В то же время распад первичных катионов возрастает, когда в процессе образуются вторичные и третичные карбкатионы.
-связи С – С снижается при переходе от первичного иона ко вторичному и третичному. Для распада вторичного октильного катиона требуется уже 176 кДж/моль энергии, вместо 92 кДж/моль для первичного катиона. В то же время распад первичных катионов возрастает, когда в процессе образуются вторичные и третичные карбкатионы.
+ +


 СН3СН2СНСН2ССН2СН3 СН2СН=СН2 +С(СН3)2СН2 – 21 кДж/моль (9.7)
СН3СН2СНСН2ССН2СН3 СН2СН=СН2 +С(СН3)2СН2 – 21 кДж/моль (9.7)

 Н3С СН3 СН3 СН3 СН3 СН3
Н3С СН3 СН3 СН3 СН3 СН3
Из сравнения термодинамики распада и изомеризации карбкатионов следует, что в большинстве случаев распаду предшествует изомеризация.
9.2.3.Присоединение карбкатионов к алкенам и аренам. Эти реакции являются обратными распаду карбкатионов:
+ +
 (СН3)3С + СН2 = С(СН3)2 (СН3)3ССН2С(СН3)2 ; (9.8)
(СН3)3С + СН2 = С(СН3)2 (СН3)3ССН2С(СН3)2 ; (9.8)



 Н
Н


 (СН3)3С + + +. (9.9)
(СН3)3С + + +. (9.9)
 (СН3)3С
(СН3)3С
Реакции (9.8) и (9.9) идут с тепловыми эффектами, равными по абсолютной величине с реакциями распада, но противоположными по знаку.
9.2.4. Передача протона молекуле алкена или аниону катализатора осуществляется, например, в реакции:
+ +
 СН2СНСН3+СН3СН=СН2 СН2=ССН3+СН3СНСН2СН3 +73 кДж/моль. (9.10)
СН2СНСН3+СН3СН=СН2 СН2=ССН3+СН3СНСН2СН3 +73 кДж/моль. (9.10)
 |  |
СН3 СН3
Термодинамически наиболее вероятны те реакции, в которых протон отщепляется от первичного карбкатиона, а в результате образуется третичный карбкатион. При передаче протона катализатору цепь обрывается.
9.2.5. Отрыв гидрид-иона от молекулы углеводорода оуществляется, например, в реакции:
+
 СН3СНСН2СН3+СН3СН(СН3)2 СН3(СН2)2СН3+ С(СН3)3+41кДж/моль. (9.11)
СН3СНСН2СН3+СН3СН(СН3)2 СН3(СН2)2СН3+ С(СН3)3+41кДж/моль. (9.11)
– Н+
Таким путем осуществляется передача цепи. Активность карбкатиона при реакции отрыва гидрид-иона от молекулы изменяется так:
R+перв. > R+втор. > R+трет.
Карбкатионные реакции протекают либо в жидкой фазе, либо на поверхности твердого катализатора. Сольватация в растворе и адсорбция на поверхности твердого катализатора изменяют тепловые эффекты реакций. При этом теоретические соотношения тепловых эффектов реакций разных карбкатионов реально могут значительно отличаться от расчетных соотношений.
|
из
5.00
|
Обсуждение в статье: Промышленные термические процессы |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

