 |
Главная |
Макрокинетика процесса
|
из
5.00
|
Процесс каталитического крекинга протекает в несколько стадий:
1) диффузия сырья к поверхности катализатора (внешняя диффузия);
2) проникновение молекул сырья в поры катализатора (внутренняя
диффузия;
3) хемосорбция на активных центрах катализатора;
4) химическая реакция;
5) десорбция продуктов процесса из пор катализатора;
6) десорбция продуктов реакции с поверхности катализатора;
7) удаление продуктов крекинга из зоны реакции.
Скорость процесса определяет самая медленная стадия. Она называется лимитирующей. Если таковой является диффузия, то скорость мало зависит от температуры. В этом случае процесс можно интенсифицировать путем увеличения удельной поверхности катализатора, т. е. измельчая его.
Если скорость процесса ограничивает сама химическая реакция, то скорость в большей степени зависит от температуры. Но повышение температуры возможно до определенного предела, после которого процесс переходит в область диффузии.
Если скорость каталитического процесса ограничивается скоростью диффузии (внешней или внутренней), то говорят, что процесс протекает в диффузионной области (внешней или внутренней). Напротив, если лимитирующей стадией является химическая реакция, то процесс осуществляется в кинетической области.
Кинетику процесса на цеолитсодержащем катализаторе описывает уравнение 1-го порядка:
Кэф. = v0 (1 –X), (9.30)
где Кэф – эффективная константа скорости реакции, моль/с×г;
v0 – скорость подачи сырья;
Х – конверсия (степень превращения) сырья, мольные доли.
Скорость процесса и выход продуктов зависят от химического состава сырья, свойств катализатора, параметров процесса и технологического оформления процесса.
Промышленный каталитический крекинг
Это один из самых многотоннажных процессов в нефтепереработке. Основной целевой продукт – высокооктановый бензин. Сырьем процесса могут служить тяжелые дистилляты и остатки, выкипающие при температурах выше 300 оC. Температура процесса 450–530 оС, давление 0,3–0,7 МПа. Другие продукты – углеводородный газ, пропан-пропиленовая и бутан-бутиленовая фракции, легкий и тяжелый газойли.
Углеводородный газ С1 – С2 (сухой газ) обычно используют внутри НПЗ в качестве технологического топлива. Можно из него выделять этан и направлять в процесс пиролиза с целью получения этилена.
Пропан-пропиленовая фракция – это, прежде всего, сырье, из которого выделяют пропилен, необходимый для алкилирования бензола, полимеризации, получения изопропилового спирта и т. д.
Фракцию С4 перерабатывают с целью получения бензина-алкилата, высокооктановых добавок к моторным топливам (МТБЭ, МТАЭ), бутадиена, изопрена, полиизобутилена, ПАВ, каучуков и др.
Бензиновая фракция содержит 25 – 40 % аренов, 15 – 30 %алкенов, 2 – 10 %циклоалканов и 35 – 60 % алканов, преимущественно изостроения. Октановое число такого бензина достигает 92 – 93 по исследовательскому методу. Он наравне с бензином-риформатом является базовым компонентом товарных бензинов.
Легкий газойль (фракция 195 – 350 оС) используется как компонент авиакеросина или дизтоплива. Цетановое число такого топлива, полученного из парафинового сырья, достигает 45 – 55. Фракцию 195 – 270 оС, получаемую по нефтехимическому варианту, используют как компонент реактивного топлива в качестве флотореагента, а фракцию 270 – 420 оС – как сырье для производства технического углерода.
Тяжелый газойль (фракция выше 350 или 420 оС) применяют в качестве компонента котельного топлива, направляют на установку коксования или рециркулируют в сырье каталитического крекинга.
Контрольные вопросы
1. Дайте определения активности, селективности и стабильности катализатора.
2. Что такое промоторы? Какова их роль в катализе?
3. Какие вещества называют каталитическими ядами? Приведите примеры типичных ядов в нефтепереработке и нефтехимии.
4. Объясните механизм действия окислительно-восстановительных катализаторов. Приведите примеры таких катализаторов.
5. Объясните механизм действия катализаторов кислотного типа. Приведите примеры таких катализаторов.
6. Что такое карбкатионы? Приведите примеры реакций карбкатионов.
7. Дайте определение процессу каталитического крекинга. Назовите его основные параметры и химические реакции.
8. Приведите реакции алканов в каталитическом крекинге.
9. Приведите реакции циклоалканов в каталитическом крекинге.
10. Приведите реакции алкенов в каталитическом крекинге.
11. Приведите реакции аренов в каталитическом крекинге.
12. Назовите катализаторы каталитического крекинга. Приведите общую формулу цеолитов и структурные формулы алюмосиликатов. Объясните, что такое кислоты Бренстеда и Льюиса.
13. Назовите продукты каталитического крекинга и области дальнейшего их применения.
ТЕМА 10.
Каталитический риформинг
Основное назначение каталитического риформинга состоит в получении высокооктановых бензинов, а также моноароматических аренов. Процесс ведут при 480–520 оС под давлением Н2 1,5–4,0 МПа на бифункциональном катализаторе, обладающем кислотной и гидрирующе-дегидрирующей функциями. Первую функцию несет алюмогель Al2O3 , вторую – Pt или Рt с Re или с Rh.
Химизм процесса
В основе химизма риформинга лежат несколько типов реакций:
а) ароматизация исходного сырья путем дегидроциклизации алканов;
б) дегидроизомеризация алкилциклопентанов;
в) дегидрирование алкилциклогексанов;
г) изомеризация н-алканов в изоалканы;
д) гидрокрекинг.
Реализация перечисленных реакций приводит к повышению октанового числа бензина. Благодаря особенностям катализатора и других факторов, скорость процесса риформинга значительно выше, чем в каталитическом крекинге.
10.1.2.Реакции алканов. Они подвергаются изомеризации, дегидроциклизации и гидрокрекингу. Изомеризация протекает по известному карб-катионному механизму. Скорость изомеризации возрастает с увеличением молекулярной массы углеводорода.
Дегидроциклизация – это одна из важнейших реакций риформинга, которая протекает по схеме:
 |



 СnH2n + 2 4H2 + R . (10.1)
СnH2n + 2 4H2 + R . (10.1)
Эта реакция сильно эндотермическая (Q = – 250 кДж/моль), и поэтому константа равновесия растет с увеличением температуры. Так как процесс идет с увеличением объема, то повышение давления, наоборот, сдвигает равновесие влево. На практике же во избежание закоксовывания катализатора процесс ведут при повышенном давлении водорода. При этом, например, при температуре 500 оС конверсия н-гептана в толуол равна 95 %.
Возможные пути реализации механизма ароматизации алканов следующие.
1. Дегидрирование на Pt до триена с последующей циклизацией его на Pt или Al2O3:
 |


 С – С – С – С – С – С С = С – С = С – С = С . (10.2)
С – С – С – С – С – С С = С – С = С – С = С . (10.2)
– 3Н2 – Н2
2. С5-циклизация на Pt через циклический переходный комплекс:

 СН2
СН2


 Н2С СН – СН3
Н2С СН – СН3

 Н + Н2С СН2 + Н + H2 . (10.3)
Н + Н2С СН2 + Н + H2 . (10.3)



 – 4Pt
– 4Pt
Pt Pt Pt Pt
3. Дегидрирование алканов в алкены на Pt с последующей циклизацией алкенов на Al2O3:

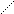
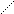
 СН2 СН2
СН2 СН2
НС СН2 Н2С СН2 + Н+ . (10.4)







 Н+
Н+

 СН3 – НС СН2 СН3 – НС СН2
СН3 – НС СН2 СН3 – НС СН2

 /////////// //////////////
/////////// //////////////
А-А-
Получаемые пятичленные циклы далее на кислотных центрах изомеризуются в шестичленные, а затем дегидрируются на Pt в арены. Данные исследований показывают, что ароматизация идет по всем перечисленным направлениям.
Если исходный алкан имеет меньше шести атомов углерода в основной цепи, то он сначала изомеризуется с удлинением главной цепи. Если алкан содержит 10 и более атомов углерода, то образуются арены с конденсированными кольцами. Арены с достаточно длинными заместителями могут замыкать дополнительные циклы:

При дегидроциклизации алканов образуются бензол и нафталин, а также их гомологи с максимальным содержанием именно метильных заместителей в ядре, которое допускает строение исходного алкана.
Гидрокрекинг алканов приводит к образованию низкомолекулярных соединений:

 СН(СН3)3 + СН3СН3;
СН(СН3)3 + СН3СН3;
Н2


 СН3 (СН2)4СН3 (10.6)
СН3 (СН2)4СН3 (10.6)
 2СН3СН2СН3.
2СН3СН2СН3.
Реакция протекает по стадиям:
Ме К К К



 Алкан Алкен Вторичный Третичный Изоалкан и
Алкан Алкен Вторичный Третичный Изоалкан и
дегидри- прото- карбкатион изоме- карбкатион  -рас- карбкатион
-рас- карбкатион
рование ниро- ризация пад меньшей
 рование массы
рование массы
Ме К

 Изоалкен и алкен Изоалкен и алкен
Изоалкен и алкен Изоалкен и алкен
меньшей массы гидрирование меньшей массы – Н+
где К – металлический активный центр;
Ме – кислотный активный центр.
10.1.3. Реакции циклоалканов. Циклоалканы также подвергаются изомеризации, ароматизации и гидрокрекингу:



 СН3. (10.7)
СН3. (10.7)

Равновесие почти нацело сдвинуто вправо, но частично шестичленные циклы превращаются в арены, причем равновесие смещено к аренам:








 СН3. (10.8) –3Н2 .
СН3. (10.8) –3Н2 .
Избирательность превращения циклогексана в бензол или метилциклопентан определяется соотношением скоростей реакций и активности компонентов бифункционального катализатора.
Скорость дегидрирования гомологов циклогексана в алкилбензолы выше чем циклогексана. Гемциклогексан дегидрируется по следующей схеме:








 СН3 СН3 СН3 СН3 СН3 Н2 +СН4. (10.9)
СН3 СН3 СН3 СН3 СН3 Н2 +СН4. (10.9)



 2 – 3Н2 Н3С
2 – 3Н2 Н3С
Бициклогексаны дегидрируются также легко, как и моноциклические, образуя нафталин и его производные.
Гидрокрекинг цикланов происходит в незначительной степени по схеме, аналогичной для алканов.
Поскольку дегидрирование циклоалканов в арены существенно выше скоростей других реакций, то селективность превращения циклоалканов в арены приближается к 100 %.
Гомологи циклопентана при риформинге ведут себя таким образом:
1) изомеризация по заместителю

2) изомеризация с последующей дегидроароматизацией
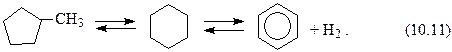
Выход бензола по последней реакции возрастает с повышением температуры и понижением давления (например, при температуре 500 оС со снижением давления с 3,6МПа до 1,5МПа он возрастает с 45 до 90 %);
3) раскрытие кольца (гидроформинг)


 СН3(СН2)4СН3; (10.12) + Н2
СН3(СН2)4СН3; (10.12) + Н2



 СН3 СН3 – СН(СН3) – (СН2)2 – СН3; (10.13)
СН3 СН3 – СН(СН3) – (СН2)2 – СН3; (10.13)
 СН3 – СН2 – СН(СН3) – СН2 – СН3 . (10.14)
СН3 – СН2 – СН(СН3) – СН2 – СН3 . (10.14)
На свежем алюмоплатиновом катализаторе гидрогенолиз идет на платине при соотношении продуктов реакций (10.12), (10.13) и (10.14) как 2,4 : 2,1 : 1 соответственно. В процессе эксплуатации активность платины постепенно падает вследствие дезактивации, и гидрогенолиз далее идет уже на кислотных центрах по карбкатионному механизму:


















 СН3 + СН3 СН3 + Н+А- СН3 + А- СН3 + Н+А- +Н2 М (10.15) С6Н14 .
СН3 + СН3 СН3 + Н+А- СН3 + А- СН3 + Н+А- +Н2 М (10.15) С6Н14 .
В результате гидрогенолиза метилциклопентана основным продуктом этого процесса является н-гексан.
10.1.4. Реакции аренов. Незамещенные арены устойчивы. Метилзамещенные арены подвергаются диспропорционированию или изомеризации по положению заместителя (реакции (9.26) и (9.27)).
Алкиларены с тремя и более атомами углерода в заместителях деалкилируются на кислотных центрах, аналогично процессу каталитического крекинга с последующим гидрированием полученного алкена на металлической составляющей бифункционального катализатора. Но в отличие от каткрекинга в процессе риформинга могут деалкилироваться и метилзамещенные арены с образованием бензола и метана.
Катализаторы процесса
10.2.1. Состав катализатора. Наиболее распространенным является алюмоплатиновый катализатор, который представляет собой композицию, в которой металлическая платина в тонкодисперсном виде наносится на поверхность пористого оксида алюминия. Как известно, платина активна в реакции гидрирования-дегидрирования. Доля платины в такой композиции составляет от 0,3 до 0,6 % масс. Увеличение концентрации платины более 0,6 %в катализаторе повышает его активность и октановое число бензина, но снижает его отбор. Снижение доли платины менее 0,3 % приводит к резкому снижению активности катализатора и качества бензина. В последнее десятилетие в данную каталитическую композицию все чаще вводят рений Re в количестве 0,3–0,4 % масс. Рений образует с платиной сплав, препятствующий ее дезактивации и закоксовыванию. Кроме того, введение в катализатор добавки рения позволяет снизить давление процесса с 3,5–4 до 1,5–2,0 МПа и увеличить выход бензина с октановым числом 95 (по исследовательскому методу) примерно на 6 %.
Введение в катализатор промотирующих добавок Ir, Be, Sn, Pb, а также La, Ce, Nd позволяет повысить избирательность катализатора, подавить ряд побочных реакций, например, деметанирование аренов, расщепление цикланов. Кроме того, эти добавки способствуют повышению срока службы катализатора с 5 до 6 – 7 лет.
Для повышения кислотной функции катализатора, особенно на начальной стадии его эксплуатации, в катализатор вводят 0,5–2 % хлора. При этом доля воды в сырье не должна превышать 1 ррт. Для компенсации потерь летучего хлора в сырье вводят небольшие добавки хлорорганических соединений, таких как СН2 Сl –CH2Cl, CCl4, CH3 – CH2Cl и др.
10.2.2. Факторы, влияющие на активность катализатора. Присутствие в каталитической системе таких гетероатомов, как N, S, O, Pb, As, Cu и других в сырье приводит к отравлению катализатора путем сорбции их на поверхности катализатора. Поэтому в требованиях к качеству сырья предусмотрено ограничение этих элементов следующими величинами, ррт: S – 1,0; N – 0,5; Pb, As, Cu – не более 3·10-3. Для достижения указанных требований сырье перед риформингом подвергается гидроочистке.
Закоксовывание катализатора может происходить в результате протекания реакций полимеризации и поликонденсации, а также диссоциации связей С – С, приводящих к образованию смол, кокса и углерода, отлагающихся на активных центрах катализатора.
|
из
5.00
|
Обсуждение в статье: Макрокинетика процесса |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

