 |
Главная |
Химические реакции, которые при одних и тех же условиях могут идти в противоположных направлениях, называются обратимыми
|
из
5.00
|
Например:
H2 + Cl2 = 2HCl (t = 200 °C) Реакция необратимая, идет до конца.
Н2 + I2 ↔ 2HI (t = 200 °C) Реакция обратимая, до конца не идет.
В уравнении обратимой реакции всегда ставятся двойные стрелки (↔).
Изменение концентраций реагентов (исходных веществ) и продуктов обратимой реакции во времени может быть представлено следующим графиком:

Как видим из графика, концентрации исходных веществ уменьшаются, а концентрации продуктов реакции увеличиваются.
Выражения скоростей прямой и обратной реакций согласно закону действующих масс имеют вид:

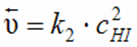
Скорость прямой реакции со временем будет уменьшаться, а скорость обратной реакции - увеличиваться. Наступит такой момент, когда скорости прямой и обратной реакций выровняются:
 =
= 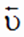
Состояние реакции, в котором скорость обратной реакции становится равной скорости прямой реакции, называется химическим равновесием. Состояние равновесия имеет динамический характер.
Признаки химического равновесия:
1. Наличие всех реагентов в системе;
2. Постоянство их концентраций во времени;
3. Возможность подойти к состоянию равновесия как со стороны прямой реакции, так и со стороны обратной реакции.
Начиная с момента равновесия концентрации всех веществ (реагентов и продуктов реакции) будут оставаться неизменными. Концентрации веществ, соответствующие состоянию равновесия, называются равновесными и обозначаются в виде квадратных скобок: [ ]
Для рассматриваемой выше реакции, находящейся в состоянии равновесия, приравниваем скорости примой и обратной реакций:

Преобразуя полученное выражение, получим уравнение, представляющее собой математическое выражение закона действующих масс при химическом равновесии.

Для условной обратимой реакции аА + bВ  сС + dD закон действующих масс записывается следующим образом:
сС + dD закон действующих масс записывается следующим образом:

Kравн - константа равновесия, представляет собой отношение констант скоростей прямой и обратной реакций, не зависит от концентраций веществ, но зависит от температуры и природы реагирующих веществ. При данной температуре константа равновесия является постоянной величиной.
Итак, константа равновесия равна отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ, взятых в степенях, равных их стехиометрическим коэффициентам в уравнении реакции.
Примеры:
1. 2SO2(г) + O2(г) ↔ 2SO3(г)

2. СО2(г) + Н2О(ж) ↔ Н2СО3(ж) (реакция гетерогенная)

3. Ti(тв) + 2I2(г) ↔ TiI4(г) (реакция гетерогенная)

В гетерогенных реакциях в выражения константы равновесия входят концентрации только газовых компонентов.
Для реакций с участием газов константа равновесия может выражаться через парциальные давления (обозначается символом Кр).
Пример. H2(г) + I2(г) ↔ 2НI(г)

Значение константы равновесия определяет выход реакции.
Выходом реакции называют отношение количества получаемого в действительности продукта к тому количеству, которое получилось бы при протекании реакции до конца (или по расчёту). Выход реакции обычно выражается в процентах. Так, при Kравн>> 1 выход реакции велик, поскольку в этом случае
[C]c [D]d >> [A]a [B]b
При Kравн << 1 выход реакции мал.
Примеры задач на равновесие.
Пример 1. Исходные концентрации водорода и иода в реакции H2(г) + I2(г) ↔ 2HI(г) равны 1,5 моль/л и 0,9 моль/л соответственно. Вычислите константу равновесия, если известно, что к моменту равновесия прореагировало 40 % Н2.
Решение. При решении задач на равновесие удобно использовать табличную форму записи. Записываем уравнение реакции и под ним составляем таблицу, состоящую из трех строк.
H2(г) + I2(г) ↔ 2HI(г)
| исходные концентрации, моль/л | 1,5 | 0,9 | |
| изменение концентраций, моль/л | 0,6 | 0,6 | 1,2 |
| равновесные концентрации, моль/л | 0,9 | 0,3 | 1,2 |
В первой строке таблицы будем записывать исходные концентрации реагентов (или исходных веществ).
Во второй строке - изменение концентраций исходных веществ и продуктов реакции к моменту достижения состояния равновесия.
В третьей строке - равновесные концентрации всех веществ.
Заполнение таблицы происходит постепенно.
По условию задачи даны исходные концентрации водорода и иода, поэтому, заполняя таблицу, в первой строке второй графы под формулами веществ H2 и I2 ставим значения их исходных концентраций. А под формулой вещества HI ставим цифру “0”, т.к. в начальный момент времени иодоводорода не было.
По условию задачи к моменту равновесия прореагировало 40 % водорода. Изменение концентрации H2 составило:
1,5 · 0,4 = 0,6 моль/л
Проставим это значение в таблице во второй строке под водородом.
Руководствуясь уравнением реакции, вычислим изменение концентрации иодоводорода к моменту достижения состояния равновесия:
1 моль Н2 прореагировал с 1 моль I2
0,6 моль Н2 прореагирует с х моль I2 ,
отсюда х = 0,6 моль I2
на 1 моль Н2 получено 2 моля НI
на 0,6 моль Н2 получено х моль НI ,
отсюда х = 1,2 моль HI
Запишем полученные значения (0,6 и 1,2) в таблице во второй строке под формулами веществ I2 и HI.
Далее подсчитаем равновесные концентрации водорода, иода и иодаводорода и проставим их значения в таблице в третьей строке.
[H2] = 1,5 - 0,6 = 0,9 моль/л
[I2] = 0,9 - 0,6 = 0,3 моль/л
[HI] = 0 + 1,2 = 1,2 моль/л
Поставив значения равновесных концентраций в выражение константы равновесия, получим:

Ответ: константа равновесия равна 5,33.
Пример 2. Равновесие реакции N2 + 3H2 ↔ 2NH3 устанавливается при следующих концентрациях участвующих в них веществ: [N2] = 0,01 моль/л,
[H2] = 2,0 моль/л, [NH3] = 0,4 моль/л. Вычислите константу равновесия и исходные концентрации азота и водорода.
Решение. Записываем уравнение реакции и под ним составляем таблицу.
N2 + 3H2 ↔ 2NH3
| исходные концентрации, моль/л | 0,21 | 2,6 | |
| изменение концентраций, моль/л | 0,2 | 0,6 | 0,4 |
| равновесные концентрации, моль/л | 0,01 | 2,0 | 0,4 |
По условию задачи даны равновесные концентрации азота, водорода и аммиака.
Вносим значения этих концентраций в третью строку таблицы под соответствующими веществами. Запишем в таблице в первой строке исходную концентрацию аммиака, равную “нулю”.
Исходя из того, что аммиака вначале реакции не было, а равновесная концентрация его равна 0,4 моль/л, то делаем вывод, что аммиака получено в ходе реакции 0,4 моль/л. Записываем это значение в таблице во второй строке под формулой NH3.
Зная это значение и исходя из уравнения реакции, подсчитаем изменение концентрации азота и водорода. Для этого составим пропорции:
на 1 моль N2 приходится 2 моля NH3
на х моль N2 придется 0,4 моля NH3 ,
отсюда х = 0,2 моль/л N2
на 3 моля Н2 приходится 2 моля NH3
на х моль Н2 придется 0,4 моля NH3 ,
отсюда х = 0,6 моль/л Н2
Вносим полученные данные в таблицу во вторую строку под формулами N2и H2.
Далее подсчитываем исходные концентрации азота и водорода:
Исходная концентрация N2: 0,01 + 0,2 = 0,21 моль/л
Исходная концентрация H2: 2,0 + 0,6 = 2,6 моль/л
Подсчитаем константу равновесия.
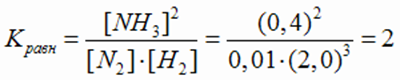
Ответ: Kравн = 2; 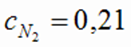 моль/л;
моль/л; 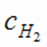 = 2,6 моль/л
= 2,6 моль/л
Пример 3. Рассчитайте равновесные концентрации веществ, участвующих в реакции СО + Н2О ↔ СО2 + Н2, если исходные концентрации веществ равны:
 = 0,1 моль/л,
= 0,1 моль/л,  = 0,4 моль/л, а константа равновесия при данной температуре равна 1.
= 0,4 моль/л, а константа равновесия при данной температуре равна 1.
Решение. Записываем уравнение реакции и под ним составляем таблицу.
СО + H2О ↔ СО2 + Н2
| исходные концентрации, моль/л | 0,1 | 0,4 | ||
| изменение концентраций, моль/л | а | а | а | а |
| равновесные концентрации, моль/л | (0,1-а) | (0,4-а) | а | а |
По условию задачи даны исходные концентрации веществ СО и Н2О. Вносим значения этих концентраций в таблицу в первую строку под веществами СО и Н2О, а под продуктами реакции СО2 и Н2 проставляем “нули”.
Далее, поскольку других данных в условии задачи нет (кроме константы равновесия), то задаемся некоторой величиной (обозначим её “а”), считая, что а - это количество вещества СО, израсходованного к моменту равновесия (в моль/л). Проставим величину “а” в таблице во второй строке под веществом СО.
Далее можно найти, сколько прореагировало вещества Н2О к моменту равновесия, и сколько получено веществ СО2 и Н2 к моменту равновесия. Найти эти величины можно, исходя из коэффициентов в уравнении реакции. Коэффициенты в уравнении реакции перед всеми веществами равны “единицы”. Это значит, согласно закону стехиометрии, на 1 моль СО будет израсходован 1 моль Н2О и будет получено по 1 молю СО2 и Н2. А на “а” моль СО будет израсходовано “а” моль Н2О и получено по “а” моль СО2 и Н2. Проставляем значение ‘а” в таблице во второй строке под веществами Н2О, СО2 и Н2.
Равновесные концентрации для исходных веществ будут уменьшены на величину “а”, а для продуктов реакции будут равны величине “а”. Проставляем в таблице выражения равновесных концентраций в третьей строке.
Записываем выражение константы равновесия для данной реакции:

Подставляем выражения равновесных концентраций в данную формулу. По условию задачи Кравн равна 1. Получаем уравнение с одним неизвестным.

Решая уравнение, находим величину “а”. а = 0,08
Таким образом, равновесные концентрации веществ будут равны:
[CO] = 0,1 - 0,08 = 0,02 моль/л;
[H2O] = 0,4 - 0,08 = 0,32 моль/л;
[CO2] = 0,08 моль/л;
[H2] = 0,08 моль/л.
Ответ: 0,02; 0,32; 0,08; 0,08 (моль/л)
|
из
5.00
|
Обсуждение в статье: Химические реакции, которые при одних и тех же условиях могут идти в противоположных направлениях, называются обратимыми |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

