 |
Главная |
Рекомендуемые примеры тестов к промежуточной аттестации по теме «Кислотно-основное титрование» раздела «Титриметрический анализ»
|
из
5.00
|
1. Титрантом в алкалиметрическом титровании является
а) HCl б) H2SO4 в) NaOH г) NH3 × H2O
2. Стандартным веществом в алкалиметрическом титровании является
а) НCl б) H2SO4 в) Na2B4O7 ·10H2O г) H2C2O4·2H2O
3. Индикатором в ацидиметрическом титровании слабого основания является является
а) метилоранж б) дифениламин в) мурексид г) фенолфталеин
4. Алкалиметрическим титрованием можно определить
а) CH3COOH б) Na2CO3 в) NaOH г) NH3 × H2O
5. Фактор эквивалентности серной кислоты при определении ее алкалиметрическим титрованием равен
а) 1 б) 1/2 в) 2
6. Зарисуйте вид кривой титрования соляной кислоты натрия гидроксидом с указанием всех структурных элементов. Укажите название и знак индикаторной ошибки при использовании индикатора метилового оранжевого с рТ = 4
а) водородная (-)
б) водородная (+)
в) гидроксидная (-)
г) гидроксидная (+)
7. При титровании щелочного раствора в присутствии двух индикаторов затрачено 8 мл кислоты под контролем индикатора ФФ, а МО – 20 мл. В смеси содержатся ионы
а) ОН- б) СО32- в) НСО3- г) СО32- и ОН- д) НСО3- и СО32-
8. Щавелевую кислоту массой 1,0000 г растворили в мерной колбе вместимостью 200,0 мл. Титр полученного раствора равен
а) 0,1000 б) 0,01000 в) 0,05000 г) 0,005000
Приведите расчеты.
9. На кривой титрования СО32- - иона имеется
а) 1 линия эквивалентности (л.э.) и 1 точка эквивалентности (т.э.)
б) 1 л.э. и 2 т.э.
в) 2 л. э. и 1 т.э.
г) 2 л. э. и 2 т. э.
10. Вид кривой титрования сильной кислоты сильным основанием




а) б) в) г)
3. Рекомендуемые вопросы к экзамену для оценки освоения аналитической химии
(из образца экзаменационного билета)
1. Приведите уравнение реакции обнаружения (катиона или аниона) в ионной форме, укажите аналитический эффект (сигнал):_________________ и среду, в которой проводится данная реакция _________________.
2. Показатель чувствительности (рД) реакции обнаружения сульфат-иона равен 5. Рассчитайте предел обнаружения (Сmin) этой реакции.
3. Приведите выражение и рассчитайте константу равновесия реакции обнаружения сульфат-иона ________. Известно, что ПР(BaSO4) = 10–10.
4. Сульфат- и ацетат-ионы можно разделить с помощью солей  . Приведите схему разделения.
5. Рассчитайте рН раствора, содержащего 10–2 моль/л H2SO4 и 10–3 моль/л CH3COOH ________________.
6. Какой ион содержится в растворе, если при прибавлении к нему магнезиальной смеси образуется белый кристаллический осадок в виде снежинок или ножниц? _____________ (Cl-; SO42-; PO43-).
7. На основании схемы титриметрического анализа вещества (А)
назовите: 1) метод определения; 2) прием титрования; 3)индикатор;
запишите: 4) уравнение реакции между А и вспомогательными веществами;
укажите: 5) число электронов, которым соответствуют вещества в горизонтальной и вертикальной строчках одновременно; 6) значение fэкв(А). . Приведите схему разделения.
5. Рассчитайте рН раствора, содержащего 10–2 моль/л H2SO4 и 10–3 моль/л CH3COOH ________________.
6. Какой ион содержится в растворе, если при прибавлении к нему магнезиальной смеси образуется белый кристаллический осадок в виде снежинок или ножниц? _____________ (Cl-; SO42-; PO43-).
7. На основании схемы титриметрического анализа вещества (А)
назовите: 1) метод определения; 2) прием титрования; 3)индикатор;
запишите: 4) уравнение реакции между А и вспомогательными веществами;
укажите: 5) число электронов, которым соответствуют вещества в горизонтальной и вертикальной строчках одновременно; 6) значение fэкв(А).
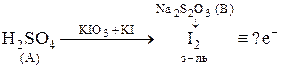 Перечислите условия получения заместителя I2 в вышеуказанной схеме титрования
8. Зарисуйте вид кривой титрования I2 раствором натрия тиосульфата, указав все обозначения и структурные элементы, если Ео(I2/2I-)=+0,54 B, а Eo(S4O62-/2S2O32-)=+0,1B.
9. Приведите формулу расчета массовой доли (%) фосфора, если известны навеска вещества, содержащего его, и масса гравиметрической формы Mg2P2O7.
10. Рассчитайте молярную концентрацию эквивалента (N) и содержание H2SO4 в граммах, если анализируемый раствор кислоты поместили в мерную колбу вместимостью 100 мл, довели до метки водой и перемешали, а 10,00 мл полученного раствора оттитровали 10,45 мл 0,1 н. раствора NaOH.
11. Рассчитайте массовую концентрацию FeSO4∙7Н2О в растворе (в г/мл), если при амперометрическом титровании 50,00 мл этого раствора 0,1 н. раствором калия дихромата были получены следующие данные:
V(K2Cr2O7), мл 0 2 4 6 7 8
I (мкА) 93 60 25 12 12 12
М(FeSO4∙7Н2О) = 278 г/моль.
12. В какой последовательности (сверху вниз) распределяются осадки в хроматографической колонке при анализе смеси, содержащей катионы Ag+, Pb2+ и Cu+ методом осадочной хроматографии, если осадителем является KI. ПР(AgI) = 10–16; ПР(PbI2) = 10–9; ПР(CuI) = 10–12. Ответ обоснуйте и приведите расчет.
13. Рассчитайте светопоглощение (А) раствора, если светопропускание (Т) его составляет 62,3%.
14. Приведите законы, лежащие в основе экстракционных процессов. Что такое коэффициент распределения (Д)?
Перечислите условия получения заместителя I2 в вышеуказанной схеме титрования
8. Зарисуйте вид кривой титрования I2 раствором натрия тиосульфата, указав все обозначения и структурные элементы, если Ео(I2/2I-)=+0,54 B, а Eo(S4O62-/2S2O32-)=+0,1B.
9. Приведите формулу расчета массовой доли (%) фосфора, если известны навеска вещества, содержащего его, и масса гравиметрической формы Mg2P2O7.
10. Рассчитайте молярную концентрацию эквивалента (N) и содержание H2SO4 в граммах, если анализируемый раствор кислоты поместили в мерную колбу вместимостью 100 мл, довели до метки водой и перемешали, а 10,00 мл полученного раствора оттитровали 10,45 мл 0,1 н. раствора NaOH.
11. Рассчитайте массовую концентрацию FeSO4∙7Н2О в растворе (в г/мл), если при амперометрическом титровании 50,00 мл этого раствора 0,1 н. раствором калия дихромата были получены следующие данные:
V(K2Cr2O7), мл 0 2 4 6 7 8
I (мкА) 93 60 25 12 12 12
М(FeSO4∙7Н2О) = 278 г/моль.
12. В какой последовательности (сверху вниз) распределяются осадки в хроматографической колонке при анализе смеси, содержащей катионы Ag+, Pb2+ и Cu+ методом осадочной хроматографии, если осадителем является KI. ПР(AgI) = 10–16; ПР(PbI2) = 10–9; ПР(CuI) = 10–12. Ответ обоснуйте и приведите расчет.
13. Рассчитайте светопоглощение (А) раствора, если светопропускание (Т) его составляет 62,3%.
14. Приведите законы, лежащие в основе экстракционных процессов. Что такое коэффициент распределения (Д)?
|
|
из
5.00
|
Обсуждение в статье: Рекомендуемые примеры тестов к промежуточной аттестации по теме «Кислотно-основное титрование» раздела «Титриметрический анализ» |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

