 |
Главная |
Дитизон (дифенилтиокарбазон)
|
из
5.00
|
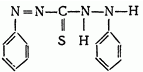
Фиолетово-черный кристаллических порошок, Tпл 165-169°С (разлагается); Умеренно растворим в воде и в разбавленных минеральных кислотах, растворяется в разбавленных растворах аммиака с образованием желтой окраски (енолизация); Умеренно растворяется в углеводородах – хлороформе и четыреххлористом углероде.
Дитизон ведет себя в водных растворах как одноосновная кислота. Константа кислотной диссоциации равна 3,2·10-5 .
Участвует в реакциях в двух формах: структура I соответствует енолу, а структура II– кетоформе:


I II
Отсюда следует, что тяжелые металлы образуют два типа комплексов. Согласно исследованиям Ирвинга, дитизон, имеющий метильную группу у атома серы, не реагирует с ионами тяжелых металлов. Это указывает на то, что в кетоформе дитизона атом серы обладает донорной функцией (первичные дитизонаты). Исследование дифракции рентгеновских лучей тоже показало, что структура первичных дитизонатов соответствует формуле:

Структура комплексов, образованных енольным таутомером дитизона, еще точно не выяснена. На основе стехиометрии комплексов предполагали, что дитизон ведет себя в этих соединениях как двухосновная кислота. Но это предположение никогда не было окончательно подтверждено. В ходе изучения первичной и вторичной форм комплекса дитизоната меди Фрейзер показал, что так называемая «енольная форма», или вторичный дитизонат, обладает диамагнитными свойствами и содержит в качестве центрального атома медь(I); поэтому комплекс – моноосновная кислота. Исследования Бриское привели к аналогичным выводам. Эти ученые установили присутствие смешанного комплекса, содержащего хлорид-ион и лиганд дитизона в водном растворе вторичного дитизона ртути.
Согласно этому, для выяснения действительных структур комплексов, образуемых енольной формой дитизона, требуются дальнейшие исследования.
Первичные комплексы дитизона имеют гораздо большее аналитическое значение. Они намного прочнее вторичных комплексов и более растворимы в органических растворителях. С точки зрения аналитического применения гораздо важнее то, что первичные комплексы образуются в кислых растворах, содержащих в избытке лиганд, а вторичные комплексы – при избытке иона металла. Высокие значения pH благоприятствуют образованию вторичных комплексов.
Дитизон дает применимые в аналитической практике хелатные комплексы с ионами следующих металлов: марганца (II), железа (II), кобальта (II), никеля (II), меди (I), меди (II), серебра (I), золота (III), палладия (II), платины (II), цинка (II), кадмия (II), ртути (I), ртути (II), галлия (III), индия (III), таллия (I), олова (II), свинца (II), висмута (III), теллура (IV) и плутония (IV). (уравнение 1).[7,8]
 (1)
(1)
Разница в прочности хелатных комплексов различных ионов и различная способность к экстракции, определяемая прочностью, позволяют разделять ионы некоторых металлов. Например, серебро, ртуть, медь, палладий и золото можно отделить от других металлов в растворе разбавленной минеральной кислоты (0,1-0,1 молярной) при помощи дитизона.
Избирательность экстракции можно еще увеличить, применяя маскирующие реагенты. Она также увеличивается из-за того, что комплексы некоторых металлов инертны. Например, кобальт (II) и никель (II) реагируют с дитизоном только в щелочной среде, но образовавшиеся хелаты устойчивы к действию кислот. Поэтому все дитизонаты таких металлов, которые разлагаются кислотой, можно экстрагировать раствором минеральной кислоты из дитизонатов кобальта и никеля. С другой стороны, дитизонатные комплексы, которые образуются в кислых растворах, можно отделить до получения комплексов кобальта и никеля.
Дитизон действует как восстановительно по отношению к окисляющим катионам. Установлено, что комплекс дитизона с железом, оловом и палладием содержит металлы в состоянии низкой степени окисления, даже если на дитизон подействовать солями железа (III), олова (IV) и палладия (IV).[2-4]
Дитиокарбаматы
1. Диэтилдитиокарбамат натрия:

Белые кристаллы; образует 35%-ные растворы в воде, менее растворим в органических растворителях. Однако свободная диэтилдитиокарбаминовая кислота легко растворима в органических растворителях, но меньше растворима в воде. Значит, при подкислении водного раствора диэтилдитиокарбамата можно экстрагировать свободную кислоту хлороформом или четыреххллористым углеродом.
Значение –lgKн кислоты равно 3,4 в водной среде. Из этого следует, что реагент можно экстрагировать количественно из кислой среды (pH<4) органическими растворителями, тогда как при pH>8 он остается количественно в водной фазе.
Диэтилдитиокарбамат натрия реагирует с еще большим числом металлов, чем дитизон. Однако его аналитическое применение в значительной степени ограничивается очень низкой устойчивостью в кислых водных средах. Согласно исследованиям Бодэ, реагент сильно разлагается за 5 мин при pH 5. Поэтому аналитическое применение этого реагента ограничивается очень узкой областью значений pH. Аналитическую избирательность экстракций этим реагентом нельзя увеличить, используя разницу между прочностями комплексов с ионами различных металлов и подбором значения pH реакционной смеси. Несмотря на это, некоторые авторы предлагают проводить экстракцию из кислых сред, например, в случае таких прочных комплексов, как комплексы меди (II), никеля (II) и висмута(III). Однако экстракцию надо проводить немедленно после подкисления, но даже и тогда необходимо учитывать ошибку, возникающую при разложении реагента. Аналитическую избирательность реакций комплексообразования с диэтилдитиокарбаматом можно увеличить путем использования различных вспомогательных комплексообразователей и маскирующих реагентов. Для этой цели можно применять ЭДТА, цианиды и др.(уравнение 2)

 (2)
(2)
Реагент не поглощает в видимой области (>400 нм). С другой стороны, комплексы его с металлами обычно окрашены, что позволяет применять реагент для спектрофотометрических измерений.
Диэтлдитиокарбамат пригоден также для обогащения и выделения следов металлов. Например, металлы морской воды или промывных вод, получаемых при очистке загрязненного воздуха, можно экстрагировать раствором диэтилдитиокарбамата в этилпропионате. Раствор в этилпропионате непосредственно спектрофотометрируют. Чувствительность измерения в таком растворе намного выше, чем в воде.
2. Диэтилдитиокарбамат диэтиламмония:

Слабо растворяется в воде, легко растворяется в хлороформе и четыреххлористом углероде. Разлагается в водном растворе, но в органических растворителях устойчив.
В смесях вода-хлороформ реагент количественно удерживается в водной фазе при pH>8, а при pH<4 переходит количественно в органическую фазу.
Реагент взаимодействует с ионами тех же металлов, что и диэтилдитиокарбамат натрия. Однако он обладает тем преимуществом, что некоторые ионы металлов экстрагируются им из значительно более кислых растворов, что в некоторых случаях увеличивает аналитическую избирательность.(уравнение 3).[2,4-8]
 (3)
(3)
|
из
5.00
|
Обсуждение в статье: Дитизон (дифенилтиокарбазон) |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

