 |
Главная |
Меркурометрическое титрование
|
из
5.00
|
Меркурометрический метод осадительного титрования (меркурометрия) основан на титровании растворов хлоридов и йодидов раствором нитрата ртути (I):

В качестве титранта в методе применяют 0,1 н раствор Hg2(NO3)2 · 2H2O, который готовят из нитрата ртути (I), растворяя его в 0,2 н HNO3. В нитрате ртути (I) может находиться примесь ртути (II). Для удаления Hg2+ добавляют немного металлической ртути и, взболтав, оставляют на сутки. При этом идет реакция
Hg2+ + Hg = Hg2+2
Титр приготовленного раствора Hg2(NO3)2 устанавливают по стандартному раствору хлорида натрия.
>В качестве индикаторов в меркурометрии применяют раствор роданида железа или раствор дифенилкарбазона. Роданид железа (III) получают непосредственно в титруемом растворе галогенида, добавляя к нему 1 мл 0,05 н NH4SCN и 2 мл концентрированного раствора Fe(NO3)3. Появляется красное окрашивание вследствие образования комплексного иона [Fe(SCN)]2 +. Красная окраска раствора не исчезает во время титрования, пока в нем находится избыток галогенидов. При полном их связывании в точке эквивалентности в растворе появляется избыток титранта Hg2(NO3)3. Раствор обесцвечивается вследствие осаждения SCN - -ионов ионами Hg2+2 в виде менее растворимого соединения:
Hg2+2 + 2 [Fe(SCN)]2+ 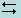

Кривая титрования слабой кислоты сильным основанием/strong>
При расчете кривой титрования слабой кислоты щелочью следует учитывать тот факт, что до точки эквивалентности в растворе присут-ствует буферная смесь, состоящая из неоттитрованной слабой кислоты и ее соли, образованной за счет взаимодействия слабой кислоты со щелочью. В точке эквивалентности в растворе присутствует соль, образованная слабой кислотой и сильным основанием, она подвергается гидролизу и среда становится щелочной, в отличие от точки эквивалентности в случае титрования сильной кислоты щелочью.
За точкой эквивалентности в растворе, как и в случае титрования сильной кислоты, будет находиться в избытке щелочь, и ее содержание в растворе будет определять рН.
Пример.
Построить кривую титрования 10,0 мл 0,1 М CH3COOH раствором 0,1 М NaOH. Расчетные данные приведены в табл.13.1.1.
Решение.
В первоначальный момент (без добавления NaOH) в растворе присутствует слабая кислота, расчет рН ведется по формуле

Во всех последующих точках на кривой титрования до точки эквивалентности (в том числе в начале скачка на кривой титрования) расчет рН ведут для буферной системы (смесь CH3COOH и ее соли CH3COONa) по формуле

Концентрация оставшейся уксусной кислоты в растворе вычисляется по формуле

|
из
5.00
|
Обсуждение в статье: Меркурометрическое титрование |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

