 |
Главная |
Механизм реакции нитрования
|
из
5.00
|
Механизм реакции нитрования изучен достаточно хорошо, что, вероятно, обусловлено большим практическим значением этого процесса и масштабами производства нитросоединений.
Установлено, что при нитровании концентрированной азотной кислотой и ее смесями с другими кислотами активным реагентом является нитроний-катион NO2Å, образующийся по схеме:


или в общем виде:

Существование нитроний-катиона убедительно доказано криоскопическими измерениями, спектральными методами, а также выделением и изучением солей нитрония NO2ÅAU. Исследование кинетики процесса подтвердило активное участие нитроний-катиона в этой реакции.
При добавлении азотной кислоты температура замерзания серной кислоты понижается примерно в четыре раза больше, чем можно ожидать, если бы диссоциация не происходила, т.е. при добавлении одной молекулы азотной кислоты образуется четыре частицы.
Существование нитроний-катиона подтверждается выделением его солей, представляющих собой белые кристаллические вещества с четкими температурами плавления:
.
В солях нитрония NO2ÅAU присутствие иона нитрония точно установлено рентгеноструктурным анализом. Скорость реакции нитрования как солями нитрония, так и другими нитрующими агентами пропорциональна концентрации NO2Å.
Серная кислота в нитрующих смесях играет по меньшей мере двоякую роль: реагирует как сильная кислота при превращении HNO3 в (HO)2NOÅ и образует сильные водородные связи с водой, понижая ее активность и смещая тем самым суммарную реакцию в сторону образования нитросоединения и воды.
В случае нитрования ароматических соединений реакция протекает по обычной схеме:

Нитрование является одной из немногих реакций, где существование s-комплекса (комплекса Уэланда) было доказано экспериментально.
При нитровании азотной кислотой в инертном растворителе реакционноспособных ароматических соединений лимитирующей стадией является образование нитроний-катиона и скорость реакции не зависит от концентрации нитруемого вещества. Для соединения с пониженной реакционной способностью в этих же условиях определяющей скорость стадией будет взаимодействие субстрата с нитроний-катионом. В полярных средах, где концентрация нитроний-катиона высока, скорость реакции пропорциональна как концентрации субстрата, так и концентрации реагента.
Ряд реакционноспособных ароматических соединений нитруется даже разбавленной азотной кислотой, несмотря на практически полное отсутствие в ней ионов нитрония. Исследования (А.И.Титов, К.Ингольд) показали, что в этих случаях реакция идет через стадию нитрозирования и последующего окисления нитрозосоединений:
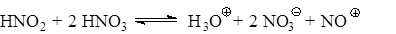

Как видно из приведенной схемы, для реакции достаточно наличия лишь следов азотистой кислоты, так как последняя регенерируется на стадии окисления нитрозосоединения.
Таким образом, физико-химический анализ азотной кислоты и ее смесей позволяют представить ее как сложную систему. В зависимости от состояния и условий применения азотная кислота может дать три различных электрофильных нитрующих агента:
- нитроний-катион NO2Å, который находится в виде сольватированного иона в протонных растворителях;
- соли нитрония, которые действуют как сольватированная ионная пара в диполярных апротонных растворителях (сульфолан и т.п.);
- протонированную форму ацетилнитрата CH3COONO2HÅ, образующегося в смесях азотной кислоты с уксусным ангидридом.
Наибольшей активностью в электрофильном нитровании обладает нитроний-катион, наименьшей – протонированный ацетилнитрат.
Коновалов считал, что нитрование разбавленной азотной кислотой при повышенных температурах осуществляется по радикальному механизму.
Радикальный механизм является основным при нитровании алканов (А.И.Титов). В отсутствие инициаторов реакция проходит по схеме:

Не исключен и цепной механизм:

Реакция ускоряется при добавлении инициаторов начальной стадии образования свободных радикалов R..
Другим возможным путем протекания радикального нитрования является следующий:

Как уже отмечалось, цепной механизм характерен для нитрования алканов. В случае нитрования аренов реакция, как правило, идет с обрывом цепи и заканчивается рекомбинацией радикалов R. и NO2..
|
из
5.00
|
Обсуждение в статье: Механизм реакции нитрования |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

