 |
Главная |
Алкилирование по Фриделю-Крафтсу
|
из
5.00
|
Алкилирование по Фриделю-Крафтсу состоит в реакции бензола с алкилгалогенидами в присутствии кислот Льюиса (AlBr3, AlCl3, FeCl3, SbCl5, BF3, ZnCl2 и др.).

Электрофильная частица образуется при взаимодействии алкилгалогенида (основание Льюиса) с катализатором (кислотой Льюиса). Взаимодействие протекает через следующие стадии.
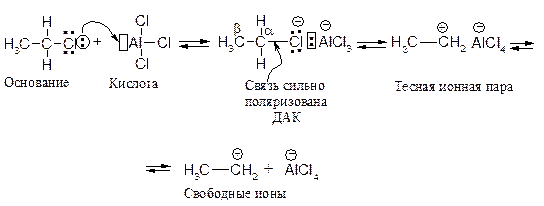
В донорно-акцепторном комплексе (ДАК) на атоме хлора появляется полный положительный заряд, что приводит к сильной поляризации связи С – Cl. Возможен даже гетеролитический разрыв этой связи, противоположно заряженные ионы удерживаются в тесной ионной паре за счет кулоновского притяжения без образования ковалентной связи.
Какое строение имеет электрофил, атакующий ароматическое ядро, определить трудно. Строение электрофильной частицы постепенно меняется от структуры ДАК до ионной пары при переходе от первичного галогеналкана к третичному. Чем более устойчив образующийся карбокатион, тем более равновесие смещено в сторону образования свободных ионов.
Возможно, комплекс трет-алкилгалогенидов с хлоридом алюминия распадается с образованием карбокатиона, который и атакует ароматическое ядро.

Способность атома галогена в R – Hal к образованию ДАК с кислотой Льюиса уменьшается от фтора к иоду. Следовательно, активность алкилирующих агентов в реакции Фриделя-Крафтса уменьшается в ряду
R – F > R – Cl > R – Br > R – I
Тенденция галогена в алкилгалогенидах к комплексообразованию с кислотами Льюиса обратно пропорциональна ионным объемам, поэтому устойчивость комплекса возрастает от алкилиодида к алкилфториду. По этой же причине возрастает поляризация связи С–Х от алкилиодида к алкилфториду, т. е. атом углерода алкилгалогенида обладает всё большим положительным зарядом, который определяет его реакционную способность по отношению к нуклеофильному ароматическому соединению. Так, например, метилбромид в присутствии бромистого алюминия реагирует с бензолом примерно в 200 раз быстрее, чем метилиодид. Поэтому для реакций алкилирования по Фриделю - Крафтсу алкилиодиды мало пригодны. Различие в реакционной способности алкилгалогенидов позволяет селективно замещать атом фтора в присутствии брома в одной и той же молекуле.

Ароматические углеводороды легко алкилируются под действием разнообразных галогенпроизводных углеводородов, их реакционная способность уменьшается в ряду:
(C6H5)3C–Hal > (C6H5)2CH–Hal > C6H5CH2-Hal > CH2=CH-CH2-Hal > > R3C-Hal > R2CH-Hal > RCH2-Hal > CH3-Hal.
В реакции алкилирования по Фриделю-Крафтсу нельзя использовать в качестве алкилирующих агентов арилгалогениды Ar-Hal и винилгалогениды R-CH=CH-Hal.
Стадии образования и стабилизации σ-комплекса аналогичны рассмотренным ранее.

Алкилирование по Фриделю-Крафтсу имеет ряд серьезных недостатков.
Во-первых, реакция алкилирования по Фриделю-Крафтсу связана с изомеризацией алкилирующего агента в ходе реакции, в результате чего образуется смесь изомерных продуктов алкилирования.
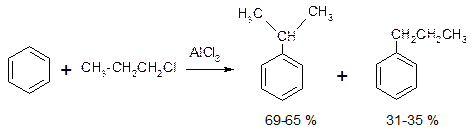
Основным продуктом алкилирования является изопропилбензол – результат взаимодействия бензола с вторичным карбокатионом (CH3)2CHÅ. Возможно, перегруппировка осуществляется на стадии образования ДАК.
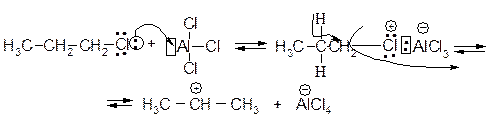
Для получения алкилбензолов с неразветвленной цепью атомов углерода используют двухстадийный синтез (п. 1.6.1.4).
Во-вторых, образующийся при алкилировании бензола продукт является более реакционноспособным, чем бензол. Поэтому алкилирование аренов алкилгалогенидами при соотношении реагентов, близком к эквимолярному, приводит к образованию значительного количества продуктов полиалкилирования.

В этом отношении алкилирование сильно отличается от нитрования и галогенирования. Для того чтобы свести полиалкилирование к минимуму, используют большой избыток ароматического углеводорода. В этом случае он выполняет роль и реагента, и растворителя.
Еще одно ограничение для использования реакции алкилирования по Фриделю-Крафтсу связано с миграцией алкильной группы в конечном продукте (диспропорционирование продуктов). Например, алкилирование толуола хлористым изопропилом при 0 оС (AlCl3, растворитель – ацетонитрил CH3CN) приводит к смеси изомеров.

Однако при 25 оС в присутствии AlCl3 (2 моль) и HCl образуется только мета-изомер.
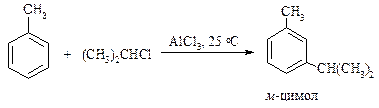
Из смеси трех изомерных цимолов в присутствии катализатора BF3 ×HCl уже через 10 минут образуется только мета-изомер.

Алкилирование по Фриделю-Крафтсу относится к немногочисленной группе обратимых реакций электрофильного ароматического замещения, подчиняющихся термодинамическому контролю: в продуктах реакции, протекающей при более высокой температуре, преобладает наиболее термодинамически устойчивый 1,3-диалкил- или 1,3,5-триалкилбензол.

Изомеризация первоначально образующихся продуктов алкилирования происходит на стадии образования s-комплекса за счет 1,2-сдвига отрицательно заряженной алкильной группы (карбоаниона).

В результате перемещения группы CH3Θ в карбокатионах между тремя изомерами ксилола устанавливается равновесие, в котором всегда преобладает наиболее стабильный мета-изомер. В зависимости от температуры массовая доля м-ксилола в смеси равна 52-60 %, п-ксилола – 23-24 % и о-ксилола – 16-25 %. В более жестких условиях изомеризация алкилбензолов приобретает межмолекулярный характер. В результате из ксилолов образуется смесь, содержащая три-, тетра- и пентаметилбензолы наряду с толуолом и бензолом, происходит диспропорционирование.
Таким образом, при алкилировании правила ориентации соблюдаются только до тех пор, пока процесс протекает в мягких условиях, благоприятствующих кинетическому контролю (низкая температура, малые количества катализатора). Напротив, в условиях термодинамического контроля (более высокая температура, продолжительное время реакции, большие количества катализатора) алкилирование приводит преимущественно к мета-замещенным продуктам.
Некоторые ограничения алкилирования по Фриделю-Крафтсу связаны с группами, которые уже имеются в ароматическом кольце: 1) соединения, содержащие только электроноакцепторные группы (-NO2, -COOH, -CHO, -CN) не алкилируются; 2) ароматические соединения с группами –NH2, -NHR, -NR2, -OH не вступают в реакции алкилирования по Фриделю-Крафтсу из-за связывания кислоты Льюиса основными группами с образованием межмолекулярного ДАК.

Для алкилирования ароматических углеводородов вместо алкилгалогенидов можно использовать спирты. В этом случае в качестве катализаторов используют трехфтористый бор, фосфорную или серную кислоты.

Катализатор следует применять в стехиометрическом количестве, т. к. вода, образующаяся в результате реакции, связывает трехфтористый бор.
Наиболее дешевыми реагентами для алкилирования аренов в промышленности являются алкены. Типичными катализаторами таких процессов служат системы HCl–AlCl3, HF–BF3 или H3PO4, HF.
Электрофильная частица образуется в результате следующих реакций:

Образование s-комплекса и его стабилизация происходят в соответствии с механизмом SEAr.

Для алкилирования ароматических углеводородов широко используется формальдегид. В присутствии минеральных кислот реакция бензола с формальдегидом приводит к дифенилметану с высоким выходом.

Ацилирование
Ацилирование - это реакция введения ацила RCO- или ароила ArCO-. При ацилировании ароматического кольца в качестве ацилирующего агента обычно используют хлорангидриды и ангидриды карбоновых кислот:

Пример: ацилирование бензола хлорангидридом уксусной кислоты.
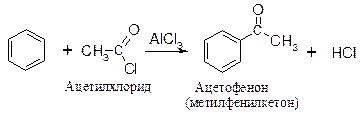
Механизм реакции
Активная частица – электрофил - образуется в реакции между ацетилхлоридом и хлоридом алюминия.

Ацилий-катион достаточно устойчив: в граничной структуре (II) все атомы имеют октет электронов, поэтому взаимодействие катализатора и ацилирующего агента может протекать с полной ионизацией. Какая из этих частиц (ДАК или ацилий-катион) атакует ароматическое ядро, зависит от природы субстрата, ацилгалогенида, растворителя и от количества катализатора.
Атака ароматического ядра ацилий-катионом приводит к образованию s-комплекса (карбокатиона), в следующей стадии отрыв протона даёт конечный продукт - кетон.

Образующийся кетон является основанием, он даёт устойчивый продукт с хлоридом алюминия.

Так хлористый алюминий выводится из реакционной среды. Поэтому возникает необходимость вводить в реакцию ацилирования эквимолекулярное количество катализатора.
По окончании реакции кетон выделяют из комплекса действием воды.

Ацильную группу можно ввести в бензольное кольцо и с помощью ангидридов карбоновых кислот.
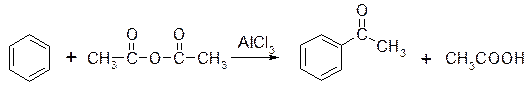
Образование ацилий-катиона происходит в соответствии со следующей схемой:

Ацилирование по Фриделю-Крафтсу лишено тех недостатков, которые присущи реакции алкилирования. При ацилировании вводится только одна ацильная группа, поскольку ароматические кетоны не вступают в дальнейшую реакцию ацилирования (так же, как и другие арены, содержащие сильные электроноакцепторные группы). Еще одним преимуществом этой реакции является отсутствие перегруппировок в ацилирующем агенте. Кроме того, для ацилирования не характерны реакции диспропорционирования продуктов.
Реакция ацилирования может быть использована в двухстадийном синтезе алкилбензолов с неразветвлённой цепью атомов углерода: первая стадия - ацилирование, вторая - восстановление полученного кетона амальгамированным цинком в концентрированной соляной кислоте (восстановление по Клеменсену).

Хлорметилирование
Хлорметильную группу можно ввести непосредственно в кольцо по способу, сходному с реакцией Фриделя - Крафтса, - взаимодействием бензола с формальдегидом и хлороводородом в присутствии хлористого алюминия или хлористого цинка.

При хлорметилировании наблюдаются те же особенности, что и в реакции алкилирования по Фриделю-Крафтсу: такое же влияние ориентантов; кроме того, образуется некоторое количество полизамещённых продуктов. В приведённом примере получается в небольшом количестве п-дизамещённый продукт.
7.6.1.6. Формилирование
При помощи реакции, аналогичной синтезу кетонов по Фриделю-Крафтсу, можно ввести в бензольное кольцо формильную группу –СНО (реакция Гаттермана-Коха). Реакцию проводят в присутствии хлористого алюминия и однохлористой меди.

Возможно, что промежуточным неустойчивым продуктом этой реакции является формилхлорид, но как таковой он выделен не был.

Ориентация и границы применения реакции Гаттермана-Коха приблизительно те же, что и при синтезе кетонов по Фриделю-Крафтсу, но выходы ниже. В обычных условиях этого метода бензол в реакцию не вступает и может быть использован в качестве растворитедя при формилировании других углеводородов.
|
из
5.00
|
Обсуждение в статье: Алкилирование по Фриделю-Крафтсу |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

