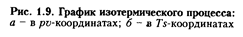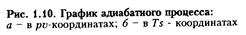|
Главная |
ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС
|
из
5.00
|
Процесс, протекающий при постоянной температуре рабочего тела, называется изотермическим. Он возможен, например, в цилиндре поршневой машины, если по мере подвода теплоты к рабочему телу поршень перемещается, увеличивая при этом объем настолько, что температура остается неизменной. График изотермического процесса pv- и Ts-диаграмм называется изотермой. Уравнение изотермического процесса может быть получено из уравнения Клапейрона, если принять температуру постоянной (T = idem):

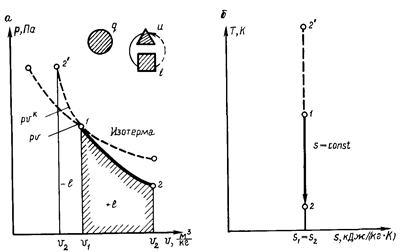
согласно (1.73) изотермический процесс в рv-диаграмм (рис. 1.9) изображается в виде равнобокой гиперболы, рас положенной симметрично относительно координатных осей.
Из уравнения (1.73) следует:

1аким образом, при постоянной температуре рабочего тела давление изменяется обратно пропорционально его удельному объему.
Работа расширения газа l (см. рис. 1.9, а) графически изображается площадью, ограниченной линией процесса (1 - 2 расширение,1 - 2' - сжатие) и осью абсцисс.
|
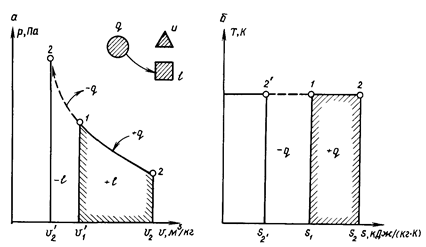
Формула для подсчета работы расширения l 1 кг газа в изотермическом процессе может быть записана в следующем виде:
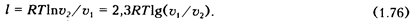
Для G (кг) газа формула (1.76) приобретает вид
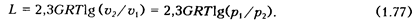
Изменение внутренней энергии в изотермическом процессе идеального газа

так как T  = T
= T  = idem.
= idem.
Количество теплоты q, сообщенной газу в данном процессе, определяется из выражения первого закона термодинамики с учетом формул (1.76) и (1.77):

Следовательно, в изотермическом процессе вся теплота, сообщаемая газу, расходуется полностью на работу расширения.
Изменение энтальпии (Δh = h  – h
– h  ) идеального газа в изотермическом процессе с учетом формулы (1.69) равно нулю:
) идеального газа в изотермическом процессе с учетом формулы (1.69) равно нулю:

В Ts-диаграмме (см. рис. 1.9, б) изотерма изображается горизонтальной линией относительно оси абсцисс, подводимая теплота (+ q) ~ площадью 1, 2,  , а отводимая теплота (- q) - площадью 1,
, а отводимая теплота (- q) - площадью 1, 
Изменение удельной энтропии в изотермическом процессе подсчитывают по уравнению

АДИАБАТНЫЙ ПРОЦЕСС
Адиабатным называется процесс, который осуществляется без теплообмена между газом и внешней средой (q = 0). Практическое использование этот процесс находит в соплах паровых турбин, реактивных двигателей и в других случаях, когда газ движется с высокими скоростями. Уравнение адиабаты имеет вид

где k = С 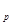 /C
/C  - показатель адиабаты (для одноатомных газов k = 1,67, для двухатомных k = 1,41, для трех- и более атомных газов k = 1,29).
- показатель адиабаты (для одноатомных газов k = 1,67, для двухатомных k = 1,41, для трех- и более атомных газов k = 1,29).
Практически адиабатный процесс можно осуществить при расширении или сжатии газа в цилиндре, стенки которого не проводят теплоты, или при протекании процесса настолько быстро (мгновенно), что теплообмен между рабочим телом и окружающей (внешней) средой не успевает произойти.
В jou-диаграмме (рис. 1.10, а) адиабата изображается неравнобокой гиперболой. Из сравнения адиабаты и изотермы видно, что давление в адиабатном процессе изменяется быстрее, чем в изотермическом.
Связь между параметрами состояния рабочего тела в адиабатном процессе устанавливается из уравнения (1.82):

Изменение внутренней энергии рабочего тела определяют по выражению

Работа расширения / газа в адиабатном процессе может быть найдена из выражения первого закона термодинамики:
|

Отсюда
Так как согласно (1.36) C 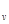 = R/(k – 1), то
= R/(k – 1), то
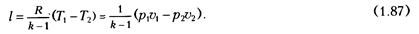
Следовательно, в адиабатном процессе расширения работа совершается за счет уменьшения внутренней энергии газа, т.е.
Т2 < T1
В обратном процессе сжатия работа, совершаемая внешней
средой над газом, идет на увеличение внутренней энергии рабочего тела, повышение его температуры.
Работа расширения газа - положительная (+ l) работа сжатия – отрицательная
(- l).
ПОЛИТРОПНЫЙ ПРОЦЕСС
Во всех реальных тепловых машинах (двигателях внутреннего сгорания - ДВС, компрессорах, газотурбинных установках и т.д.) процессы сжатия рабочего тела (газа), горения топлива, расширения рабочего тела являются политропными.
Политропный процесс обратимый и выражается уравнением

где показатель п может принимать любое значение от - ∞ до + ∞. Для каждого процесса показатель п - величина постоянная.
Все описанные ранее процессы (изохорный, изобарный, изотермический и адиабатный) являются частными случаями политропного процесса с показателями политропы п соответственно ± ∞; 0; 1; k.
Поскольку уравнение политропного процесса (pv 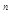 = idem) совпадает по форме с уравнением адиабатного процесса (pv
= idem) совпадает по форме с уравнением адиабатного процесса (pv 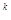 = idem), то связь между параметрами состояния газа в политропном процессе может быть выражена формулами, аналогичными формуле (1.83):
= idem), то связь между параметрами состояния газа в политропном процессе может быть выражена формулами, аналогичными формуле (1.83):

То же самое относится и к выражению для работы расширения l в политропном процессе:
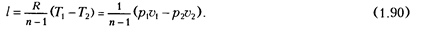
Изменение внутренней энергии в политропном процессе определяется общим выражением

Количество теплоты в процессе может быть вычислено на основании первого закона термодинамики:
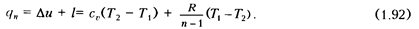
Чтобы подсчитать теплоемкость газа (рабочего тела) в политропном процессе с  , используют формулу
, используют формулу

С учетом формулы (1.92) выражение принимает вид

Изменение энтропии в политропном процессе может быть найдено из выражения
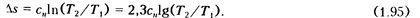
|
из
5.00
|
Обсуждение в статье: ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы