 |
Главная |
Общие методы получения аминокислот, бетаинов
|
из
5.00
|
И белковых комплексов из растительного сырья
Препараты высокоочищенных бетаинов, белков и пептидов находят разнообразное применение в научных исследованиях, медицине и биотехнологии. Так как многие из этих веществ высоколабильны, выделение проводят с помощью предельно мягких методов и при пониженной температуре (0-50С). К таким методам относятся диализ, высаливание, гель-фильтрация и ионообменная хроматография. В последние годы для выделения, разделения и анализа бетаинов, белков и пептидов используется капиллярный электрофорез.
Капиллярный электрофорез (CE, CE/MS) выполняется на капиллярных колонках длиной от 40 см до 1 м. В пустотелом капилляре, к стенкам которого приложен отрицательный потенциал, а к его концам накладывается разность потенциалов. Под действием электрического поля начинается движение молекул электролита от анода к катоду, вызывающее общее течение жидкости. При введении в такую систему анализируемого образца положительно заряженные молекулы анализируемых соединений движутся к катоду быстрее потока жидкости в капилляре, незаряженные молекулы «текут» с потоком, а отрицательно заряженные, удерживаясь положительным зарядом, текут медленней всего, но тем не менее, текут к катоду. Происходит весьма эффективное разделение молекул по зарядам. Идентификация осуществляется спектрально (УФ) или другим подходящим способом (часто- масс-спектрометр-CE/MS).
В методе используются пустотелые кварцевые капилляры с внутренними диаметрами 50, 75 и 100 мкм и с эффективной длиной 24.5, 40, 56, 72 и 104 см. С наружной стороны капилляры имеют полиамидное покрытие, улучшающее их прочность. Торцы капилляров обработаны с зеркальной чистотой поверхности. Предусмотрено "окошко" для детектирования по УФ. Кроме того, имеются капилляры с удлиненным оптическим путем детектирования (для капилляров с внутренним диаметром 25 мкм оптический путь составляет 125 мкм, для 50-мкм капилляров- 150 мкм, а для 75 микронных- 200 мкм).
Покрытые изнутри поливиниловым спиртом капилляры минимизируют гидрофобные и электростатические взаимодействия анализируемых соединений со стенками и, кроме того, снижают электроосмотический поток. Покрытие стабильно в растворах с рН от 2.5 до 9.5. Все это улучшает форму пиков и воспроизводимость времен удерживания.
Капилляры для капиллярной электрохроматографии (СЕС) обычно заполняются CEC-Hypersil сорбентом для ВЭЖХ (силикагелевые частицы размером 3 мкм с привитой фазой). В качестве привитой фазы применяются (С8, С18 и фенил) углеводородные цепи. Капиллярная электрохроматография сочетает разделительную способность ВЭЖХ и эффективность капиллярного электрофореза. На обоих концах капилляров можно создавать избыточное давление для предотвращения выделения пузырьков газа в результате наложения высокого потенциала.
Капиллярный электрофорез отличается от родственных ему методов жидкостной хроматографии чрезвычайно высокой эффективностью разделения.
АНТРАЦЕНОВЫЕ ВЕЩЕСТВА
Антраценовыми называют группу природных веществ, содержащих три конденсированных кольца, общей формулы С6-С2-С6.

Различают окисленные, восстановленные и конденсиро-ванные производные антрахинонов, ниже представлены некоторые примеры структур:
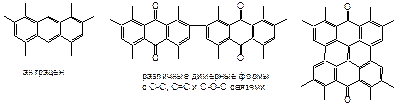 |
Все они могут содержать в качестве заместителей ОН, ОСН3, С(О)Н, СООН, радикалы от С1 до С5, углеводные фрагменты.
В зависимости от характера заместителей, они растворяются в неполярных (агликоны) и полярных растворителях при нагревании.
Восстановленные формы окисляются, особенно при нагревании, до соответствующих окисленных форм. За счет образования фенолятов, они хорошо растворимы в щелочах.
Различные производные антрахинона с доминирующим содержанием 1-2 групп присутствуют, чаще всего, в растениях семейства Rubiaceae, Phamnaceae, Polygonaceae, Fabaceae, Leguminosae, Liliaceae, но описаны также и во многих низших растениях, мхах, плесенях, лишайниках, в морской флоре, в микроорганизмах (антрациклиновые антибиотики), в червях.
Антрагликозиды содержатся в клеточном соке и легко диагностируются при микроскопии, агликоны локализуются во всех органах, но более всего в корнях и корневищах.
При анализе любого сырья на наличие антраценов, их экстракцию проводят 50-70% спиртом или 50% ацетоном при нагревании. Это позволяет извлечь агликоны и гликозиды. При необходимости их делят методами электрофореза, БХ, ТСХ, ВЭЖХ, а количественное содержание определяют методами потенциометрии, колори- и спектрометрии, ГЖХ, ЖЖХ, ВЭЖХ, реже ВЭТСХ.
Выделение:
1. Измельченное растительное сырье заливают (1:10) спиртом этиловым 70%, нагревают на водяной бане в течение 1 часа, фильтруют.
2. Измельченное растительное сырье заливают спиртом этиловым (хлороформом, этилацетатом), прибавляют 2-3 мл 10% раствора кислоты серной, нагревают на водяной бане в течение 1 часа, фильтруют.
3. Навеску препарата растворяют в 50% растворе ацетона (спирте этиловом 50-70%), перемешивают до растворе-ния.
Полученное любым методом извлечение используют для качественного анализа, отбирая по 1-3 мл [11].
Качественный анализ:
Поскольку все производные антрахинонов являются полифенолами, они дают все реакции фенолов, при этом оттенок развивающегося окрашивания определяется расположением ОН-групп и их количеством. Кроме того, их можно обнаружить реакциями [11,12]:
q Реакция Борнтрегера. Добавляют 10% раствор натра едкого, появляется окрашивание от розового до бордово-красного (1,8-диоксипроизводные), пурпурное (1,4-диоксипроиз-водные), фиолетовое (1,2-диоксипроизводные), красно-бурое (восстановленные формы).
q В парах или от добавления раствора аммиака появляется окрашивание от розового до карминово-красного (окисленные формы).
q Добавляют 3% спиртовый раствор магния ацетата, появляется окрашивание от розового до красно-фиолетового (окисленные окси-антрахиноны). 1,6- и 1,8-диоксипроизводные окрашиваются в оранжево-красный цвет; 1,2-диоксипроиз-водные – в фиолетовый; 1,4-диоксипроизводные – в пурпурный. Реакция более чувствительная, чем р. Борнтрегера!
q Добавляют несколько капель кислого раствора циркония нитрата, появляется красно-фиолетовый осадок (орто-диокси-замещенные антрахиноны).
q Добавляют 5 мл кислоты уксусной ледяной, появляется флюоресценция.
q Добавляют 5 мл кислоты серной концентрированной появляется интенсивно синее окрашивание (пара-расположен-ные ОН-группы).
q Добавляют 3-5 мл 0.5 н спиртового раствора калия гидроксида, появляется желтое и зеленое окрашивание или оттенки. При стоянии на воздухе по мере окисления окраска меняется до красно-коричневой (различные типы связи димерных структур).
q Добавляют 2-3 капли 0.1% раствора пара-нитрозоди-метиланилина в пиридине появляется болотно-зеленое окра-шивание (восстановленные формы антрахинонов).
q Добавляют 1-3 мл 3-5% растворов натрия карбоната, буры, железа окисного хлорида, 25% раствор кислоты фосфорной, 1% аммиачного раствора серебра азотнокислого, 5% раствор цинка ацетата, 1-3% раствор железоаммониевых квасцов, все перечисленные реактивы дают окрашивание или осадки.
В качестве систем для хроматографического анализа чаще используют:
§ этилацетат – метанол – вода 100:17:13 (ТСХ на силикагеле)
§ бензол – метанол 9:1 (БХ, ТСХ)
§ толуол – н-бутанол – уксусная кислота 1:1:1
§ н-бутанол – метиловый спирт – вода 5:5:1 или 5:2:2
§ бензол – ацетон 8:2 (БХ)
§ н-бутанол – уксусная кислота – вода 40:12.5:29 (БХ)
Применение тонкослойной и колоночной хроматографии на силикагеле дает большие возможности для разделения сложных смесей оксиметилантрахинонов. Качественный состав этих соединений в различных органах растений исследуют двухмерной хроматографией в тонком слое Silicagel LS 5/40 мк (+13% гипса) на стеклянных пластинках размером 18x18 или 20x20 см, которые предварительно активируют при 1100С в течение часа, или на пластинках Silufol UV254 в системах растворителей: толуол - этилформиат – муравьиная кислота (5:4:1) (первое направление) и этилацетат - метанол - вода (100:16.5:13.5) (второе направление). Экстракцию антрахинонов проводят 70%-ным этиловым спиртом трёхкратно при кипячении на водяной бане с обратным холодильником в течение 30, 20 и 10 минут при соотношении сырья и растворителя l:10. Объединённый фильтрат сгущают до точного объема (2-3 мл) и наносят количественно в уголок хроматограммы. В спиртовых экстрактах присутствуют агликоны и гликозиды. Пятна оксиметилантрахинонов имеют в дневном свете желтую окраску, в УФ свете - оранжевую флюоресценцию. Обработка аммиаком меняет цвет пятен на малиновый в дневном свете и на оранжевый в УФ свете. Пятна эмодина (реум-, алоэ- и франгула-эмодина) и некоторых его производных после обработки аммиаком в УФ свете темнеют.
Силикагель с адсорбированным на нем веществом соскабливают с хроматографической пластинки, вещество элюируют спиртом этиловым, при необходимости гидролизуют в течение одного часа кислотой серной 10% (при соотношении элюата и кислоты 1:1) на кипящей водяной бане, а затем извлекают из гидролизата толуолом, бензолом или хлороформом. Агликоны хризофанол, эмодин, фисцион, реин, алоэ-эмодин хроматографируют параллельно с элюатами (из экстракта) на пластинках Silufol UV254 в системе толуол - этиловый эфир муравьиной кислоты - муравьиная кислота (5:4:1). Следует отметить, что вполне возможно нанесение на хроматограмму кислого гидролизата без извлечения агликонов липофильными растворителями. Описанная методика позволяет быстро и надёжно идентифицировать агликоновую часть "связанных" антрахинонов (при наличии двух - трех тонкослойных хроматограмм).
Разделение антрахинонов возможно и с помощью хроматографии на колонках силикагеля марки КСК. Промывают колонки теми смесями растворителей, которые дают хорошее разделение в тонких слоях силикагеля, а именно: смесь толуола, этилового эфира муравьиной кислоты и муравьиной кислоты (5:4:1); смесь бензола и четыреххлористого углерода (1:1), этилового спирта и бензола (92:8) и др. Соотношение смеси и адсорбента 1:150, объем фракций - 50 мл. По этому же принципу разделяют сумму агликонов после гидролиза этанольных экстрактов. Применение для колоночной хроматографии растворителей, успешно показавших себя при хроматографии в тонких слоях силикагеля, для многих растений оказывается успешным.
При разработке показателей подлинности различных видов зверобоя предложен метод ТСХ на пластинах силикагеля UV254, которые перед нанесением растворов промывают метанолом и высушивают на воздухе. Затем наносят отдельно полосками (20 мм х 3 мм) 20 мкл анализируемых растворов и 5 мкл раствора СО гиперозида (5 мг на 10 мл метанола). Хроматографируют в системе: ледяная уксусная кислота - безводная муравьиная кислота – вода – этилацетат (1:1:2:10). Хроматограммы сушат вначале на воздухе, а затем 2 минуты в потоке горячего воздуха. Еще горячий слой набрызгивают раствором дифенилборил-оксиэтиламина (10 г/л) в метаноле и просматривают в ультрафиолетовом свете при 365 нм. На хроматограмме анализируемых растворов присутствует несколько желтых и оранжевых пятен, из которых одно соответствует по положению, размеру и интенсивности пятну гиперицина на хроматограмме сравнительного раствора; пятна со значением Rf прибл. 0.85 (гиперицин) и Rf прибл. 0.80 (псевдогиперицин), светло-голубые пятна (хлорогеновая и другие кислоты) [29-36].
Для разделения, качественного определения и анализа подлинности антраценсодержащих фармпрепаратов широко используется метод ВЭЖХ. Наиболее эффективными признаны ODS C8 и C18 хроматографические системы различного производства: Asahipak GS-310, Nucleosil P300 C18, GL ODS-3, Lichrospher100 RP18 и Spherisorb ODS-1. В качестве подвижных фаз были предложены метанол [37], смесь метанола и воды (при градиентном элюировании от 45:55 до 80:20 за 80 мин) [38], ацетонитрил – вода 65:35 [39], 0.02Млимонная кислота (с добавлением 0.14% триэтиламина)–ацетонитрил–метанол–тетрагидрофуран 100:50:25:5 [40], с использованием УФ детектора (254 нм). Хорошие результаты были также получены на колонке с Purospher RP18 сорбентом, элюентом служила смесь ацетонитрила, воды и муравьиной кислоты в соотношении 25:72:3 при использовании УФ детектора (270 нм) [41]. Высокую селективность анализа антраценсодержащих препаратов показала система Shimpack CLC-ODS с подвижной фазой метанол – 0.1% H3PO4 80:20 и УФ детектором 410 нм [42].
Количественное определение:
Выбор метода количественного определения содержания антраценпроизводных определяется природой доминирующих производных антрахинона и сопутствующих веществ.
Чаще всего проводят предварительное расщепление антрагликозидов нагреванием с серной, хлороводородной или уксусной кислотами. Выделившиеся в процессе гидролиза агликоны экстрагируют органическим растворителем и определяют различными методами. Чаще других используется метод Аутерхоффа, который предложил соединить описанные выше две стадии в одной методике, описанной в ГФ Х1 для антраценсодержащего сырья.
Различные модификации методики касались использования различных СО и, соответственно, длин волн, при которых проводилось определение оптической плотности.
Поскольку производные антрахинона дают оттенки красного цвета со щелочью, вместо СО антрахинонового типа, которые, как правило, мало доступны, используют растворы кобальта хлорида и этот метод включен в фармакопеи многих стран.
Лемли предложил извлекать димерные антрагликозиды из сырья водой при нагревании, затем окислять их железом хлорным и гидролизовать кислотой хлороводородной, полученные агликоны экстрагировать эфиром. Аликвотную часть эфирного извлечения упарить, остаток растворить в 1н растворе калия гидроксида и измерить оптическую плотность красного раствора.
Бэтс предложил методику раздельного определения свободных антрахинонов, О- и С-гликозидов в американской крушине и фитопрепаратах на ее основе. Свободные антрахиноны отделяют растиранием свежей коры с песком и водой с последующей экстракцией четыреххлористым углеро-дом. О-гликозиды определяют после кислотного гидролиза экстракцией четыреххлористым углеродом, а С-гликозиды после обработки коры раствором железа хлорного и кислоты с последующей экстракцией четыреххлористым углеродом. 3 полученных органических извлечения обрабатывают раство-рами 1н натрия гидроксида и определяют оптическую плотность полученных растворов.
Для раздельного определения сеннозидов А и Б в листьях и стручках кассии, для определения каскарозида и алоина в американской крушине, для определения сеннозидов и реинидинов в ревене, для разделения антраценов в европейской и американской крушине предложены также хроматографи-ческие варианты (ТСХ и колоночный) в различных системах с последующим определением плотности окраски пятен денситометрическим методом. Эти методы удобны для научно-исследовательских работ, но трудоемкие и длительные во времени.
Ниже приведены некоторые примеры хорошо воспроизво-димых методик, используемых в ГФ Х, Х1 и некоторых частных статьях [29-36].
Метод 1включает извлечение антраценов после гидролиза гликозидов. Около 1.0 г (точная навеска) измельченного сырья помещают в колбу вместимостью 100 мл, прибавляют 15 мл 10% кислоты серной (7.5 мл кислоты уксусной ледяной) и нагревают с обратным холодильником на кипящей водяной бане в течение 1 часа. Охлаждают, через холодильник добавляют 50 мл хлороформа (этилацетата) и кипятят еще в течение 1 часа.
Охлаждают, извлечение фильтруют в делительную воронку, прибавляют 20 мл щелочно-аммиачного раствора, взбалтывают 5-7 минут. После полного расслоения прозрачный красный нижний слой сливают. Обработку повторяют до прекращения окрашивания щелочно-аммиачного слоя, перемешивают.
Измеряют оптическую плотность полученных щелочно-аммиачных извлечений при длине волны 525±5 нм в кювете с толщиной слоя 10 мм, используя в качестве раствора сравнения щелочно-аммиачный раствор.
Содержание производных антрахинона в пересчете на хризофановую кислоту (эмодин, истизин, ализарин, гиперицин и др.) вычисляют по формуле:
|
m . (100 – W)
где С- содержание производных антрахинона в 1 мл испытуемого раствора, найденное по калибровочному графику, в граммах;
m - масса навески сырья, в граммах;
W - потеря в массе при высушивании сырья, в процентах.
Примечания. Построение калибровочного гра-фика. Калибровочный график строят по растворам кобальта хлорида, высушенного до постоянной массы, исходя из того, что 1% раствор кобальта хлорида по оптической плотности при длине волны 525±5 нм соответствует 4.3 мг хризофановой кислоты или 3.6 мг истизина в 1 л щелочно-аммиачного раствора.
Приготовление щелочно-аммиачного раство-ра: 50 г натрия гидроксида растворяют при перемешивании в 870 мл воды очищенной. После охлаждения раствора прибавляют 80 мл раствора аммиака концентрированного, перемешивают.
Раствор годен в течение суток [7,30,33].
* Вместо щелочно-аммиачного раствора, годность которого ограничена 1 сутками, вследствие летучести аммиака, извлечение антрахинонов возможно 0.5М раствором натрия гидроксида.
** Если в сумме антрахинонов преобладает эмодин, калибровочный график строят по растворам эмодина при длине волны 483 нм, если хризофанол – при 515 нм, глюкофрангулин – 475 нм, франгулин – 500 нм [9].
Метод 2. Около 0.2 г (точная навеска) препарата (мазь, суппозиторий и др.) растворяют в 10 мл диоксана в мерной колбе вместимостью 100 мл и доводят объем до метки щелочно-аммиачным раствором, перемешивают. 10 мл полученного раствора помещают в мерную колбу на 50 мл, доводят объем до метки тем же щелочно-аммиачным раствором, перемешивают.
Измеряют оптическую плотность раствора при длине волны 530±5 нм в кювете с толщиной слоя 10 мм.
Далее, как в методе 1.
Содержание производных антрахинона в процентах вычисляют по формуле:
|
m . 10 . [(100 – W)]
где D– оптическая плотность испытуемого раствора при длине волны 530±5 нм;
m - масса навески сырья или препарата, в граммах;
W - потеря в массе при высушивании сырья, в процентах.
* Вследствие малого срока годности щелочно-аммиачного раствора, можно использовать 3-5% водные растворы натрия гидроксида.
** Метод пригоден для анализа сырья и фитопрепаратов [30].
При наличии в сырье и препаратах димерных форм пригоден метод 3. Около 0.2 г (точная навеска) препарата (мази, суппозитории, свечи) в колбе вместимостью 50 мл растворяют в 10 мл ацетона (или спирта) при нагревании на водяной бане при 30-400С. Охлаждают, фильтруют в мерную колбу на 25 мл, доводят объем раствора ацетоном до метки, перемешивают.
Измеряют оптическую плотность полученного раствора при длине волны 590 нм в кювете с толщиной слоя 10 мм, используя в качестве раствора сравнения ацетон.
Содержание производных антрахинона в пересчете на гиперицин в процентах (Х) вычисляют по формуле:
|
m . 513
где D - оптическая плотность испытуемого раствора при длине волны 590 нм;
513 – удельный показатель поглощения гиперицина в ацетоне при длине волны 590 нм;
* 718 - удельный показатель поглощения гиперицина в спирте этиловом при длине волны 590 нм;
m – масса навески препарата, в граммах;
b – средняя масса препарата (таблетка, суппозиторий и т.д.).
Модификация этой методики для сырья: 1 г (точная навеска) измельченного лекарственного сырья экстрагируют в приборе Сокслета хлороформом до тех пор, пока обратно не начнет стекать бесцветный хлороформ. Полученное извлечение отделяют, а сырье экстрагируют в приборе Сокслета ацетоном до тех пор, пока обратно не начнет стекать бесцветный ацетон. Жидкость упаривают под вакуумом досуха, остаток растворяют в спирте метиловом, переносят в мерную колбу на 25 мл и доводят объем раствора до метки тем же растворителем. [5 мл этого раствора разбавляют спиртом метиловым до объема 25 мл.] (*)
Измеряют оптическую плотность полученного раствора при длине волны 590 нм в кювете с толщиной слоя 10 мм, используя в качестве раствора сравнения спирт метиловый.
Содержание гиперицина (Х) в процентах определяют по формуле:
|
m . (100 – W)
где D– оптическая плотность испытуемого раствора при длине волны 590 нм;
m - масса навески сырья, в граммах;
W - потеря в массе при высушивании сырья, в процентах.
* Разбавление проводят при необходимости.
При наличии в сырье и препаратах димерных гликозиди-рованных форм антрахинонов пригоден метод 4. Около 0.3 г (точная навеска) препарата помещают в колбу, прибавляют 20 мл 10% раствора железа окисного хлорида, 0.1 г натрия бикарбоната, 10 мл воды очищенной и кипятят с обратным холодильником на кипящей водяной бане в течение 1 часа. Прибавляют 1.5 мл кислоты хлороводородной концентрирован-ной, 10-20 мл воды очищенной и кипятят еще 20-30 минут до прозрачности раствора. Охлаждают, переносят в делительную воронку и экстрагируют 40 мл хлороформа. Хлороформное извлечение упаривают досуха. К остатку прибавляют 25 мл 0.5% раствора магния ацетата, появляется розовое окрашивание, встряхивают до полного растворения и фильтруют.
Измеряют оптическую плотность полученного раствора при длине волны 515 нм в кювете с толщиной слоя 10 мм, используя в качестве раствора сравнения воду очищенную.
Содержание антрагликозидов в процентах (Х) в пересчете на СО сеннозида вычисляют по формуле:
|
m . 240 . 25
где D - оптическая плотность испытуемого раствора при длине волны 515 нм;
240 – удельный показатель поглощения СО сеннозида при длине волны 515 нм;
m – масса навески препарата, в граммах [31,32].
Ниже приведена методика, позволяющая определить содержание компонентов в сумме производных антрахинона.
Метод 5. Точную навеску измельченного сырья (0.5-1.0 г) помещают в колбу вместимостью 100 мл, прибавляют 30 мл спирта этилового 70% и кипятят на водяной бане 1 час. Экстракт декантируют, а экстракцию повторяют еще раз в тех же условиях.
Объединенные экстракты концентрируют на роторном испарителе до 2-3 мл (точный объем).
0.2-0.3 мл микропипеткой наносят на линию старта пластинки Силуфол UV254 или силикагель LS 5/40 для ТСХ. Высушивают на воздухе, помещают в камеру и хроматогра-фируют в системе толуол(бензол)-этиловый эфир муравьиной кислоты-муравьиная кислота (75:24:1) до половины пластинки. Пластинки вынимают, высушивают на воздухе и хроматогра-фируют в системе петролейный эфир-этилацетат-уксусная кислота (90:5:5) до конца пластинки. (*)
Пятна индивидуальных антрахинонов вместе с силикагелем переносят в стеклянные колонки высотой 6-7 см, диаметром 0.6-1 см или на фильтры Шота. Элюируют антрахиноны с силикагеля спиртом этиловым 95-96%.
Измеряют оптическую плотность элюатов на спектро-фотометре при длине волны 430 нм (если в сырье доминируют хризофановая кислота, алоэ-эмодин и реин), 440 нм (если - эмодин и фисцион), 248 нм (если - ализарин).
В качестве раствора сравнения используют спиртовый элюат с чистого слоя силикагеля этой пластинки.
Калибровочные графики для СО антрахинонов строят для спиртовых растворов (96%), концентрации 1 мг/мл.
Содержание индивидуальных антрахинонов в процентах (Х) на абсолютно сухое сырье рассчитывают по формуле:

|
m . V3 . (100 – W) . 1000
где С- содержание антрахинона в 1 мл испытуемого раствора, найденное по калибровочному графику, в миллиграммах;
V1 – объем экстракта, в миллилитрах;
V2 – объем элюата, в миллилитрах;
V3 – объем экстракта, нанесенный на хроматограмму, в миллилитрах;
W - потеря в массе при высушивании сырья, в процентах;
m – масса навески сырья в граммах [34].
* В системе 1, хризофанол и фисцион не разделяются, хорошо делятся алоэ-эмодин, ализарин, реин, эмодин; в системе 2 – разделяются хризофанол и фисцион.
** Содержание антрахинонов в сырье определяют суммированием содержания индивидуальных антрахинонов.
*** Если в сырье одновременно присутствуют заметные количества гликозидов антрахинонов, проводят гидролиз аликвоты экстракта кислотой серной 10% в течение часа на кипящей водяной бане [43].
Например, в пенициллиновые флаконы отбирают 0.1-0.3 мл экстракта, добавляют такой же объем раствора кислоты серной и после гидролиза весь гидролизат количественно наносят полоской в 1 см на пластинки с силикагелем, которые хроматографируют в вышеуказанных системах. Очерчивают пятна индивидуальных антрахинонов, снимают слой силикагеля с веществом и переносят в стеклянные колонки диаметром в верхней части 0.6 см, в нижней - 0.1 см и высотой 6-7 см. Элюируют агликоны с силикагеля спиртом этиловым 96% порциями по 0.5 мл до получения точного объема не менее 3 мл.
Калибровочные графики для индивидуальных веществ - хризофанола, фисциона, эмодина, реина, алоэ-эмодина, ализа-рина строят после проведения их через процедуры хромато-графирования и элюции, как и в случае работы с экстрактами. Используют стандартные растворы этих антрахинонов в спирте этиловом 96% (концентрация 1 мг/мл), в качестве контроля – спирт этиловый 96 %.
|
из
5.00
|
Обсуждение в статье: Общие методы получения аминокислот, бетаинов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

