 |
Главная |
Свойства коллоидных растворов
|
из
5.00
|
1. Оптические свойства.
Если взять два стакана – один с раствором NaCl, а другой – с гидрозолем, то на вид трудно установить, где истинный раствор, а где коллоидный, т. к. на вид обе жидкости прозрачны. Но их можно отличить по оптическим свойствам. Если в темноте через растворы пропустить узкий и яркий луч света, то в истинном растворе NaCl он будет невидим («истинные растворы оптически пусты»). А в стакане с золем будет видна световая дорожка – конус Фарадея-Тиндаля. Этот эффект характерен для всех дисперсных систем с размером частиц 1 – 100нм. Он объясняется рассеиванием света коллоидными частицами, размер которых соизмерим с длиной волны падающего света. Свет как бы огибает каждую частицу и меняет направление – рассеивается. Этим объясняется голубоватая опалесценция коллоидных растворов.
Сильнее всего рассеиваются короткие волны, что придаёт голубую окраску небу. Меньше всего рассеиваются длинноволновые участки спектра. Поэтому стоп-фонари у машин, светофоров имеют красную окраску, чтобы было дальше видно.
На явлении рассеивания света коллоидными частицами основано применение ультрамикроскопа для изучения коллоидных растворов.
Как известно, малый размер коллоидных частиц не позволяет наблюдать их в обычный микроскоп. В ультрамикроскопе применяют боковое освещение, когда свет не попадает в глаз наблюдателя. Поэтому фон остается темным и на нем видны светящиеся точки коллоидных частиц. Здесь можно видеть броуновское движение, подсчитать число частиц. Но особенности структуры можно наблюдать только в электронном микроскопе.
2. Окраска коллоидных растворов.
Часть падающего света коллоидный раствор поглощает. Избирательное поглощение света коллоидным раствором приводит к его окрашиванию в тот или иной цвет.
Золи одного и того же вещества могут приобретать разную окраску в зависимости от способа приготовления, так как в этом случае будет разной степень дисперсности частиц. Например, золи золота в грубодисперсном состоянии имеют синюю, при большей дисперсности – фиолетовую, в высокодисперсном состоянии – ярко-красную окраски. Причем окраска золей является очень интенсивной. Например, для приготовления искусственного рубинового стекла для автомобильных фар, светофоров и т.д. на 1 т стеклянной массы надо добавить 100 г коллоидного золота.
Красивая и яркая окраска драгоценных камней (рубинов, сапфиров, изумрудов) обусловлена наличием в них ничтожно малых количеств примесей тяжелых металлов и их оксидов, находящихся в коллоидном состоянии.
3. Молекулярно-кинетические свойства вызваны тепловым движением частиц в растворе. Эти свойства у коллоидных растворов принципиально не отличаются от свойств истинных растворов, но из-за большего размера коллоидных частиц и меньшей их концентрации эти свойства выражены значительно слабее.
а) Броуновское движение.
Частицы дисперсной фазы золя под влиянием ударов молекул растворителя находятся в состоянии непрерывного хаотического движения. Это движение хорошо видно в ультрамикроскоп. Броуновское движение коллоидных частиц можно сравнить с движением волейбольного мяча под ударами игроков.
б) Диффузия.
Благодаря броуновскому движению коллоидных частиц в коллоидных растворах также возможен самопроизвольный процесс выравнивания концентрации, то есть диффузия. Коэффициент диффузии, который зависит от размеров частиц и определяется по уравнению Эйнштейна,
 (2.1)
(2.1)
для коллоидных растворов будет в сотни и тысячи раз меньше, чем для истинных растворов.
в) Осмотическое давление.
Для разбавленных растворов неэлектролитов осмотическое давление, согласно закону Вант-Гоффа, пропорционально молярной концентрации кинетически активных частиц.
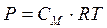 (2.2)
(2.2)
Если учесть, что объем и масса коллоидной частицы больше, чем объем и масса низкомолекулярных веществ, то в единице объема коллоидных частиц будет меньше при одной и той же массовой концентрации. А значит и меньше осмотическое давление (в сотни и тысячи раз).
г) Седиментация – осаждение частиц под действием силы тяжести, отстаивание. Скорость оседания частиц зависит от их размеров, от вязкости среды, от скорости диффузии, которая противоположна седиментации.
Это явление используется для разделения компонентов коллоидного раствора, например, плазму отделяют от эритроцитов. Поскольку оседание таких мелких частиц под действием силы тяжести происходит очень медленно, для ускорения применяют центрифуги и ультрацентрифуги, развивающие центробежную силу, в миллион раз превышающую силу тяжести. С помощью ультрацентрифуг определяют молекулярные массы белков и ВМС, так как скорость осаждения пропорциональна молекулярной массе.
Устойчивость золей.
Проблема устойчивости дисперсных систем одна из основных в коллоидной химии. Являясь высокодисперсными системами с большой поверхностью раздела фаз, коллоидные системы обладают большим избытком поверхностной энергии и поэтому термодинамически неустойчивы даже не смотря на наличие стабилизатора. Тем не менее, многие из них сохраняются многие годы, а золи золота, полученные Фарадеем более ста лет назад, устойчивы и сейчас, и хранятся в его музее. Под устойчивостью золей понимают их способность сохранять неизменность свойств во времени. Существует два вида устойчивости дисперсных систем: кинетическая и агрегативная.
Кинетическая (или седиментационная) – это способность коллоидных систем находиться в дисперсном состоянии и не осаждать дисперсную фазу, то есть это устойчивость частиц дисперсной фазы против силы тяжести. Высокодисперсные коллоидные системы кинетически устойчивы, так как мелкие частицы удерживаются во взвешенном состоянии благодаря броуновскому движению и силе Архимеда. Чем мельче частицы, тем выше кинетическая устойчивость.
Агрегативная устойчивость – способность сохранять определенную степень дисперсности, не объединяясь в более крупные агрегаты. То есть это устойчивость к объединению частиц, их слипанию, коагуляции.
Нарушение агрегативной устойчивости из-за слипания частиц и выпадение дисперсной фазы в осадок называют коагуляцией.
Коллоидные системы агрегативно неустойчивы, так как при коагуляции уменьшается площадь поверхности и, следовательно, поверхностная энергия. Поэтому, агрегативная устойчивость коллоидных систем лишь относительна. Она обусловлена присутствием на поверхности коллоидных частиц стабилизатора, образующего двойной электрический слой. Рассмотрим причины агрегативной устойчивости.
При сближении мицелл на расстояние, соизмеримое с размерами частиц, т.е. при соприкосновении их диффузионных слоев, возникает два вида противоположно направленных сил:
– силы межмолекулярного притяжения, силы Ван-дер-Ваальса.
– силы электростатического отталкивания одноименно заряженных частиц ДЭС (диффузионного слоя и гранул) и одноименно заряженных концов диполей воды гидратной оболочки. Эти силы отталкивания называют «расклинивающим давлением».
|
 |

 | |||
 | |||

Рис 2.5. Расклинивающее давление.
Следовательно, расклинивающее давление обеспечивает агрегативную устойчивость коллоидных систем, препятствует коагуляции.
Баланс сил притяжения и отталкивания можно нарушить. Можно увеличить силы отталкивания, а, значит, и увеличить устойчивость коллоидных систем путем добавления к золям специальных веществ (ПАВ, ВМС, белков и т.д.). Они адсорбируются на поверхности частиц дисперсной фазы, создают защитную оболочку - «коллоидную защиту», за счет которой лиофобный золь приобретает свойства лиофильного.
Коагуляция золей.
Даже при наличии стабилизатора агрегативная устойчивость золей невысока и в них происходит самопроизвольный процесс слипания частиц – коагуляция и уменьшение суммарной площади поверхности. Коагуляция коллоидных растворов происходит с разной скоростью, то есть коллоидные растворы обладают разной устойчивостью.
Коагуляцию можно ускорить любыми внешними воздействиями на золь:
– резкой сменой температуры;
– повышением давления;
– механическим перемешиванием или вибрацией;
– жестким облучением;
– повышением концентрации;
– добавлением электролитов.
Закономерности коагуляции золей электролитами описываются правилом Шульце – Гарди:
1. Любой электролит может вызвать коагуляцию при концентрациях, равных или больше порога коагуляции.
2. Минимальная концентрация электролита, вызывающая явную коагуляцию, называется порогом коагуляции. Порог коагуляции рассчитывается по формуле:
 ( 2.3)
( 2.3)
Величина, обратная порогу коагуляции, называется
|
3. Коагуляцию вызывают лишь те ионы электролита, знак заряда которых противоположен знаку заряда гранулы.
4. Чем выше заряд коагулирующего иона, тем меньше его порог коагуляции, тем выше его коагулирующая способность. Для одно-, двух- и трехзарядных ионов пороги коагуляции относятся как величины, обратные заряду в шестой степени: 
5. Органические ионы обладают большей коагулирующей способностью, чем неорганические с таким же зарядом.
Например, рассмотрим коагуляцию электролитами золя сульфида мышьяка, стабилизированного сероводородом и полученного по реакции:
2AsCl3 + 3H2S → As2S3 ↓ + 6HCl.
Он коагулирует под действием катионов, поскольку гранула заряжена отрицательно. Пороги коагуляции резко уменьшаются с ростом заряда катиона. Если бы коагуляцию вызывали анионы, пороги коагуляции были бы одинаковы для этих электролитов.
{m(As2S3)n S 2- (2n-x)H+}X – xH+
Электролит Коагулирующий ион Порог коагуляции, моль/л
NaCl Na+ 51
KCl K+ 50
CaCl2 Ca 2+ 0.7
AlCl3 Al 3+ 0.09
При коагуляции смесями электролитов может наблюдаться 3 случая:
1. Аддитивность (add - складывать). Электролиты действуют независимо друг от друга. Их коагулирующее действие определяется по правилу простого сложения.
2. Антагонизм электролитов – подавление коагулирующей способности другого иона.
3. Синергизм электролитов – взаимное усиление коагулирующей способности. Встречается реже.
Частным случаем коагуляции электролитами является взаимная коагуляция золей, имеющих противоположные знаки зарядов гранул.
Например, золи Fe(OH)3 и Al(OH)3 используют для очистки природных и промышленных вод. Их положительно заряженные частицы вызывают быструю взаимную коагуляцию с отрицательно заряженными коллоидными частицами почвы и микрофлоры загрязненной воды.
Механизм коагуляции.
Теория коагуляции коллоидных растворов электролитами довольно сложная. В настоящее время механизм коагуляции представляют так: рассмотрим его на примере коагуляции золя сульфида мышьяка под действием электролита сульфата магния: {m(As2S3)n S 2- (2n-x)H+}X – xH+
MgSO4 → Mg2+ + SO4 2-
1. Ионы – коагулянты, Мg2+, противоположно заряженные грануле, притягиваются к ней.
2. На их пути находятся одноименно заряженные ионы диффузного слоя, которые отталкиваются внутрь гранулы.
3. Когда все х ионов диффузионного слоя перейдут в гранулу, она теряет заряд – происходит сжатие диффузионного слоя до адсорбционного.
4. Состояние золя, когда заряд гранулы равен нулю, называется изоэлектрическим, ИЭС. Это самое неустойчивое состояние золя.
5. Сжатие диффузионного слоя приводит к потере и гидратной оболочки. При этом исчезает расклинивающее давление, происходит коагуляция.
6. Ионы- коагулянты сами входят внутрь гранулы, нейтрализуют её заряд, ускоряя тем самым коагуляцию.
|
из
5.00
|
Обсуждение в статье: Свойства коллоидных растворов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

