 |
Главная |
Коррозийная стойкость металлов
|
из
5.00
|
Лабораторная работа №8
Цель работы: ознакомление с механизмами и скоростями коррозионного разрушения металлов.
1. Методические указания
Коррозионное разрушение металлов – это самопроизвольный переход металла в более устойчивое окисленное состояние под действием окружающей среды. В зависимости от характера окружающей среды различают химическую, электрохимическую и биокоррозию.
Электрохимическая коррозия – наиболее распространенный тип коррозии. Коррозия металлических конструкций в естественных условиях – в море, в земле, в грунтовых водах, под конденсационными или адсорбционными пленками влаги (в атмосферных условиях) носит электрохимический характер. Электрохимическая коррозия ̶ это разрушение металла, сопровождающееся появлением электрического тока в результате работы множества макро- и микрогальванических пар. Механизм электрической коррозии разделяется на два самостоятельных процесса:
1) анодный процесс - переход металла в раствор в виде гидратированных ионов с оставлением эквивалентного количества электроном в металле:
(-)A: Me + mH2O →[Me(H2O)m]1+ + ne
2) катодный процесс ассимиляция избыточных электронов в металле какими-либо деполяризаторами (молекулами или ионами раствора, которые могут восстанавливаться на катоде). При коррозии в нейтральных средах деполяризатором обычно служит коррозии в растворенный в электролите кислород:
(+)K: O2 + 4e +2H2O →4OH¯
При коррозии в кислых средах – ион водорода
(+)K: H·H2O + e → 1/2H2↑+H2O
Макрогальванические пары возникают при контакте различных металлов. При этом металл, имеющий более отрицательный электродный потенциал является анодом и подвергается окислению (коррозии).
Металл, имеющий более положительный потенциал, служит катодом. Он выполняет роль проводника электронов от металла-анода к частицам окружающей среды, способным эти электроны принимать. Согласно теории микропар, причиной электрохимической коррозии металлов является наличие на их поверхности микроскопических короткозамкнутых гальванических элементов, возникающих вследствие неоднородности металла и его контакта с окружающей средой. В отличие от специально изготовленных в технике гальванических элементов они возникают на поверхности металла самопроизвольно. В тонком слое влаги, всегда существующем на поверхности металла, растворяют О2,СО2, SO2 и другие газы из воздуха. Это создает условия для соприкосновения металла с электролитом.
С другой стороны, различные участки поверхности данного металла обладают разными потенциалами. Причины этого многочисленны, например, разность потенциалов между различно обработанными частями поверхности, разными структурными составляющими сплава, примесями и основным металлом.
Участки поверхности образна с более отрицательным потенциалом становятся анодами и растворяются (корродируют) (рис 1.1).
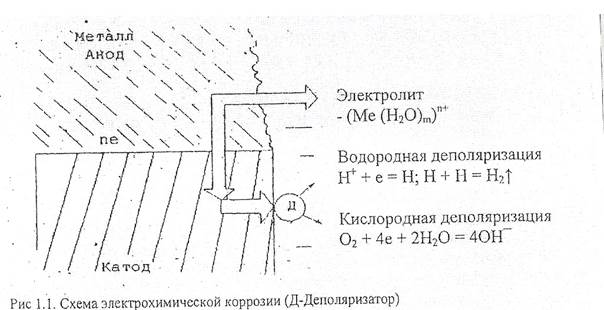
Часть освободившихся электронов перейдет с анода на катод. Поляризация электродов, однако, препятствует коррозии, так как электроны, оставшиеся на аноде, образуют с перешедшими в раствор положительными ионами двойной электрический слой, растворение металла прекращается. Следовательно, электрическая коррозия может протекать, если электроны с анодных участков постоянно отводятся на катоде, а затем удаляются, с катодных участков. Процесс отвода электронов с катодных участков называется деполяризацией, а вещества или ионы, вызывающие деполяризацию называются деполяризаторами. Если имеется контакт какого-либо металла со сплавом, сплав приобретает потенциал, соответствующий потенциалу наиболее отрицательного металла, входящего в его состав. При, контакте латуни (сплав меди с цинком) с железом корродировать станет латунь (за счет наличия в ней цинка). При перемене среды электродный потенциал у отдельных металлов может резко меняться. Хром, никель, титан, алюминий, и другие металлы нормальный электродный потенциал которых резко отрицателен, в обычных атмосферных условиях сильно пассивируется, покрываются оксидной пленкой, вследствие чего их потенциал становится положительным. В атмосферных условиях и пресной воде будет работать следующий гальванический элемент:

 e
e
(-)Fe | H2O, O2 | Al2O3(Al)+
(-)A: 2Fe – 4e = 2Fe2+
(+)K: O2 + 4e + 2H2O = 4OH¯
В итоге: 2Fe2 + 4OH¯ = 2Fe(OH)2
4Fe(OH)2 + O2 + 2H2O = 2Fe(OH)3
Однако в кислой, щелочной среде или в нейтральной, содержащей ионы хлора (например, в морской воде), разрушающие оксидную пленку, алюминий в контакте с железом становится анодом и подвергается коррозионному процессу. В растворе NaCl и морской воде будет работать следующий гальванический элемент:

 е
е
| |
 (-)Al | H2O, O2, NaCl | Fe(+)
(-)Al | H2O, O2, NaCl | Fe(+)
(-)A: Al – 3e = Al3+
(+)K: O2 +4e + 2H2O = 4OH¯
4Al3 + 12OH¯ = 4Al(OH)3
Очень часто электрохимическая коррозия возникает в результате различной аэрации, то есть неодинакового доступа кислорода воздуха к отдельным участкам поверхности металла. На рис.1.2. изображен случай коррозии железа и каплей волы. Около краев капли, куда кислороду проникнуть легче, возникают катодные участки, а в центре, где толщина защитного слоя воды больше и кислороду проникнуть труднее анодный участок.

На возникновение коррозиционных гальванических элементов оказывает влияние различие в концентрации растворенного электролита, различие температур и освещенности и другие физические условия.
Защита от коррозии
Причины, вызывающие коррозионное разрушение металлов многочисленны. Разнообразны и методы защиты от коррозии:
обработка внешней среды;
защитные покрытия;
электрохимическая защита;
изготовление специально коррозионно-устойчивых сплавов.
Обработка внешней среды заключается в удалении или понижении активности некоторых, находящихся в ней веществ, вызывающих коррозию. Например, удаление растворенного в йоде кислорода (деаэрация) Иногда в раствор добавляют специальные замедляющее коррозию вещества, которые называются замедлителями или ИHГИБИТОРАМИ (уротропин, тиoмочевина, анилин и другие).
Детали, подвергающиеся защите в атмосферных условиях, помещаются вместе с ингибиторами в контейнер или обертываются бумагой, внутренний слои, которой пропитан ингибитором, а наружный, парафином. Ингибитор, испаряясь, адсорбируется на поверхности детали, обусловливая торможение электродных процессов.
Роль защитных покрытий сводится к изоляции металла от воздействия защитных внешней среды. Это достигается нанесением на поверхность металла лаков, красок, металлических покрытий.
Металлические покрытия делятся на анодные и катодные. В случае АНОДНОГО покрытия электродный потенциал покрывающего металла более отрицателен, чем потенциал защищенного металла. В случае КАТОДНОГО покрытия электродный потенциал покрывающего металла более положителен, чем потенциал основного металла.
Пока защитный слой полностью изолирует основной металл воздействия от окружающей среды, принципиального различия между анодным и катодный покрытием нет. При нарушении же целостности покрытия возникают новые условия. Катодное покрытие, например олово на железе, не только перестает защищать основной металл, но и усиливает своим присутствием коррозию железа (в возникшем гальваническом элементе железо является анодом).
При электрохимической защите уменьшение или полное прекращение коррозия достигается созданием на защищаемом металлическом изделии высокого электроотрицательного потенциала. Для этого защищаемое, изделие или соединяют с металлом, имеющим более отрицательный электродный потенциал, способным легче отдавать электроны (протекторная защита) или с отрицательным полюсом внешнего источника тока (катодная электрозащита).

Анодное покрытие, например цинк на железе, наоборот, при нарушении целостности покрывающего слоя будет само подвергаться разрушению, защищая тем самым основной металл от коррозии (в возникшем гальваническом элементе цинк является анодом).


Изготовление специальных коррозийно-устойчивых сплавов, нержавеющих сталей и т.д. сводится к введению в них добавок различных металлов.
Эти добавки оказывают влияние на микроструктуру сплава и способствуют возникновению в нем таких микрогальванических элементов, у которых суммарная ЭДС вследствие взаимной компенсации приближается к нулю. Такими полезными добавками, особенно для стали, являются хром, никель и другие металлы.
1. Выполнение работы
Задание 1
Проведение качественных химических, реакций позволяющих обнаружить ионы металла, перешедших при анодном процессе коррозии в раствор.
Приборы и реактивы: растворы ZnSO4, FeSO4 и K3[Fe(CN)6], набор пробирок.
Ход работы: Налить в пробирки 1-2 мл раствора солей:
а) ZnSO4 и несколько капель K3 [Fe(CN)6];
б) FeSO и несколько капель K3 [Fe(CN)6].
Отметить выпадающих осадков. Написать соответствующие реакции в молекулярном и ионном виде.
Задание 2
Изучение механизма коррозии металла при непосредственном контакте в нейтральной среде.
Опыт, проводится на установке, изображенной на рис. 1.7

В U-образную трубку налить 5-10 мл водного раствора NaCl. В него опускаются пластины металлов, соединенные между собой при помощи зажимов.
Пластинки металлов должны быть тщательно зачищены наждачной шкуркой, а место контакта пластинки и зажима находятся вне раствора. При выполнении опыта необходимо отметить изменение окраски раствора у катода и анода.
Написать:
1) анодные и катодные процессы коррозии
2) соответствующие реакции, при помощи которых был обнаружен ион металла в растворе
3) схему гальванического элемента.
1. опускаются пластины Zn и Fe.
В раствор, где находится цинковый электрод, добавить несколько капель K3 [Fe(CN)6] , где находится железный электрод, несколько капель фенолфталеина.
2. Опускаются пластины Fe и Cu,
В раствор где находится железный электрод, добавить несколько капель K3 [Fe(CN)6], где находится медный электрод, несколько капель фенолфталeина.
Сравнить поведение железа в том и другом случае, делать соответствующие выводы.
Задание 3
Изучение механизма коррозии металлов при их непосредственном контакте в кислой среде.
Опыт произвести на установке, изображенной на рис 1.8.
В фарфоровую чашечку налить 10% раствор НСl. В раствор опустить два метала Аl и Си, и наблюдать за поведением металлов. У какого металла выделяются пузырьки водорода? Написать соответствующие реакции. Привести чти металлы в контакт друг с другом. На каком металле выделяются пузырьки водорода при контакте металлов? Составить схему гальванического элемента и электродные процессы на его электродах. Написать суммарное уравнение реакции.

3. Примеры решения задач
Пример 1
Рассмотрим коррозионный процесс при контакте железа со свинцом в растворе HCl
В растворе электролита (HCl) эта система представляет собой гальванический элемент, во внутренней цепи которого Fe является анодом (E°=0.1260). атомы железа, передавая по два электрона свинцу переходят в раствор в виде ионов. Электроны же на свинце, восстанавливают ионы водорода, находящиеся в растворе, т.к.
HCl = H+ + Cl¯
Анодный процесс Fe0 – 2e = Fe 2+
Катодный процесс 2H+ + 2e = 2H0
Пример 2
Коррозионный процесс при контакте Fe c Ph в растворе NaCl. Так как раствор NaCl имеет нейтральную реакцию (соль, образована сильным основанием и сильной кислотой), то
Анодный процесс Fe – 2e = Fe2+,
Катодный процесс O2 + 4e + 2H2O = 4OH¯
Хлористый натрий (NaCl) в коррозионных процессах не участвует, он показан в схеме только как вещество, способное увеличить электропроводность раствора электролита.
Пример 3
Почему химически чистое железо является более стойким против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии технического железа.
Решение
Процесс коррозии технического железа ускоряется ввиду образования в нем микро и субмикрогальванических элементов. В микрогальванических парах в качестве анода, как правило, служит основной металл, т.е. железо. Катодами являются включения в металл, например, зерна графита, цемента. На анодных участках ионы металла переходят в раствор (окисление).
A: Fe – 2e = Fe2+
На катодных участках электроны, перешедшие сюда с анодных участков, связываются либо кислородом воздуха, растворенным в воде, либо ионами водорода. В нейтральных средах происходит, кислородная деполяризация:
K: O2 + 4e + 2H2O = 4OH¯
В кислых средах (высокая концентрация H – ионов ) вородная деполяризация
K: 2H+ + 2e = 2H0
Пример 4
Назовите, катодным, или анодным является цинковое и покрытие на железном изделии? Какие процессы будут протекать, если целостность покрытия нарушится, и изделие будет находиться во влажном воздухе?
Решение
Электродный потенциал цинка по своей алгебраической величине ниже, чем электродный потенциал железа, поэтому покрытие является анодным. В случае нарушения целостности слоя цинка образуется коррозионная гальванопара, в которой цинк будет анодом, а железо катодом. Анодный процесс заключается в окислении цинка:
Zn2+ + 2OH = Zn(OH)2
Катодный процесс протекает на железе. Во влажном воздухе происходит преимущественно кислородная деполяризация.
K(Fe): O2 + 4e + 2H2O = 4OH¯
Пример 5
Кадмиевая и никелевая пластины, будучи погружены в разбавленную серную кислоту, растворяются в ней с выделением водорода. Что изменится, если опустить их обе одновременно в сосуд с кислотой, соединив концы проволокой?
Решение
Если соединить концы кадмиевой и никелевой пластин проволокой, образуется кадмий, никелевый гальванический элемент, в котором кадмий, как более активный металл, является анодом. Кадмий будет окисляться:
A:Cd – 2e = Cd2+,
Избыточные электроны перейдут на никелевую пластину, где будет происходить процесс восстановления ионов водорода:
K(Ni): 2H + 2e =2H0 .
Таким образом, растворению подвергаются только кадмий, никель станет только проводником электронов и сам растворяться не будет. Водород будет выделяться только на никелевой пластине.
Пример 6
Как влияет PH среды на скорость коррозии алюминия?
Решение
Уменьшение PH среды, т.е. увеличение концентрации H-ионов резко увеличивает скорость коррозии никеля, - так как кислая среда препятствует образованию защитных пленок гидроксида никеля, в кислой среде происходит активное окисление никеля
A: Ni – 2e = Ni2+
Снижение концентрации H-ионов, т.е. повышение концентрации OH, способствует образованию слоя гидроксида никеля:
Ni2+ - 2OH¯ = NI(OH)2
Гидроксид алюминия обладает амфотерными свойствами, т.е. растворяется в кислотах и щелочах:
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + NaOH = Na AlO2 + 2H2O
Более точно эта реакция протекает так:
Al(OH)3 + NaOH = Na[Al(OH)4]
Таким образом, наименьшая скорость коррозии никеля в щелочной среде, алюминия – в нейтральной.
4. Задачи
1. Железная пластинка, погруженная в соляную кислоту, очень медленно выделяет водород, но если прикоснуться к ней цинковой проволокой, то она тотчас же покрывается пузырьками водорода. Объясните это явление. Какой металл переходит при этом в раствор?
2. В железном изделии имеются детали, изготовленные из никеля. Как это отразится на коррозии железа? Напишите соответствующие анодные и катодные процессы, если изделие находится во влажной атмосфере.
3. В какой среде скорость разрушения железа больше? Какая среда способствует анодному окислению цинка? Написать соответствующие реакции.
4. Как происходит атмосферная коррозия луженого железа и луженой меди при нарушении цельности покрытия? Составьте электронные уравнения анодного и катодного процессов.
5. Медь не вытесняет водород из разбавленных кислот. Почему? Однако, если к медной пластинке прикоснуться цинковой, то на меди начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения катодного и анодного процессов.
6. В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Составьте электронные уравнения катодного и анодного процессов.
7. Что может произойти, если изделие, в котором техническое железо находится в контакте с медью, оставить и воздухе при повышенной влажности? Напишите уравнения соответствующих процессов.
8. Алюминий склепан с железом. Какой из металлов будет подвергаться коррозии? Какие процессы будут протекать, если изделие попадет в морскую воду?
9. Почему при контактировании железных изделий с алюминиевыми – железные изделия подвергаются более интенсивной коррозии, хотя алюминий имеет более отрицательный стандартный электродный потенциал?
10. Железные пластинки опущены:
а) в дистиллированную воду
б) в морскую воду
В каком случае процесс коррозии протекает интенсивнее? Ответ мотивируйте.
11. Составьте уравнения процессов, происходящих при коррозии алюминия, погруженного в раствор:
а) кислоты
б) щелочи
12. Почему технический цинк взаимодействует с кислотой более интенсивно, чем химически чистый цинк?
13. В раствор электролита опущена пластинка:
а) меди
б) меди, частично покрытой оловом
в каком случае процесс коррозии протекает интенсивнее?
Ответ мотивируйте
14. Почему при никелировании железных изделий их покрывают сначала медью, а потом никелем?
Составьте электронные уравнения реакций, происходящих в процессах коррозии при повреждении никелевого покрытия.
15. Железное изделие покрыли кадмием. Какое это покрытие – анодное или катодное?
Ответ мотивируйте. Какой металл будет коррозировать при повреждении защитного слоя? Составьте электронные уравнения соответствующих процессов (среда нейтральная).
16. Какой из металлов:
а) олово
б) кобальт
в) магний
может быть протектором к сплаву на основе железа. Составьте электронные уравнения соответствующих процессов (среда кислая).
17. Какие процессы будут происходить на цинковой и железной пластинах, если погрузить каждую в отдельности в раствор медного купороса? Какие процессы произойдут, если наружные концы, находящиеся в растворе пластинок, соединить проводником? Составьте электронные уравнения
18. Алюминиевая пластина опущена
а) в дистиллированную воду
б) в раствор хлористого натрия
в каком случае процесс коррозии протекает интенсивнее? Составьте уравнения анодного и катодного процессов коррозии технического алюминия в нейтральной среде.
19. Если гвоздь вбить во влажное дерево, то ржавчиной покрывается та часть, которая находится внутри дерева. Чем это объяснить? Анодом или катодом является эта часть гвоздя?
20. В последнее время кобальтом стали покрывать другие металлы для защиты от коррозии. Анодным или катодным является кобальтовое покрытие стали? Какие процессы протекают во влажном воздухе при нарушении целостности покрытия?
|
из
5.00
|
Обсуждение в статье: Коррозийная стойкость металлов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

