 |
Главная |
Получение ацетиленаминов
|
из
5.00
|

Реакция идет в присутствии солей меди (I).
Реакции электрофильного присоединения]
Электрофильное присоединение к алкинам инициируется под воздействием положительно заряженной частицы — электрофила. В общем случае, катализатором таких реакций являются кислоты.
Общая схема первой стадии реакции электрофильного присоединения:

Реакции галогенирования
Алкины способны присоединять одну или две молекулы галогена с образованием соответствующих галогенпроизводных:


Галогенирование алкинов идет как транс-присоединение (как правило) и протекает по аналогии с галогенированием алкенов.
Вместе с тем, присоединение по тройной связи идет труднее, чем по двойной, в связи с чем при наличии в соединении как двойной, так и тройной связи, возможно провести избирательное присоединение:

Реакции гидрогалогенирования
Присоединение хлороводорода и бромоводорода к алкинам происходит по аналогии с алкенами. Реакция идет в две стадии: сперва образуется галогеналкен, который далее переходит в дигалогеналкан:

Несмотря на бо́льшую электроотрицательность галогенов, обе стадии реакции идут по правилу Марковникова. Это объясняется возникновением p-сопряжения между атомами галогена и водорода. Как видно из схемы, в результате реакции присоединения образуются транс- изомеры.
Гидратация
В присутствии солей ртути алкины присоединяют воду с образованием ацетальдегида (для ацетилена) или кетона (для прочих алкинов). Эта реакция известна какреакция Кучерова.
Считается, что процесс гидратации идет через стадию образования енола:

Реакции карбонилирования[править | править вики-текст]
Реакция карбонилирования были открыты в лаборатории Реппе в 1939 году[20].

где Х: ОН, OR, OCOR, NH2 и пр.


Катализатором реакции являются карбонилы никеля или палладия[22].
Отдельно стоит упомянуть реакцию оксилительного карбохлорирования:

Прочие реакции электрофильного присоединения
1. Присоединение карбоновых кислот с образованием диэфиров:

Уксусная кислота в реакции с ацетиленом образует винилацетат:

Ацетиленовые углеводороды присоединяют CO2 и вторичные амины с образованием амидов:

1. Реакция ацетилена с цианистым водородом в присутствии солей одновалентной меди с получением акрилонитрила:

1. Ацетилен способен в присутствии катализаторов присоединять углеводороды с образованием новых С-С связей[20]:

или

Реакции нуклеофильного присоединения]
Нуклеофильное присоединение к алкинам инициируется под воздействием отрицательно заряженной частицы — нуклеофила. В общем случае, катализатором таких реакций являются основания. Общая схема первой стадии реакции нуклеофильного присоединения:

Типовые реакции нуклеофильного присоединения
1. Характерным примером реакции нуклеофильного присоединения является Реакция Фаворского — присоединение спиртов в присутствии щелочей с образованием алкенильных эфиров:

1. Первичные амины под действием оснований присоединяются к алкинам с образованием иминов[23]:

По аналогии ацетилен реагирует с аммиаком, образуя этилиденимин[20]:

При высокой температуре в присутствии катализатора имин дегидрируется и превращается в ацетонитрил:

1. В среде очень сильных оснований (например: КОН+ДМСО) ацетилен реагирует с сероводородом, образуя дивинилсульфид[20]:

Реакции радикального присоединения
В присутствии перекисей или других условиях, способствующих образованию свободных радикалов, присоединение к алкинам идет по радикальному механизму — против правила Марковникова (эффект Караша):

По свободнорадикальному механизму* может протекать реакция алкинов с тиолами:

* — В присутствии оснований реакция идет по нуклеофильному механизму.
Аналогично происходит присоединение карбенов:

Реакции этинилирования
Реакциями этинилирования называют реакции увеличения углеродного скелета алкинов с сохранением тройной связи. Они могут протекать как по электрофильному, так и нуклеофильному механизму в зависимости от среды и условий реакции, характера субстрата, а также типа используемого катализатора.
Получение ацетиленовых спиртов]
В присутствии сильных оснований алкины с концевой тройной связью способны присоединять карбонильные соединения с образованием спиртов[14] (Реакция Фаворского):

Важнейшей реакцией из этой группы является присоединения формальдегида к ацетилену с образованием пропаргилового спирта и далее бутин-2-диола-1,4*:


* Бутин-2-диол-1,4 является важным промежуточным полупродуктом для получения бутиленгликоля, γ-Бутиролактона, изопрена и тетрагидрофурана.
Эту реакцию разработал в 1925 году Реппе (Реакция Фаворского-Реппе). Она протекает при высоком давлении в присутствии ацетиленида меди.
Получение ацетиленовых эфиров и кислот
Ацетиленовые кислоты или их эфиры можно получить по реакции Цужи[20]:
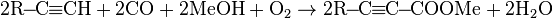
Катализаторы: PdCl2, CuCl.
Реакции гидрирования[]
Гетерогенное гидрирование
Гидрирование алкинов водородом на гетерогенных катализаторах, как правило, приводит к образованию цис-присоединения[6]. Катализаторами гидрирования служатNi, Pd, Pt, а также оксиды или комплексы Ir, Ru, Rh и некоторых других металлов.
На первой стадии образуется алкен, который практически сразу же гидрируется до алкана:

Для остановки реакции на стадии получения алкена используют катализаторы Линдлара (Pd/PbO/CaCO3) или борид никеля.
При гидрировании ацетилена на никель-кобальтовом катализаторе можно получить изобутилен:

Гомогенное гидрирование
Гомогенное гидрирование проводят с амидом натрия в жидком аммиаке или алюмогидридом лития в тетрагидрофуране. В ходе реакции образуются транс-алкены.

Гидроборирование
Алкины легко присоединяют диборан против правила Марковникова, образуя цис-алкенилбораны:

Реакция интересна тем, что далее алкенилбораны легко перевести в соответствующие цис-алкены простым действием уксусной кислоты[18]:

или окислить H2O2 до альдегида или кетона[18]:

Восстановительное карбоксилирование
По аналогии с реакциями алкенов, алкины вступают в реакцию восстановительного карбоксилирования. В зависимости от условий реакции и типов катализаторов, конечными продуктами могут стать спирты, альдегиды или алканы:


Реакции окисления
Реакции окислительного присоединения
Алкины окисляются более трудно чем алкены, однако при контролируемом окислении можно сохранить C-C связь и получить в качестве продуктов реакции карбонильные соединения[16]:

В качестве окислителя может выступать озон (с последующим восстановлением и гидролизом озонида), KMnO4 в слабощелочной или нейтральной среде и некоторые другие вещества[16].
Ацетилен, в зависимости от окислителя может давать три продукта:
 (глиоксаль) — окисление разбавленной HNO3 в присутствии PdCl2 и NaNO2[20].
(глиоксаль) — окисление разбавленной HNO3 в присутствии PdCl2 и NaNO2[20].
 (глиоксалевая кислота) — окисление KClO3 в субстрате вода+диэтиловый эфир[16].
(глиоксалевая кислота) — окисление KClO3 в субстрате вода+диэтиловый эфир[16].
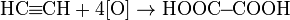 (щавелевая кислота) — окисление KMnO4 в кислой среде или HNO3 в присутствии PdCl2.
(щавелевая кислота) — окисление KMnO4 в кислой среде или HNO3 в присутствии PdCl2.
Отдельный тип реакций — реакции окислительного карбоксилирования.
В растворах комплексов палладия образуются эфиры малеиновой кислоты:
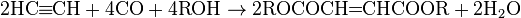
Реакции окислительного расщепления
При действии сильных окислителей в жестких условиях алкины окисляются с разрывом тройной связи. В ходе реакции образуются карбоновые кислоты и CO2:


Реакции окислительного сочетания
В присутствии солей одновалентной меди в спиртовом растворе аммиака алкины окисляются кислородом воздуха до диацетиленов (Реакция Глазера):

Реакция для ацетилена может идти c образованием полиинов:

Эта реакция легла в основу синтеза карбина[24].
Применение
Из всех ацетиленовых углеводородов серьёзное промышленное значение имеет только ацетилен, который является важнейшим химическим сырьём.
Ацетилен используют для синтеза следующих продуктов:
1. тетрахлорэтан, трихлорэтилен, дихлорэтилен (хлорирование ацетилена) — растворители;
2. акрилонитрил (конденсация ацетилена с циановодородом) — для получения полиакрилонитрила;
3. акриламид (конденсация ацетилена с CO и аммиаком) — для получения полиакриламида;
4. тетрагидрофуран (конденсация ацетилена с формальдегидом с последующим гидрированием и дегидратацией) — важный растворитель, сырье для уретановых полимеров;
5. винилхлорид (гидрохлорирование ацетилена) — для получения поливинилхлорида;
6. винилацетат (конденсация с уксусной кислотой) — для получения поливинилацетата;
7. ацетальдегид (гидратация ацетилена) — для дальнейшего получения уксусной кислоты, ацетона и др. продуктов;
8. бутиленгликоль (конденсация ацетилена с формальдегидом с последующим гидрированием) — для получения полиуретанов, полиэфиров, пластификаторов.
9. винилацетилен (димеризация ацетилена) — полупродукт для синтеза полимеров;
10. хлоропрен (гидрохлорирование винилацетилена) — для получения хлоропреновых каучуков;
11. бутадиен (дегидратация бутиленгликоля) — для получения бутадиеновых каучуков;
При горении ацетилена выделяется много тепла, что используется для резки и сварки металлов в ацетилен-кислородной сварке (расходуется до 30 % всего производимого ацетилена)[13].
В конце 19-го — начале 20-го века широкой популярностью пользовались многочисленные ацетиленовые светильники (источником ацетилена служил дешевый карбид кальция), используемые на железнодорожном и водном транспорте, для освещения улиц, в быту[31]. Несмотря на то, что сегодня массовое использование ацетиленовых фонарей ушло в прошлое, их выпуск и потребление не прекратились. Они производятся в небольших количествах как походное снаряжение
1.
|
из
5.00
|
Обсуждение в статье: Получение ацетиленаминов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

