 |
Главная |
Типовые примеры решения задач
|
из
5.00
|
Департамент образования Ярославской области
Государственное образовательное учреждение
Среднего профессионального образования
Ростов – Ярославский сельскохозяйственный техникум
Внеаудиторная самостоятельная работа по химии
Ростов, 2015
| СОГЛАСОВАНО на заседании ПЦК общеобразовательных дисциплин Протокол №____ от ________20___г. Председатель ЦК_______________ | УТВЕРЖДАЮ Зам. директора по УР _____________________ ____ ____________20___г. |
Разработчик: Краснова Ирина Анатольевна - преподаватель
Указания к выполнению
При выполнении работы следует:
1.Написать номер темы и ее название, номер вашего варианта (по списку в журнале)
Оформление внеаудиторной самостоятельной работы
Самостоятельная работа должна быть набрана на компьютере
(сообщения) и распечатана на принтере, а задачи в рукописном варианте, но на формате А - 4 , вложена в папку и сдана на проверку.
Стиль оформления основного текста самостоятельной работы (сообщения) должен содержать следующие установки:
Шрифт – кегль 14, гарнитура «Times New Roman».
Межстрочный интервал –1.
Интервал между словами – 1 знак.
Абзацный отступ – 1,25.
Выравнивание – по ширине.
Перенос автоматический «Сервис – Язык - Расстановка переносов».
Нумерация страниц располагается внизу по центру страницы.
Формат страницы - А4 (210Х297 мм).
Поля верхнее - 25 мм; нижнее - 25 мм; левое - 25мм; правое - 25мм.
Заголовки разделов и пунктов самостоятельной работы не должны быть оторваны от текста и находиться внизу страницы.
Таблицы должны быть расположены правильно: без «разрывов», без отрыва «шапки» таблицы от самой таблицы; при переносе таблицы на следующую страницу «шапку» нужно повторить и добавить над ней слова «Продолжение табл.…» («Окончание табл.…»).
Размер кегля внутри таблиц – 12 пт., минимальный размер кегля внутри таблицы (только при необходимости) -11.
Текст работы может быть дополнен иллюстрациями, таблицами и схемами. Обязательно должен быть приведен список использованной литературы по правилам библиографического описания и содержать следующие элементы: фамилия и инициалы автора, наименование, место издания работы, издательство, год издания, количество страниц.
Например:
1. Колчков В. И. Метрология, стандартизация и сертификация. Учебник для студентов образовательных учреждений среднего профессионального образования. Гриф МО РФ. М.:Владос 2010.-400 с.
Группировка литературы может быть алфавитная, систематическая, хронологическая, по видам источников.
Титульный лист самостоятельной работы оформляется в соответствии с предложенным образцом в приложение 1. Обязательна нумерация страниц. Первой считается титульный лист, на котором номер страницы не ставится. Личная подпись и дата выполнения – обязательны.
2. Указать тему сообщения. Сообщения должны быть небольшими и конкретными. Сообщения для всех вариантов одинаковые.
3. Условие задач из своего варианта необходимо списывать.
Например:
Тема 1.1. Основные понятия и законы
Вариант №3
1. Аллотропные модификации углерода (алмаз, графит), кислорода (кислород, озон), олова (серое и белое олово).
.
.
.
.
2. Понятие о химической технологии, биотехнологии и нанотехнологии.
.
.
.
Задача 1. Вычислите относительную молекулярную массу гидроксида железа (III).
Дано: Решение:
Найти:
Ответ:
Задача 2. Рассчитайте массовую долю (%) для первого элемента в веществе NH3.
Дано: Решение:
Найти :
Ответ:
Задача 3. Какова масса нитрата меди, образующегося при взаимодействии оксида меди(II) массой 4г с азотной кислотой?
Дано: Решение:
Найти :
Ответ:
4. Выполненная работа сдается преподавателю на следующее занятие.
РАЗДЕЛ 1. ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ
Тема 1.1. Основные понятия и законы
Типовые примеры решения задач
Пример 1. Вычислите относительную молекулярную массу серной кислоты, химическая формула которой Н2SO4.
Решение. Для вычисления относительной молекулярной массы необходимо суммировать относительные атомные массы элементов (их взять из периодической таблицы Д.И.Менделеева), образующих соединение с учетом числа атомов:
Мr (Н2SO4)= 1×2+32+16×4=98
Пример 2. Вычислите массовую долю кислорода в SО3.
Решение. Массовая доля элемента в веществе (w) показывает, какую часть относительной молекулярной массы вещества составляет относительная атомная масса элемента, умноженная на индекс (n) при знаке элемента в формуле. Массовая доля – величина безразмерная. Выражается в долях от единицы или в процентах.
1. Вычисляем относительную молекулярную массу SО3:
Мr (SO3)= 32+16×3=80
2. Вычисляем массовую долю кислорода.
Относительная атомная масса кислорода из периодической таблицы Д.И.Менделеева Аr(О) =16
Составим пропорцию: Мr (SO3) 80 - 100%

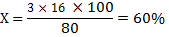
w(О)=60%
|
из
5.00
|
Обсуждение в статье: Типовые примеры решения задач |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

