 |
Главная |
Одноосновные карбоновые кислоты и их производные
|
из
5.00
|
Классификация карбоновых кислот по основности и строению углеводородного радикала.
Одноосновные кислоты. Изомерия. Номенклатура. Ацильные радикалы. Природа карбоксильной группы. Способы получения кислот: окислением первичных спиртов и альдегидов, из галогенопроизводных через стадию образования нитрилов и металлорганических соединений, промышленные методы получения карбоновых кислот окислением алканов, оксосинтезом. Получение ароматических кислот окислением алкинаренов.
Физические свойства.
Химические свойства. Общая характеристика. Кислотность. Образование солей. Получение и свойства функциональных производных кислот: галогенангидридов, ангидридов, сложных эфиров, амидов и нитрилов. Механизм реакции этерификации. Понятие о пространственных затруднениях при этерификации ароматических кислот.
Галогенозамещенные кислоты. Индуктивный эффект и сила кислот.
Высшие жирные кислоты. Мыла.
Непредельные одноосновные кислоты. Акриловая и метакриловая кислоты, их эфиры и нитрилы. Технические методы получения и применение. Полимеризация и сополимеризация. Кротоновая и олеиновая кислоты. Их цис-транс-изомерия. Коричная кислота.
Понятие о кислотах с несколькими двойными связями: сорбиновая, линолевая, линоленовая и арахидоновая кислоты.
Методические указания
В органических (карбоновых) кислотах присутствует карбоксильная группа, которая является носителем кислотных свойств. Кислотные свойства обусловлены эффектом сопряжения неподеленных электронов атома кислорода ОН-группы с π-электронами карбонильной группы и диссоциация кислот выражается уравнением:
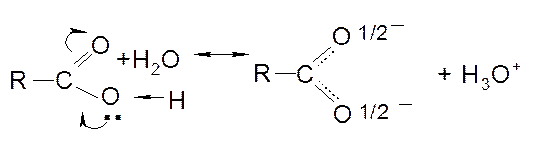
Следует отметить, что в карбоксилат-анионе оба атома кислорода несут по половинному отрицательному заряду длины связей С ---О равны 1,27 Å. Алкановые кислоты – слабые кислоты. Введение электроноакцепторных заместителей в алкильный радикал увеличивает силу кислот.
Важнейшие превращения карбоновых кислот связаны или с изменением в карбоксильной группе (получение производных карбоновых кислот), или с изменениями углеводородного радикала (получение замещенных карбоновых кислот по α-углеродному атому). Для кислот рассмотрите реакции получения солей, галогенангидридов, сложных эфиров, ангидридов кислот, амидов и нитрилов кислот. В случае непредельных карбоновых кислот и их производных обратите внимание на их применение в качестве мономеров.
Вопросы для самопроверки
1. Расположите в ряд по увеличению кислотности следующие кислоты: уксусную, муравьиную, хлоруксусную и трихлоруксусную. Дайте пояснение.
2. Получите для пропановой кислоты следующие производные: амид, галогенангидрид, сложный эфир и нитрил.
3. Напишите уравнения реакций взаимодействия уксусного ангидрида с пропанолом-2, аммиаком и водным раствором гидроксида калия.
4. Что такое фруктовые эссенции, как их получают и где они применяются? Напишите уравнение реакции получения изоамилацетата (грушевой эссенции).
Двухосновные карбоновые кислоты и их производные
Классификация. Номенклатура. Особенности физических и химических свойств. Щавелевая, малоновая, янтарная и адипиновая кислоты; их получение, свойства, применение. Малоновый эфир и его использование в реакциях органического синтеза. Понятие о непредельных двухосновных кислотах, малеиновая и фумаровая кислоты, их свойства и взаимные переходы. Фталевая и терефталевая кислоты. Синтетическое волокно «лавсан».
Методические указания
Наличие двух карбоксильных групп предопределяет возможность образования двух видов производных: по одной или обеим карбоксильным группам. В щавелевой кислоте следует обратить внимание на большое различие в константах диссоциации первой и второй карбоксильной групп (Ка1=5,9·10-2 и Ка2=6,4·10-5), что объясняется сильным индуктивным взаимным влиянием обоих карбоксилов, увеличивающим первую константу диссоциации. В малоновой кислоте в отличие от других кислот присутствует дополнительный реакционный центр – метиленовая – СН2 – группа, атомы водорода которой обладают большой подвижностью (протонизированы). Эта особенность нашла широкое применение в синтезе – синтезы с малоновым эфиром. При изучении непредельных дикарбоновых кислот – фумаровой и малеиновой – необходимо вспомнить геометрическую изомерию.
Вопросы для самопроверки
1. Получите средние и кислые соли щавелевой кислоты (оксалаты), где они встречаются в природе?
2. Напишите уравнение реакции синтеза масляной кислоты исходя из малонового эфира, рассмотрите строение натриймалонового эфира.
3. Сравните кислотные свойства уксусной, щавелевой и малоновой кислот. Электронные эффекты обозначьте стрелками.
4. Напишите уравнение реакции гидратации фумаровой кислоты, а из малеиновой кислоты получите ее ангидрид.
Липиды
Классификация. Простые липиды. Жиры и масла. Основные физико-химические характеристики. Омыление, переэтерификацня и гидрогенизация жиров. Понятие о прогоркании жиров. Окислительная порча жиров. Саломас, маргарин. Понятие о фосфолипидах.
Методические указания
В органической химии к липидам (от греч. lipos – жир) относят совокупность веществ, нерастворимых в воде, экстрагируемых из биологических объектов органическими растворителями и содержащих в молекулах высшие алкильные радикалы. По способности к гидролизу липиды подразделяют на омыляемые и неомыляемые, а по составу и химическому строению их делят на простые и сложные. Мы будем изучать «жиры» – сложные эфиры глицерина и высших алкановых кислот и растительные «масла» – сложные эфиры глицерина и высших непредельных карбоновых кислот. Рассмотрите связь строения и консистенции жиров.
Химические свойства глицеридов обусловлены их сложноэфирным строением – реакции гидролиза, омыления, переэтерификации и др., а также наличием углеводородных радикалов – реакции окисления, присоединения и др. Следует отметить, что благодаря такому строению жиры, растительные масла и жиросодержащие продукты при хранении портятся, прогоркают, т.е. происходит гидролитическое и окислительное прогоркание.
Вопросы для самопроверки
1. Чем отличаются по составу и строению твердые жиры от растительных масел. Напишите реакцию гидрогенизации трилинолеата глицерина.
2. Напишите уравнение реакции омыления и переэтерификации с этанолом (1 моль) для тристеарата глицерина.
3. Напишите уравнения реакций 1,2-диолеата-3-линолеата глицерина с а) иодом; б) бромводородом; в) щелочным раствором КMnО4.
Амины
Строение, изомерия, классификация. Первичные, вторичные и третичные амины.
Получение аминов из галогенопроизводных, амидов кислот, восстановлением нитросоединений, нитрилов и изонитрилов. Значение реакции Зинина для развития промышленности органического синтеза.
Физические свойства аминов.
Химические свойства. Основность аминов. Образование солей, алкилирование, ацилирование, действие азотистой кислоты. Четвертичные аммониевые основания и соли. Галогенирование, нитрование и сульфирование ароматических аминов.
Понятие о диаминах. Получение синтетического волокна «нейлон».
Значение аминов в промышленности.
Методические указания
Амины можно рассматривать как аммиак, в котором один, два или три атома водорода водорода замещены на алкильные или арильные радикалы.
Соответственно различают первичные, вторичные и третичные амины, а также алифатические и ароматические амины.
Подобно аммиаку амины обладают основным характером, что обусловлено наличием неподеленной пары электронов у атома азота.
Следует отметить, что алкиламины более сильные основания, а ароматические амины более слабые основания, чем аммиак. Это объясняется повышением электронной плотности на атоме азота за счет электронодонорных свойств алкильных радикалов (+I-эффект) и уменьшением ее за счет электроноакцепторных свойств бензольного кольца (–М-эффект). Так, трифениламин основными свойствами практически не обладает. В свою очередь, аминогруппа – сильный электронодонорный заместитель, повышающий электронную плотность в ядре бензола, особенно в орто- и пара-положениях, облегчает введение заместителей в реакциях электрофильного замещения. Так, бромирование анилина происходит легко даже при действии бромной воды с образованием триброманилина.
Вопросы для самопроверки
1. Сравните свойства метиламина, триметиламина анилина и дифениламина как оснований. Электронные эффекты обозначьте стрелками.
2. Напишите уравнения реакций взаимодействия этиламина с соляной кислотой, азотистой кислотой, иодистым этилом и хлористым ацетилом.
3. Напишите структурные формулы всех аминов состава С3Н9N, назовите их и укажите первичные, вторичные и третичные амины.
|
из
5.00
|
Обсуждение в статье: Одноосновные карбоновые кислоты и их производные |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

