 |
Главная |
Тема 5: Термодинамика и кинетика химических превращений
|
из
5.00
|
Термодинамика – наука о превращении одних форм энергии в другие на основе закона сохранения энергии. Термодинамика устанавливает направление самопроизвольного течения химических реакций при данных условиях. При химических реакциях рвутся связи в исходных веществах и возникают новые связи в конечных продуктах. Сумма энергий связей после реакции не равна сумме энергий связи до реакции, т.е. протекание химической реакции сопровождается выделением или поглощением энергии, причем формы ее различны.
Термохимия – раздел термодинамики, посвященный изучению тепловых эффектов реакций. Тепловой эффект реакции, измеренный при постоянных температуре и давлении, называют энтальпией реакции  и выражают в джоулях (Дж) и килоджоулях (кДж).
и выражают в джоулях (Дж) и килоджоулях (кДж).
Для экзотермических реакций  , для эндотермических -
, для эндотермических -  . Энтальпию образования 1моль данного вещества из простых веществ, измереного при температуре 298 К (25 °С) и давлении 101,825 кПа (1 атм), называют стандартной
. Энтальпию образования 1моль данного вещества из простых веществ, измереного при температуре 298 К (25 °С) и давлении 101,825 кПа (1 атм), называют стандартной  (кДж/моль). Энтальпии простых веществ условно принимают равными нулю.
(кДж/моль). Энтальпии простых веществ условно принимают равными нулю.
В основе термохимических расчетов лежит закон Гесса: тепловой эффект реакции зависит только от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от пути перехода. Часто в термохимических расчетах применяют следствие из закона Гесса: тепловой эффект химической реакции  равен сумме теплот образования
равен сумме теплот образования  продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнении реакции:
продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнении реакции:

В термохимических уравнениях указывают значение энтальпии химической реакции  . При этом у формулы каждого вещества указывают его физическое состояние: газообразное (г), жидкое (ж), твердое кристаллическое (к).
. При этом у формулы каждого вещества указывают его физическое состояние: газообразное (г), жидкое (ж), твердое кристаллическое (к).
В термохимических уравнениях тепловые эффекты реакций дают в расчете на 1 моль исходного или конечного вещества. Поэтому здесь допускаются дробные коэффициенты. При химических реакциях проявляется диалектический закон единства и борьбы противоположностей. С одной стороны система стремится к упорядочению (агрегации) – уменьшению Н, а с другой стороны – к беспорядку (дезагрегации). Первая тенденция растет с понижением температуры, а вторая – с её повышением. Тенденцию к беспорядку характеризует величина, названная энтропией S [Дж/(моль.К)]. Она является мерой неупорядоченности системы. Энтропия пропорциональна количеству вещества и возрастает с увеличением движения частиц при нагревании, испарении, плавлении, расширении газа, ослаблении или разрыве связей между атомами и т.п. Процессы, связанные с упорядоченностью системы: конденсация, кристаллизация, сжатие, упрочнение связей, полимеризация и т.п. – ведут к уменьшению энтропии. Энтропия – функция состояния, т.е.

Общая движущая сила процесса складывается из двух сил: стремление к упорядочению  и стремления к беспорядку
и стремления к беспорядку  . При p = const и T = const общую движущую силу процесса
. При p = const и T = const общую движущую силу процесса  можно представить следующим образом:
можно представить следующим образом:

Энергия Гиббса  , или изобарно-изотермический потенциал, также подчиняется следствию закона Гесса:
, или изобарно-изотермический потенциал, также подчиняется следствию закона Гесса:

Самопроизвольно протекают процессы, идущие в сторону уменьшения любого потенциала и, в частности, в сторону уменьшения  . При состоянии равновесия
. При состоянии равновесия  температура начала равновесной реакции равна:
температура начала равновесной реакции равна: 
Таблица 5
Стандартные энтальпии образования  , энтропии
, энтропии  и энергии Гиббса образования
и энергии Гиббса образования  некоторых веществ при 298 К (25°С)
некоторых веществ при 298 К (25°С)
| Вещество |  , кДж/моль , кДж/моль
|  , Дж/моль , Дж/моль
|  , кДж/моль , кДж/моль
|
| CaO (к) | -635,5 | 39,7 | -604,2 |
| CaCO3 (к) | -1207,0 | 88,7 | -1127,7 |
| Ca(OH)2 (к) | -986,6 | 76,1 | -896,8 |
| H2O (ж) | -285,8 | 70,1 | -237,3 |
| H2O (г) | -241,8 | 188,7 | -228,6 |
| Na2O (к) | -430,6 | 71,1 | -376,6 |
| NaOH (к) | -426,6 | 64,18 | -377,0 |
| H2S (г) | -21,0 | 205,7 | -33,8 |
| SO2 (г) | -296,9 | 248,1 | -300,2 |
| SO3 (г) | -395,8 | 256,7 | -371,2 |
| C6H12O6 (к) | -1273,0 | - | -919,5 |
| C2H5OH (ж) | -277,6 | 160,7 | -174,8 |
| CO2 (г) | -393,5 | 213,7 | -394,4 |
| CO(г) | -110,5 | 197,5 | -137,1 |
| C2H4 (г) | 52,3 | 219,4 | 68,1 |
| CH4(г) | -74,9 | 186,2 | -50,8 |
| Fe2O3 (к) | -822,2 | 87,4 | -740,3 |
| FeO (к) | -264,8 | 60,8 | -244,3 |
| Fe3O4 (к) | -1117,1 | 146,2 | -1014,2 |
| CS2 (г) | 115,3 | 65,1 | 237,8 |
| P2O5 (к) | -1492 | 114,5 | -1348,8 |
| NH4Cl (к) | -315,39 | 94,56 | -343,64 |
| HCl (г) | -92,3 | 186,8 | -95,2 |
| NH3 (г) | -46,2 | 192,6 | -16,7 |
| N2O (г) | 82,0 | 219,9 | 104,1 |
| NO (г) | 90,3 | 210,6 | 86,6 |
| NO2 (г) | 33,5 | 240,2 | 51,5 |
| N2O4 (г) | 9,6 | 303,8 | 98,4 |
| CuO (к) | -162,0 | 42,6 | -129,9 |
| H2 (г) | 130,5 | ||
| C (графит) | 5,7 | ||
| O2 (г) | 205,0 | ||
| N2 (г) | 181,5 | ||
| Fe (к) | 27,15 | ||
| Cl2 (г) | 222,9 | ||
| KNO3 (к) | -429,71 | 132,93 | -393,13 |
| KNO2 (к) | -370,28 | 117,15 | -281,58 |
| K2O (к) | -361,5 | 87,0 | -193,3 |
| ZnO (к) | -350,6 | 43,6 | -320,7 |
| Al2O3 (к) | -1676,0 | 50,9 | -1582,0 |
| PCl5 (г) | -369,45 | 362,9 | -324,55 |
| PCl3 (г) | -277,0 | 311,7 | -286,27 |
| H2O2 (ж) | -187,36 | 105,86 | -117,57 |
Скорость реакции определяется природой и концентрацией реагирующих веществ и зависит от температуры и катализатора.
Закон действия масс:При постоянной температуре скорость химической реакции пропорциональна произведению концентрации реагирующих веществ в степени их стехиометрических коэффициентов.
Для реакции аА + вВ = сС + dD скорость прямой реакции:
 ,
,
скорость обратной реакции:  , где
, где  - концентрации растворенных или газообразных соединений, моль/л;
- концентрации растворенных или газообразных соединений, моль/л;
a, b, c, d – стехиометрические коэффициенты в уравнении;
К – константа скорости.
В выражении для скорости реакции не включают концентрации твердых фаз.
Влияние температуры на скорость реакции описывается правилом Вант-Гоффа: при нагревании на каждые 10 градусов скорость реакции возрастает в 2-4 раза.

 - скорость реакции при температурах t1 и t2;
- скорость реакции при температурах t1 и t2;
 - температурный коэффициент реакции.
- температурный коэффициент реакции.
Большинство химических реакций являются обратимыми:
аА + вВ  сС + dD
сС + dD
отношение констант скоростей – величина постоянная, называемая константой равновесия
 Кр = const при T = const.
Кр = const при T = const.
Принцип Ле – Шателье:Если на систему, находящуюся в состоянии химического равновесия, оказать какое – либо воздействие (изменить температуру, давление или концентрацию), то система будет реагировать таким образом, чтобы уменьшить приложенное воздействие:
а) при повышении температуры в равновесных системах равновесие смещается в сторону эндотермической реакции, а при понижении температуры – в сторону экзотермической реакции;
б) при повышении давления равновесие смещается в сторону меньших объемов, а при понижении давления – в сторону больших объемов;
в) при повышении концентрации равновесие смещается в сторону ее уменьшения.
Пример 1.Определите стандартное изменение энтальпии  реакции:
реакции:

Экзо- или эндотермическая данная реакция?
Решение: Стандартное изменение энтальпии химической реакции равно сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ

При каждом суммировании следует учитывать в соответствии с уравнением реакции, число молей участвующих в реакции веществ. Стандартные энтальпии образования простых веществ равны нулю:

Согласно табличным данным:

Реакции, которые сопровождаются выделением теплоты, называются экзотермическими, а те, которые сопровождаются поглощением теплоты, - эндотермическими. При постоянных температуре и давлении изменение энтальпии химической реакции равно по величине, но обратно по знаку ее тепловому эффекту. Поскольку стандартное изменение энтальпии данной химической реакции  , то делаем вывод, что данная реакция является экзотермической.
, то делаем вывод, что данная реакция является экзотермической.
Пример 2. Реакция восстановления Fe2O3 водородом протекает по уравнению:
Fe2O3(K) + 3H2(Г) = 2Fe(K) + 3H2O(Г)
Возможна ли эта реакция при стандартных условиях?
Решение: Для ответа на этот вопрос задачи нужно вычислить стандартное изменение энергии Гиббса реакции  . В стандартных условиях:
. В стандартных условиях:

Суммирование производят с учетом числа моделей, участвующих в реакции веществ,  образования наиболее устойчивой модификации простого вещества принимают равной нулю.
образования наиболее устойчивой модификации простого вещества принимают равной нулю.
С учетом выше сказанного 
Согласно табличным данным:

Самопроизвольно протекающие процессы идут в сторону уменьшения  . Если
. Если  < 0, процесс принципиально осуществим, если
< 0, процесс принципиально осуществим, если  > 0, процесс самопроизвольно проходить не может.
> 0, процесс самопроизвольно проходить не может.
 следовательно, данная реакция при стандартных условиях невозможна.
следовательно, данная реакция при стандартных условиях невозможна.
Пример 3. Написать выражения закона действия масс для реакций:
а) 2NO(Г) + Cl2(Г) = 2NOCl(Г)
б) CaCO3(K) = CaO(K) + CO2(Г)
Решение: Согласно закону действия масс скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам:
а) V = k[NO]2 .[Cl2]
б) Поскольку карбонат кальция - твердое вещество, концентрация которого не изменяется в ходе реакции, искомое выражение будет иметь вид:
V = k, т.е. в данном случае скорость реакции при определенной температуре постоянна.
Пример 4. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению:
PCl5(Г) = PCl3(Г) + Cl2(Г); 
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции – разложение PCl5? Напишите математическое выражение скорости прямой и обратной реакций, а также константы равновесия.
Решение: Смещением или сдвигом химического равновесия называют изменения равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции.
Смещение химического равновесия подчиняется принципу Ле-Шателье, согласно которому изменение одного из условий, при которых система находится в равновесии, вызывает смещение равновесия в направлении той реакции, которая противодействует производному изменению.
а) Так как реакция разложения PCl5 эндотермическая  , то для смещения равновесия в сторону прямой реакции нужно повысить температуру.
, то для смещения равновесия в сторону прямой реакции нужно повысить температуру.
б) Так как в данной системе разложение PCl5 ведет к увеличению объема (из одной молекулы газа образуется две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление.
в) Смещение равновесия в указанном направлении можно достигнуть как увеличением концентрации PCl5, так и уменьшением концентрации PCl3 или Cl2.
Согласно закону действия масс, скорости прямой (V1) и обратной (V2) реакций выражаются уравнениями:
V1 = k[PCl5]
V2 = k[PCl3][Cl2]
Константа равновесия данной реакции выражается уравнением:

Контрольные задания:
81 - 100.а) рассчитайте стандартное изменение энтальпии  прямой реакции и определите экзо- или эндотермическая это реакция;
прямой реакции и определите экзо- или эндотермическая это реакция;
б) определите изменение энергии Гиббса  прямой реакции и сделайте вывод о возможности её осуществления при стандартных условиях;
прямой реакции и сделайте вывод о возможности её осуществления при стандартных условиях;
в) напишите математическое выражение скорости прямой и обратной реакции, а также константы равновесия;
г) как следует изменить условия, чтобы равновесие процесса сместить вправо?
81. CH4(г) + CO2(г) = 2СO(г) + 2H2(г)
82. FeO(K) + CO(г) =Fe(K) + CO2(г)
83. C2H4(г) + O2(г) = CO2(г) + H2O(г)
84. N2(г) + 3H2(г) =2NH3(г)
85. H2O(г) +CO(г) = CO2(г) +H2(г)
86. 4HCl(г) + O2(г) = 2H2O(г) + 2Cl2(г)
87. Fe2O3(К) +3H2(г) = 2Fe(K) + 3H2O(г)
88. 2SO2(г) + O2(г) = 2SO3(г)
89. PCl5(г) = PCl3(г) + Cl2(г)
90. CO2(г) + C(графит) = 2СO(г)
91. 2H2S(г) + 3O2(г) = 2SO2(г) + H2O(г)
92. Fe2O3(K) +CO(г) =2FeO(K) + CO2(г)
93. 4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(г)
94. NH4Cl(K) = NH3(г) + HCl(г)
95. CH4(г) + 2O2(г) = CO2(г) + 2H2O(г)
96. CS2(г) + 3O2(г) = CO2(г) + 2SO2(г)
97. 4HCl(г) + O2(г) = 2Cl2(г) + 2H2O(г)
98. 2NO(г) + O2(г) = N2O4(г)
99. NH3(г) + HCl(г) = NH4Cl(K)
100. CS2(г) + 3O2(г) = 2Cl2(г) + 2SO2(г)
Тема 6: Растворы. Способы выражения концентрации растворов
Растворы – это гомогенные системы, состоящие из растворителя, растворенных веществ и возможных продуктов их взаимодействия. Концентрацией раствора называется содержание растворенного вещества в определенной массе или известном объеме раствора или растворителя.
Способы выражения концентрации растворов:
Массовая доля (  ) показывает количество граммов растворенного вещества в 100 г раствора:
) показывает количество граммов растворенного вещества в 100 г раствора:
 ,
,
где т – масса растворенного вещества (г), т1 – масса раствора (г).
Молярная концентрация показывает число молей растворенного вещества, содержащихся в 1л раствора:
 (Моль/л),
(Моль/л),
где М- молярная масса вещества (г/моль), V- объем раствора (л).
Моляльная концентрация показывает число молей растворенного вещества, содержащихся в 1000г растворителя:
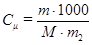 (Моль/1000г р-ля),
(Моль/1000г р-ля),
где т2 – масса растворителя (г).
Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора:
 (Моль/л),
(Моль/л),
Пример 1. В 1кг воды растворено 212 г Na2CO3; плотность раствора равна 1,188 г/мл. Найти:
а) массовую долю Na2CO3; б) молярную концентрацию;
в) моляльную концентрацию; г) молярную концентрацию эквивалента.
Решение. а) Массовая доля растворенного вещества  есть отношение массы растворенного вещества к массе раствора.
есть отношение массы растворенного вещества к массе раствора.
 ;
; 
 .
.
б) Молярная концентрация СМ – это отношение количества растворенного вещества п к объему раствора V(р-ра)

Количество вещества Na2CO3 определяют по формуле:



Объем раствора определяют через плотность 

Отсюда молярная концентрация раствора:
 .
.
в) Моляльная концентрация  есть отношение количества растворенного вещества п к массе растворителя т:
есть отношение количества растворенного вещества п к массе растворителя т:


Контрольные задания:
101-120. Найти массовую долю, молярную концентрацию, моляльную концентрацию для следующих растворов:
| Вариант | Вещество (х) | Масса вещества (х) | Объем воды | Плотность раствора |
| CuSO4 | 320 г | 10 л | 1,019 | |
| NaCl | 0,6 г | 50 мл | 1,071 | |
| H2SO4 | 2 г | 100 мл | 1,012 | |
| Na2SO4 | 13 г | 100 мл | 1,111 | |
| HNO3 | 12,6 г | 100 мл | 1,066 | |
| HCl | 3,6 кг | 10 кг | 1,098 | |
| NaOH | 8 г | 200 г | 1,043 | |
| MgCl2 | 190 г | 810 г | 1,037 | |
| KOH | 224 г | 776 г | 1,206 | |
| CuCl2 | 13,5 г | 800 мл | 1,012 | |
| HCl | 10,8 г | 200 г | 1,149 | |
| CuSO4 | 8 г | 200 мл | 1,040 | |
| NaCl | 6,1 г | 600 мл | 1,005 | |
| Na2SO3 | 4,2 г | 500 мл | 1,082 | |
| H2SO4 | 98 г | 1000 мл | 1,066 | |
| ZnCl2 | 13,6 г | 100 мл | 1,052 | |
| H3PO4 | 9,8 г | 1000 мл | 1,012 | |
| Ba(OH)2 | 100 г | 900 г | 1,085 | |
| H3PO4 | 29,4 г | 600 мл | 1,023 | |
| NaOH | 28 г | 72 г | 1,309 |
|
из
5.00
|
Обсуждение в статье: Тема 5: Термодинамика и кинетика химических превращений |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

