 |
Главная |
ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ
|
из
5.00
|
ТАБЛИЦА ВАРИАНТОВ КОНТРОЛЬНЫХ ЗАДАНИЙ
| Номер варианта | Номер контрольного задания | Номера задач контрольных заданий | |||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Продолжение таблицы | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| Продолжение таблицы | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Продолжение таблицы | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Продолжение таблицы | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Окончание таблицы | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
| Ι | |||||||||||||||
| ΙΙ | |||||||||||||||
КОНТРОЛЬНОЕ ЗАДАНИЕ I
ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ.
ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ
Эмпирический закон Гесса для необратимых химических реакций доказан после открытия первого закона термодинамики. Использующиеся в его следствиях величины внутренней энергии (U) и энтальпии (Н) представляют собой функции состояния, изменения которых определяются только начальным и конечным состоянием системы [1, 2, 7].
Пример 1. Вычислите  реакции
реакции
4KСlO3 (к) = ЗKСlО4 (к) + KСl (к) .
Будет ли данная реакция экзо- или эндотермической? Для расчёта используйте термодинамические уравнения*:
1) KСlO3 (к) = KСl (к) + 3/2 O2 (г),  = – 45,5 кДж.
= – 45,5 кДж.
2) KСlО4 (к) = KСl (к) + 2 О2 (г), 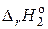 = + 6,6 кДж.
= + 6,6 кДж.
Решение. Термохимические расчёты проводят на основании закона Гесса: тепловой эффект реакции (при Т, V = const или Т, Р = const) не зависит от пути, по которому протекает процесс, а определяется только природой исходных веществ и продуктов реакции и их физическим состоянием. Согласно закону Гесса при расчётах с термохимическими уравнениями можно производить любые алгебраические действия, т.е. переносить члены уравнений из одной части уравнения в другую, складывать, вычитать и т.д.
В данном случае из уравнения 1, умноженного на 4, необходимо вычесть уравнение 2, умноженное на 3. Произведём эти действия и получим
4KClO3 (к) – 3KClO4 (к) = 4KCl (к) + 6O2 (г) – 3KCl (к) – 6O2 (г).
Приводим подобные члены и получаем уравнение химической реакции,  которой необходимо определить:
которой необходимо определить:
4KСlO3 (к) = 3KСlО4 (к) + KCl (к).
Такие же действия проведём с энтальпиями этих реакций:
 = 4 ×
= 4 ×  –3 ×
–3 × 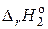 = 4·(– 45,5) – 3 · 6,6 = – 182,0 – 19,8 = – 201,8 кДж.
= 4·(– 45,5) – 3 · 6,6 = – 182,0 – 19,8 = – 201,8 кДж.
Таким образом,  = – 201,8 кДж. Так как
= – 201,8 кДж. Так как  = – Qр-ции, то данная реакция экзотермическая, т.е. протекает с выделением 201,8 кДж тепла.
= – Qр-ции, то данная реакция экзотермическая, т.е. протекает с выделением 201,8 кДж тепла.
Тепловой эффект можно включить в уравнение химической реакции:
4KСlО3 (к) = 3KСl4 (к) + ЗKСl (к) + 201,8 кДж.
Такая запись с тепловым эффектом называется термохимическим уравнением.
 |
*В термодинамических уравнениях указываются тепловой эффект реакции ΔH, а в термохимических – Q . Фазовое состояние и полиморфная модификация участвующих в реакции веществ обозначают символами: г – газообразное, ж – жидкое, к – кристаллическое и др.
Пример 2. Рассчитайте тепловой эффект реакции горения сероводорода
1) Н2S (г) + 3/2O2 (г) = Н2О (ж) + SO2 (г) по следующим данным:
2) S (к) + H2 (г) = H2S (г), 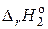 =
=  ( H2S) = – 20,6 кДж/моль;
( H2S) = – 20,6 кДж/моль;
3) Н2 (г) + 1/2О2 (г) = Н2О (ж),  =
=  ( Н2О (ж)) = – 285,8 кДж/моль;
( Н2О (ж)) = – 285,8 кДж/моль;
4) S (к) + O2 (г) = SO2 (г),  =
=  ( SO2) = – 286,9 кДж/моль.
( SO2) = – 286,9 кДж/моль.
Реакция (1) экзо- или эндотермическая?
Решение. Уравнения (2) – (4) являются термодинамическими уравнениями реакций образования соответственно 1 моль H2S (г), Н2О (ж), и SO2 (г) из простых веществ в стандартных условиях: Т = 298 K и Р = 1 атм, а значит тепловые эффекты этих реакций являются стандартными энтальпиями образования указанных соединений  . Справочные значения
. Справочные значения  различных соединений приведены в табл. П1 приложения. Стандартные теплоты образования простых веществ
различных соединений приведены в табл. П1 приложения. Стандартные теплоты образования простых веществ  = 0. Складываем уравнения (3) и (4) и вычитаем уравнение (2):
= 0. Складываем уравнения (3) и (4) и вычитаем уравнение (2):
H2 (г) + 1/2О2 (г) = Н2О (ж)
+
S (к) + O2 (г) = SO2 (г)
–
S (к) + H2 (г) = H2S (г)
________________________
H2 (г) + 1/2О2 (г) + S (к)+ O2 (г) – S (к) – H2 (г) = Н2О (ж) + SO2 (г) – H2S (г)
Приведём подобные члены и получим искомое уравнение (1):
H2S (г) + З/2О2 (г) = Н2О (ж) + SO2 (г);  =
=  +
+  –
– 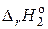 .
.
Подставив численные значения энтальпий образования H2S(г), H2O(ж) и SO2(г), получим изменение энтальпии для реакции (1):
 = –285,8 – 296,9 – (–20,6) = – 562,1 кДж.
= –285,8 – 296,9 – (–20,6) = – 562,1 кДж.
Полученное нами уравнение для расчёта энтальпии процесса горения сероводорода есть выражение одного из следствий закона Гесса:
 = (∑
= (∑  )(прод) – (∑
)(прод) – (∑  )(исх),
)(исх),
где (∑  ) (прод) и (∑
) (прод) и (∑  ) (исх) – суммы стандартных энтальпий образования продуктов реакции и исходных веществ;
) (исх) – суммы стандартных энтальпий образования продуктов реакции и исходных веществ;  ,
,  – стехиометрические коэффициенты продуктов и исходных веществ в уравнении реакции.
– стехиометрические коэффициенты продуктов и исходных веществ в уравнении реакции.
Отрицательное значение изменения энтальпии реакции горения сероводорода означает, что данная реакция экзотермическая (Qр-ции = –  ).
).
Пример 3. Вычислите тепловой эффект реакции
SiO2 (к) + 4HF (г) = SiF4 (г) + 2H2O (ж).
Определите, будет ли данная реакция экзо- или эндотермической. Теплоты образования химических соединений  приведены в табл. П1 приложения.
приведены в табл. П1 приложения.
Решение. Согласно следствию из закона Гесса, для процессов, которые протекают при Р = const, изменение энтальпии процесса (тепловой эффект реакции) равно разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ, умноженных на соответствующие коэффициенты. Находим  для предложенной реакции:
для предложенной реакции:
 = [
= [  (SiF4) + 2
(SiF4) + 2  (H2O)] – [
(H2O)] – [  (SiO2) + 4
(SiO2) + 4  (HF)].
(HF)].
Находим  веществ, участвующих в реакции, в табл. П1 приложения.
веществ, участвующих в реакции, в табл. П1 приложения.
| Вещество | SiO2 (к) | HF (г) | SiF4 (г) | Н2О (ж) |
 , кДж/моль , кДж/моль
| – 910,9 | – 273,3 | – 1614,9 | – 285,8 |
Итак,  = [(– 1614,9) + 2 · (– 285,8)] – [(– 910,9) + 4 ·(– 273,3)] =
= [(– 1614,9) + 2 · (– 285,8)] – [(– 910,9) + 4 ·(– 273,3)] =
= – 2186,5 + 2004,1 = – 182,4 кДж.
Отсюда Q р-ции = –  , = + 182,4 кДж, т.е. данная реакция экзотермическая.
, = + 182,4 кДж, т.е. данная реакция экзотермическая.
Пример 4. Найдите  для SO2, если при горении 48 г пирита по реакции: 4FeS2 (к) + 11О2 (г) = 2Fe2O3 (к) + 8SO2 (г) выделилось 330,8 кДж тепла.
для SO2, если при горении 48 г пирита по реакции: 4FeS2 (к) + 11О2 (г) = 2Fe2O3 (к) + 8SO2 (г) выделилось 330,8 кДж тепла.
Решение. Находим тепловой эффект предложенной реакции, для чего составляем пропорцию:
при сгорании 48 г FeS2 выделилось 330,8 кДж,
при сгорании 4 ·  = 4 × 120 г Fe2S выделится х кДж:
= 4 × 120 г Fe2S выделится х кДж:
х =  = 3308 кДж.
= 3308 кДж.
Q р-ции = 3308 кДж,  = – 3308 кДж.
= – 3308 кДж.
Согласно следствию из закона Гесса
 = [8
= [8  (SO2) + 2
(SO2) + 2  (Fe2O3)] – [4
(Fe2O3)] – [4  (FeS2) + 11
(FeS2) + 11  (O2)] ,
(O2)] ,
отсюда  (SO2) = 1/8
(SO2) = 1/8  – 1/4
– 1/4  (Fe2O3) + 1/2
(Fe2O3) + 1/2  (FeS2) , так как
(FeS2) , так как  (O2) = 0.
(O2) = 0.
Подставим значения  , используя табл. П1 приложения, получим
, используя табл. П1 приложения, получим
 (SO2) = 1/8 · (– 3308) – 1/4 · (– 822,2) + 1/2 (– 177,4) =
(SO2) = 1/8 · (– 3308) – 1/4 · (– 822,2) + 1/2 (– 177,4) =
= – 413,5 + 205,5 – 88,7 = – 296,7 кДж/моль.
Итак,  (SO2)= – 296,7 кДж/моль.
(SO2)= – 296,7 кДж/моль.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
Для решений используйте данные табл. П1 приложения.
1. Вычислите тепловой эффект реакции (Q) восстановления оксида железа FeO водородом: FeO (к) + H2 (г) = Fe (к) + H2O (г), используя следующие термодинамические данные.
1. FeO (к) + CO (г) = Fe (к) + CO2 (г),  = – 18,2 кДж.
= – 18,2 кДж.
2. СО (г) + 1/2 О2 (г) = СО2 (г), 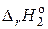 = – 283,0 кДж.
= – 283,0 кДж.
3. Н2 (г) + 1/2 О2 (г) = Н2О (г),  = – 241,8 кДж.
= – 241,8 кДж.
Ответ: Qр-ции = – 23 кДж.
2. Вычислите  реакции 3N2O (г) + 2NH3 (г) = 4N2 (г) + ЗН2О (г). Будет эта реакция экзо- или эндотермической?
реакции 3N2O (г) + 2NH3 (г) = 4N2 (г) + ЗН2О (г). Будет эта реакция экзо- или эндотермической?
Ответ:  = – 879,6 кДж.
= – 879,6 кДж.
3. Вычислите тепловой эффект (Q) процесса образования 1 т чистого карбида кальция СаС2 по реакции СаО (к) + ЗС (к) = CaC2 (к) + CO (г).
Ответ: Qр-ции = – 7,26 · 106 кДж.
4. Вычислите  (SiO2) исходя из термодинамических данных для реакции:
(SiO2) исходя из термодинамических данных для реакции:
SiO2 (к) + 2Mg (к) = 2MgO (к) + Si (к),  = – 292,04 кДж.
= – 292,04 кДж.
Ответ:  (SiO2) = – 910,94 кДж/моль.
(SiO2) = – 910,94 кДж/моль.
5. Сколько теплоты выделится при сжигании 38 г сероуглерода CS2 (г) до СО2 и SO2?
Ответ: Qр-ции = 552,0 кДж.
6. Исходя из термодинамических данных для реакций окисления As2O3 кислородом и озоном, протекающих по уравнениям:
1) As2O3 (к) + О2 (г) = As2O5 (к),  = – 271,0 кДж;
= – 271,0 кДж;
2) 3As2O3 (к) + 2О3 (г) = 3As2O5 (к), 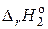 = – 1096,0 кДж,
= – 1096,0 кДж,
вычислите энтальпию образования озона из молекулярного кислорода.
Ответ:  (
(  ) = 141,5 кДж/моль.
) = 141,5 кДж/моль.
7. Вычислите  полиморфного превращения графита в алмаз
полиморфного превращения графита в алмаз
С (графит) = С (алмаз), на основании термохимических уравнений реакций:
1) 2С (графит) + 2О2 (г) ® 2СО2 (г) + 787,0 кДж;
2) 3С (алмаз) + 3О2 (г) ® 3СО2 (г) + 1186,2 кДж.
Ответ:  = + 1,9 кДж.
= + 1,9 кДж.
8. Исходя из термохимического уравнения реакции разложения перекиси водорода Н2О2 (ж) = Н2О (ж) + 1/2О2 (г) + 98 кДж, вычислите стандартную энтальпию образования Н2О2.
Ответ:  (H2O2) = –187,8 кДж/моль.
(H2O2) = –187,8 кДж/моль.
9. Вычислите стандартную энтальпию образования пропана (С3Н8), если известно, что при сжигании 11,0 г этого газа образуются Н2О (ж), СО2 (г) и выделилось 555 кДж тепла.
Ответ: 
 = – 103,85 кДж/моль.
= – 103,85 кДж/моль.
10. Вычислите, используя данные табл. П1 приложения, тепловой эффект реакции: 4NH3 (г) + 5 О2 (г) = 6 Н2О (г) + 4NO (г).
Ответ: Qр-ции = 902 кДж.
11. Вычислите  (С2H6), исходя из термодинамических реакций:
(С2H6), исходя из термодинамических реакций:
1) 2C2H6 (г) + 7O2 (г) = 4CO2 (г) + 6H2O (г),  = – 2855,56 кДж;
= – 2855,56 кДж;
2) С (графит) + О2 (г) = СО2 (г), 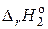 = – 393,51 кДж;
= – 393,51 кДж;
3) H2 (г) + 1/2O2 (г) = H2O (г),  = – 241,8 кДж.
= – 241,8 кДж.
Ответ: 
 = – 84,67 кДж/моль.
= – 84,67 кДж/моль.
12. Сера сгорает в закиси азота по реакции S (к) + 2N2O (г) = 2N2 (г) + SO2 (г).
Сколько тепла выделится при сгорании 5 г серы?
Ответ: Q = 72,02 кДж.
13. На основании закона Гесса и исходя из следующих термодинамических уравнений: 1) Н2 (г) + О2 (г) = Н2О2 (ж),  = – 187,86 кДж;
= – 187,86 кДж;
2) Н2О2 (ж) + Н2 (г) = 2Н2О (г), 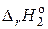 = – 295,76 кДж;
= – 295,76 кДж;
3) Н2О (ж) = Н2О (г),  = 44,02 кДж,
= 44,02 кДж,
определите изменение энтальпии для реакции 4) 2Н2 (г) + О2 (г) = 2Н2О (ж).
Рассчитайте значение стандартной энтальпии образования жидкой воды и сравните Ваш результат со справочными данными.
Ответ:  = – 571,66 кДж.
= – 571,66 кДж.
14. Вычислите тепловой эффект реакции MgO (к) + CO2 (г) = MgCO3 (к), исходя из следующих термохимических уравнений реакций:
1) С (графит) + О2 (г) = СО2 (г) + 393,51 кДж;
2) 2Mg (к) + O2 (г) = 2MgO (к) + 1202,98 кДж;
3) 2Мg (к) + 2С (графит) + 3О2 (г) = 2МgСО3 (к) + 2191,70 кДж.
Ответ: Q р-ции = 100,85 кДж.
15. По следующим термохимическим данным:
1) Si (крист.) + O2 (г) = SiO2 (кварц) + 910,94 кДж;
2) Si (аморф.) + O2 (г) = SiO2 (квapц) + 927,96 кДж,
вычислите, сколько теплоты выделится при превращении 140 г аморфного кремния в кристаллический?
Ответ: Q = 85,01 кДж.
16. Определите тепловой эффект реакции этерификации:
СН3СООН (ж) + С2Н5ОН (ж) = СН3СООС2Н5 (ж) + Н2О (ж),
исходя из следующих термодинамических уравнений:
1) СН3СООН (ж) + 2О2 (г) = 2СО2 (г) + 2Н2О (ж),  = – 874,59 кДж;
= – 874,59 кДж;
2) С2Н5ОН (ж) + ЗО2 (г) = 2СО2 + ЗН2О (ж), 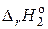 = – 1367,53 кДж;
= – 1367,53 кДж;
3) СН3СООС2Н5 (ж) + 5О2 (г) = 4СО2 (г) + 4Н2О (ж),  = – 2193,06 кДж.
= – 2193,06 кДж.
Данная реакция экзо- или эндотермическая?
Ответ: Q р-ции = – 49,06 кДж.
17. Рассчитайте тепловой эффект реакции восстановительного обжига:
Са3(РО4)2 (к) + 5С (к) = ЗСаО (ж) + 5СО (г) + Р2 (г).
Данная реакция будет экзо- или эндотермической?
Ответ: Q р-ции = – 1806,75 кДж.
18. Этан горит с образованием углекислого газа и воды. Используя данные табл. П1 приложения и на основании термодинамического уравнения реакции
С2Н6 (г) + 3,5О2 (г) = 2СО2 (г) + ЗН2О (ж);  = – 1559,84 кДж,
= – 1559,84 кДж,
вычислите стандартную энтальпию образования этана.
Ответ:  ( С2Н6 ) = – 84,67 кДж/моль.
( С2Н6 ) = – 84,67 кДж/моль.
19. Рассчитайте стандартную энтальпию образования диоксида азота (NО2), исходя из следующего термохимического уравнения:
2NО2 (г) = N2O4 (г) + 57,27 кДж.
Ответ: 
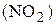 = + 34,75 кДж/моль.
= + 34,75 кДж/моль.
20. Используя термохимическое уравнение
Fe2O3 (к) + 3CO (г) = 2Fe (к) + 3CO2 (г) + 26,78 кДж,
вычислите стандартную энтальпию образования оксида железа (III).
Ответ: 
 = – 822,16 кДж/моль.
= – 822,16 кДж/моль.
ХИМИЧЕСКОЕ СРОДСТВО.
|
из
5.00
|
Обсуждение в статье: ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

