 |
Главная |
Смещение химического равновесия
|
из
5.00
|
Состояние химического равновесия сохраняется длительное время при неизменных условиях: температуры, давления и концентрации. Изменение условий влечёт засобой нарушение (смещение) равновесия. Смещение химического равновесия при изменении внешних условий подчиняется принципу Ле-Шателье: всякая система, находящаяся в состоянии химического равновесии, при оказании на нее внешнего воздействия, стремится это воздействие ослабить.
Пример 9. Как для обратимой реакции N2 (г) + 3Н2 (г) ↔ 2NH3 (г) + Q надо изменить: а) температуру; б) давление в) концентрацию, чтобы сместить равновесие в сторону прямой реакции – образования аммиака?
Решение.
1. Такая запись реакции показывает, что прямая реакция протекает с выделением тепла, а обратная, соответственно, с поглощением (эндотермический процесс). Исходя из принципа Ле-Шателье, с повышением температуры химическое равновесие смещается в сторону реакции, идущей с поглощением тепла, а с понижением температуры – в сторону реакции, идущей с выделением тепла. Следовательно, чтобы сместить равновесие в сторону образования аммиака, необходимо температуру понизить.
2. Исходя из принципа Ле-Шателье, уменьшение внешнего давления смещает равновесие в сторону его роста. Давление создается газообразными веществами. Прямая реакция идет с уменьшением объёма газообразныхвеществ (число моль продуктов реакции(2 моль NH3) меньше числа моль исходных веществ (1 моль N2 + 3 моль Н2 = 4 моль), следовательно, прямая реакция протекает с уменьшением давления. При протекании обратной реакции давление растет (увеличивается число моль газообразных веществ). Увеличение внешнегодавления смещает равновесие в сторону, ведущую к уменьшению числа моль газообразных веществ. В данной реакции к сдвигу химического равновесия в сторону образования аммиака приводит повышение давления.
3. По принципу Ле-Шателье введение в равновесную систему дополнительного количества какого-либо вещества смещает равновесие в том направлении, в котором концентрация введённого вещества уменьшается. В данной реакции, чтобы сместить равновесие в сторону образования аммиака, необходимо увеличить концентрацию исходных веществ (N2 или Н2) или выводить (уменьшать концентрацию) из равновесной системы продукт (NH3 ).
КОНТРОЛЬНЫЕ ЗАДАНИЯ
41. Реакция между сероводородом и кислородом протекает по уравнению
2H2S (г) + ЗО2 (г) = 2SО2 (г) + 2Н2О (г). Как изменится скорость прямой реакции, если увеличить в 3 раза:
1) концентрацию H2S;
2) концентрацию О2:
3) давление?
Ответ: Скорость реакции увеличится в 1) 9 раз; 2) 27 раз; 3) 243 раза.
42. Скорость химической реакции при повышении температуры на 10 °С увеличилась в 2 раза. Во сколько раз возрастёт скорость этой реакции при увеличении температуры на 40 °С?
Ответ: 16 раз.
43. Реакции протекают по уравнениям:
1) N2О4 (г) ↔ 2NO2 (г),
2) 4NH3 (г) + 3O2 (г) ↔ 2N2 (г) + 6H2O (г),
3) 2S (к) + 4H2O (г) ↔ 2SO2 (г) + 4H2 (г),
4) С (к) + О2 ( г) ↔ СО2 (г).
1. Напишите для реакций выражения констант равновесия и через молярные концентрации (K C ) и парциальные давления реагентов(KP).
2. Укажите, от каких из перечисленных ниже факторов не зависит константа равновесия: природа реагентов, температура, концентрация, энергия активации, присутствие катализатора.
44. Реакция 2HI + H2O2 = 2Н2О + I2 протекает по стадиям:
1) HI + Н2О2 = Н2О + НIO (медленная);
2) HIO + HI = Н2О + I2 (быстрая).
Напишите кинетическое уравнение реакции. Определите молекулярность, общий порядок реакции и порядок реакции по веществу HI. Как изменится скорость этой сложной реакции, если разбавить исходные вещества в 2 раза?
Ответ: уменьшится в 4 раза.
45. Реакция протекает по уравнению NO (г) + N2O5 (г) ↔ 3NO2 (г). В каком направлении сместится химическое равновесие, если концентрацию всех участников реакции увеличить в 2 раза? Ответ мотивируйте на основании расчёта скорости прямой и обратной реакций.
46. Реакция между оксидом углерода (II) и водородом протекает по уравнению CO (г) + 2Н2 (г) = СН3ОН (г). Как изменится скорость прямой реакции, если увеличить в 2 раза:
1) концентрацию СО;
2) концентрацию Н2;
3) концентрацию СО и Н2?
Ответ: скорость реакции увеличитсяв 1) 2 раза;2) 4 раза;3) 8 раз.
47. Вычислите температурный коэффициент скорости реакции, если скорость её при температуре 55 °С составляла 8,19×10 –2 моль/л∙с, а при повышении температуры до 105 °С возросла до 19,9017 моль/л∙с.
Ответ: g = 3,0.
48. Химическое равновесие в реакции СО (г) + Н2О (г) ↔ СО2 (г) + Н2 (г) установилось при следующих концентрациях реагирующих веществ (моль/л): [СО] = 0,02; [Н2О] = 0,32; [СО2] = 0,08; [Н2] = 0,08. Вычислите константу равновесия реакции и исходные концентрации оксида углерода (II) и паров воды.
Ответ: K C = 1,0; сCO = 0,1; 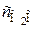 = 0,4.
= 0,4.
49. Реакция Н2 + 2IСl = I2 + 2НСl протекает в две стадии:
1) IС1 + Н2 ↔ НI + НСl (медленная);
2) IСl + HI ↔ I2 + HC1 (быстрая).
Какая стадия определяет скорость реакции? Напишите кинетическое уравнение реакции. Определите молекулярность и общий порядок реакции. Почему молекулярность и порядок реакции не совпадают?
50. Напишите кинетическое уравнение для элементарной реакции
2NO (г) + Cl2 (г) = 2NOCl (г).
Определите, во сколько раз увеличится скорость реакции:
а) при повышении концентрации NO в 3 раза;
б) при повышении давления в системе в 2 раза?
Ответ: а) 9 раз; б) 8 раз.
51. Реакция разложения оксида азота (V) 2N2O5 (г) = 2N2O4 (г) + О2 (г)идёт по стадиям (все вещества газообразные):
1) N2O5 = N2О3 + О2 (медленная);
2) N2O3 = NO2 + NO (быстрая);
3) NO + N2O5 = 3NO2 (быстрая);
4) 2NO2 = N2O4 (быстрая).
Каков порядок этой сложной реакции? Во сколько раз возрастет скорость реакции при увеличении концентрации N2O5 в два раза?
Ответ: возрастёт в 2 раза.
52. При температуре 50 °С некоторая реакция заканчивается за 20 с. Сколько времени будет длится данная реакция при понижении температуры до 0 °С, если температурный коэффициент g = 2?
Ответ: 10,67 мин.
53. Химическое равновесие реакции СО (г) + Сl2 (г) ↔ СОС12 (г) установилось при следующих концентрациях участников реакций (моль/л): [СО] = 0,18; [С12] = 0,25; [СОСl2] = 2,025. Вычислите константы равновесия реакции KC , KР и исходные концентрации оксида углерода (II) и хлора.
Ответ: KC = 45 (моль/л)–1; KР = 1,842 (атм)–1; [СО]о = 2,205, [С12]о = 2,275 моль/л.
54. Исходные концентрации водорода и брома перед началом обратимой химической реакции Н2 (г) + Вг2 (г) ↔ 2НВr (г) (моль/л): [H2]о= 0,02; [Вг2]o = 0,02, а равновесная [H2] = 0,005. Вычислите равновесную концентрацию бромоводорода и константу химического равновесия реакции (KC).
Ответ: [НВr] = 0,030 моль/л; KC = 36.
55. Химическое равновесие гомогенной реакции 2A + B ↔ 2C установилось при следующих концентрациях (моль/л): [А] = 0,5; [B] = 0,7; [С] = 2,1. В какую сторону сместится химическое равновесие, если в системе уменьшить общее давление в 2 раза? Ответ мотивируйте на основании расчёта скоростей прямой и обратной реакций.
56. Реакция между оксидом азота (II) и водородом определяется уравнением 2NO (г) + Н2 (г) ↔ N2O (г) + Н2О (г). В какую сторону сместится химическое равновесие, если увеличить давление в системе в 2 раза? Ответ мотивируйте результатами расчёта скоростей прямой и обратной реакций.
Ответ: в прямом направлении.
57. Для реакции разложения йодоводорода 2НI (г) ↔ Н2 (г) + I2 (г) температурный коэффициент скорости реакции равен 2. Рассчитайте, на сколько градусов следует повысить температуру, чтобы скорость реакции возросла в 8 раз?
Ответ: ΔТ = 30°.
58. Химическое равновесие реакции 2NO (г) + О2 (г) ↔ 2NO2 (г) установилось при следующих концентрациях реагирующих веществ (моль/л): [NO] = 0,03; [O2] = 0,06; [NO2] = 0,02. Вычислите константы химического равновесия реакции KC , KР и исходные концентрации оксида азота (II) и кислорода.
Ответ: KC = 7,41 (моль/л)–1; KР = 0,303 (атм)–1; [NO]о = 0,05, [O2]о = 0,07 моль/л.
59. Исходные концентрации оксида серы (IV) и кислорода обратимой химической реакции 2SO2 (г) + О2 (г) ↔ 2SO3 (г) были: [SO2]о = 0,06 моль/л; [O2]о = 0,07 моль/л. Равновесие установилось при [O2] = 0,06 моль/л. Вычислите равновесные концентрации [SO2], [SO3] и константу равновесия реакции (KC).
Ответ: [SO2] = 0,04 моль/л; [SO3] = 0,02 моль/л; KC = 4,167(моль/л)–1.
60. Реакция протекает по уравнению А + В ↔ АВ. Напишите кинетическое уравнение прямой и обратной реакции и определите, в какую сторону сместится химическое равновесие, если повысить температуру на 20 °С? Температурные коэффициенты прямой и обратной реакции соответственно равны 2 и 4.
|
из
5.00
|
Обсуждение в статье: Смещение химического равновесия |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

