 |
Главная |
Реакции электрофильного замещения, катализируемые кислотами Льюиса
|
из
5.00
|
ЛЕКЦИЯ 14
АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
ХИМИЧЕСКИЕ СВОЙСТВА
Арены являются высоко ненасыщенными соединениями, но для них не характерны реакции присоединения, присущие как алкенам, так и алкинам.
Ненасыщенный характер бензола не выявляется с помощью общепринятых качественных реакций:
- бензол не обесцвечивает бромную воду в отсутствие катализатора;
- бензол не обесцвечивает раствор перманганата калия даже при длительном кипячении с бензолом.
Причина отличия свойств аренов от других классов ненасыщенных соединений заключается в наличии высокой энергии стабилизации ароматической системы (у бензола 153,1кДж/моль), поэтому арены предпочтительно вступают в такие реакции, в результате которых сохраняется ароматичность, т.е. в реакции замещения.
Механизм реакции электрофильного замещения
Электронная плотность π-сопряженной системы бензольного кольца, расположенная над и под плоскостью цикла, образуемого атомами углерода:
1) экранирует атомы углерода от атаки нуклеофильными реагентами;
2) сама является удобным агентом для атаки электрофильными агентами.
Бензол нитруется, сульфируется, галогенируется, алкилируется и ацилируется по реакции электрофильного замещения. Как правило, электрофильные реагенты генерируются в процессе реакции при помощи катализаторов и соответствующих условий.
Реакция электрофильного ароматического замещения (SEAr) может быть представлена следующей общей схемой:

Рис. 14.1. Схема реакции электрофильного замещения в ароматическом кольце
!!! Особенность реакции электрофильного замещения в ароматическом ряду заключается в том, что процесс образования электрофильной частицы в каждой реакции представляет собой отдельную стадию, поскольку нейтральные молекулы, как правило, не способны преодолеть энергию сопряжения π-электронов в ароматическом кольце, что является необходимым условием для формирования новой связи.
Типичной реакцией электрофильного замещения является реакция нитрования бензола, приводящая к образованию нитробензола:
Механизм реакции электрофильного замещения включает пять стадий.
1. На первой стадии образуется электрофильный реагент. В условиях реакции нитрования электрофильным реагентом является нитроний-катион. Образуется нитроний-катион в результате взаимодействия двух молекул азотной кислоты или взаимодействия молекулы азотной кислоты и молекулы серной кислоты, при этом молекула азотной кислоты выступает в роли основания Бренстеда (принимает протон), а другая молекула азотной кислоты или молекула серной кислоты выступает в роли кислоты Бренстеда (отдает протон):

Рис. 14.2. Схема образования электрофильного реагента в реакции нитрования аренов.
2. На второй стадии образуется π-комплекс между молекулой бензола и электрофильным реагентом. Образование π-комплекса является быстрой обратимой стадией. Все атомы углерода в молекуле арена находятся в состоянии sp2-гибридизации, т.е. ароматическая система при этом не нарушается:

Рис. 14.3. Схема образования π-комплекса
3. На третьей стадии один атом углерода бензольного кольца переходит в состояние sp3-гибридизации. При этом образуется σ-комплекс или бензенониевый (аренониевый) ион:
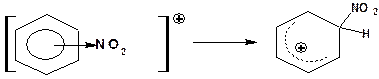
Рис. 14.4. Схема образования σ-комплекса
4. На четвертой стадии σ-комплекс перегруппировывается во второй π-комплекс с замещенным атомом углерода:

Рис. 14.5. Схема образования π-комплекса с протоном
5. На пятой стадии π-комплекс диссоциирует с образованием конечного продукта замещения:

Рис. 14.6. Схема образования продукта замещения
На четвертой стадии механизма σ-комплекс мог бы присоединить нуклеофильный реагент, что привело бы к образованию продукта присоединения и разрушению ароматической системы. Система предпочитает сохранить ароматическую систему, и сама делает выбор в пользу замещения.
14.2. Реакции электрофильного замещения, катализируемые кислотами Бренстеда и σ-кислотами.
При катализе кислотами Бренстеда и σ-кислотами образование электрофильной частицы, чаще всего, сопряжено с присоединением протона к нейтральным молекулам. К числу реакций электрофильного замещения катализируемых кислотами Бренстеда и
σ-кислотами относятся:
Сульфирование
Сульфирование – это реакция замещения атома водорода в углеводороде на группу –SO3H. Существенным отличием реакции сульфирования от других реакций электрофильного замещения является ее обратимость. Электрофильным агентом в сульфировании H2SO4 конц. или моногидратом выступает нейтральная молекула серного ангидрида(SO3), образующаяся по схеме:
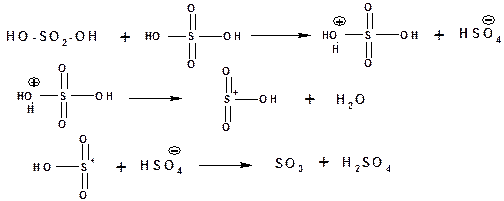

Рис. 14.6. Схема реакций образования электрофильного реагента и сульфирования бензола
Нитрование
Нитрование – это реакция замещения атома водорода в углеводороде на группу –NO2. Бензол реагирует с концентрированной азотной кислотой медленно даже при нагревании. Поэтому нитрование обычно проводят действием нитрующей смеси. Это смесь концентрированной азотной и серной кислот. Нитрование аренов нитрующей смесью является основным способом получения нитросоединений ароматического ряда.

Рис. 14.7. Схема реакции нитрования бензола
Реакции электрофильного замещения, катализируемые кислотами Льюиса
При катализе кислотами Льюиса образование электрофильной частицы, чаще всего, сопряжено с присоединением электрона к молекуле кислоты. В качестве кислот Льюиса наиболее часто используют BF3, AlCl3, AlBr3, FeCl3, FeBr3, ZnCl2, SnCl4. К числу реакций катализируемых кислотами Льюиса относятся галогенирование, а также алкилирование и ацилирование по Фриделю-Крафтсу.
1. Галогенирование. Замещение атома водорода в молекуле арена на галоген является одним из методов получения хлор- и бром-замещенных ароматических соединений. Бромирование проводят в присутствии бромного железа (III) или трехбромистого алюминия. При хлорировании в качестве катализатора используют хлорное железо (III). При этом электрофильная частица, в качестве которой выступает катион хлора или брома - генерируется в результате взаимодействия молекулы галогена с кислотой Льюиса:


Рис. 14.8. Схема образования электрофильного реагента и реакции галогенирования бензола
2. Алкилирование по Фриделю-Крафтсу происходит с использованием галогеналканов. В качестве кислоты Льюиса используют чаще всего хлорид (AlCl3) или бромид алюминия (AlBr3) в зависимости от природы галогена в реагенте. Электрофильная частица (карбкатион) генерируется по следующей схеме:

Рис. 14.9. Схема образования электрофильного реагента реакции алкилирования бензола
Факт образования карбкатиона подтверждается тем, что реакция алкилирования сопровождается перегруппировками электрофильного агента, в результате чего при алкилировании бензола н-пропилхлоридом и изопропилхлоридом, образуется изопропилбензол (кумол):

Рис. 14.10. Схема реакции алкилирования бензола
Образование изопропил-катиона из н-пропилхлорида происходит на стадии формирования ионной пары:
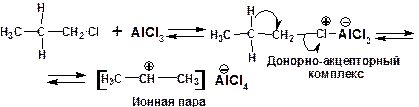
Рис. 14.11. Схема образования устойчивого карбкатиона из первичного алкилгалогенида
3. Ацилирование по Фриделю-Крафтсу – это замещение атома водорода в молекуле углеводорода в присутствии кислоты Льюиса на ацильную группу. Ацильной группой или ацилом называют остаток карбоновой кислоты после отнятия гидроксильной группы:

Рис. 14.12. Электрофильные реагенты реакции ацилирования бензола
В качестве кислоты Льюиса используют галогениды алюминия, трифторид бора, пентафторид сурьмы. В качестве ацилирирующего агента используют хлорангидриды и ангидриды карбоновых кислот. Электрофильный реагент образуется по следующему механизму:

Рис. 14.13. Схема образования электрофильного реагента реакции ацилирования бензола
Примеры реакции ацилирования по Фриделю-Крафтсу:
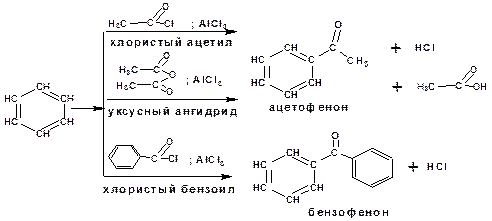
Рис. 14.14. Схема реакций ацилирования бензола по Фриделю-Крафтсу
Примеры реакций генерирования электрофильной частицы показывают, что в качестве этого реагента выступает сопряженная кислота.
|
из
5.00
|
Обсуждение в статье: Реакции электрофильного замещения, катализируемые кислотами Льюиса |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

