 |
Главная |
Для приведенной в условии задачи реакции
|
из
5.00
|

 HCHO(r) H2(r) + CO(r)
HCHO(r) H2(r) + CO(r)
кинетическое уравнение имеет вид:
V = k CHCHO 2
При повышении концентрации первого реагента в …3…. раз ( 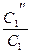 ) скорость реакции возрастет в…9….. раз.
) скорость реакции возрастет в…9….. раз.
При повышении концентрации второго реагента в …-…. раз (  ) скорость реакции возрастет в…-….. раз.
) скорость реакции возрастет в…-….. раз.
При повышении давления в …5…. раз (  ) скорость реакции возрастет в 52…*…= …25.. раз.
) скорость реакции возрастет в 52…*…= …25.. раз.
Зависимость скорости реакции от температуры отображается формулой Вант-Гоффа:



где Vt2 - скорость реакции при температуре t2,
Vt1 - скорость реакции при температуре t1,
g - постоянная для данной реакции величина, называемая температурным коэффициентом реакции.
Данные, приведенные в условии задачи:
g = ..2,8....
t1 = ..347K....
t2 = ..377K...
Вычисления по формуле Вант-Гоффа дают результат:

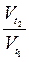 = 2,8377-347/10 = 21,952 ≈ 22
= 2,8377-347/10 = 21,952 ≈ 22
Таким образом, при повышении температуры на 30K скорость данной реакции возрастет в ..22... раза.
Большинство химических реакций являются обратимыми: одновременно с прямой реакций протекает обратная. В момент выравнивания скоростей прямой и обратной реакций в системе наступает состояние химического равновесия.
Константа химического равновесия характеризует взаимосвязь равновесных концентраций веществ, участвующих в данной реакции.
Для реакции общего вида:
a A + b B ↔ c C + d D,
где A, B, C, D - химические формулы веществ, а, b, c, d - стехиометрические коэффициенты, выражение для константы химического равновесия выглядит следующим образом:

где [A], [B], [C], [D] - равновесные концентрации соответствующих веществ.
В случае гомогенного равновесия (все вещества находятся в одинаковом фазовом состоянии, реакция происходит в однородной, гомогенной среде) в правую часть данного выражения записывают равновесные концентрации всех участников этого равновесия.
Для гетерогенных равновесий (вещества находятся в разных фазовых cостояниях, реакция протекает в неоднородной, гетерогенной среде) концентрацию твердых веществ считают практически неизменной и не записывают в правую часть выражения для константы равновесия.
Равновесие, отображенное схемой, приведенной в условии задачи, относится к разряду ........................, выражение для константы равновесия имеет вид:
Кp = PH2 * PCO
PHCHO
Изменение внешних условий приводит к смещению химического равновесия. Прогнозировать направление смещения равновесия можно с помощью принципа Ле Шателье:
если на систему, находящуюся в равновесии, оказывается воздействие извне, то равновесие смещается в сторону той реакции, протекание которой максимально ослабляет внешнее воздействие.
Поэтому:
нагреваниеблагоприятствует протеканию эндотермической реакции (DH>0), а охлаждение, напротив, смещает равновесие в сторону протекание экзотермической реакции (DH<0);
повышение общего давления в системе смещает равновесие в сторону реакции с образованием меньшего количества газообразных веществ, а понижение - большего;
добавление в реакционную систему какого-либо компонента ускоряет ту реакцию, где этот компонент расходуется, а отвод - реакцию, в которой это вещество образуется.
Исходя из этого, для смещения равновесия слева направо в рассматриваемой в задаче системе обратимых химических реакций, в которой прямая реакция происходит с поглащением... тепла (DH > 0) и увеличением (увеличением или уменьшением) количеств газообразных веществ (из 1 моль газов (HCHO) в результате реакции образуется 2 моль газообразных продуктов(H2 и CO)), НЕОБХОДИМО:
n - температуру повысить (повысить или понизить),
n - давление понизить (повысить или понизить)
n - концентрацию исходных веществ ... HCHO.... и ...……..(формулы) повысить (повысить или понизить),
n - концентрацию продуктов прямой реакции ..... H2...... и ... CO.......(формулы) понизить (повысить или понизить) (отвод).
Задача N 6
Для реакций:
1.  Se + AuCl3 + H2O Au + H2SeO3 + HCl
Se + AuCl3 + H2O Au + H2SeO3 + HCl
2.  MnO2 + NaOH MnO(OH) + Na3MnO4 + H2O
MnO2 + NaOH MnO(OH) + Na3MnO4 + H2O
Составьте уравнения методом электронного баланса. Для каждой реакции укажите, какое вещество является окислителем, а какое – восстановителем и за счет каких атомов. Определите типы данных окислительно-восстановительных реакций.
Решение
Окислительно-восстановительные реакции характеризуются переходом электронов от одного вещества (восстановителя) к другому (окислителю).
Для ответов на вопросы задачи вычислим степени окисления атомов, входящих в состав приведенных в уравнении реакции веществ, руководствуясь следующими правилами:
· - степени окисления атомов в простых веществах (построенных из атомов одного и того же элемента) принимаются равными нулю;
· - степень окисления атома водорода в соединениях с неметаллами равна +1;
· - степень окисления атома кислорода в большинстве его соединениях равна -2 (к исключениям из правила относятся, например, пероксиды типа H2O2, в которых степень окисления атома О равна -1);
· - степени окисления типичных металлов (I,II,III группы главные подгруппы периодической системы Д. И. Менделеева, кроме бора) в их соединениях постоянны и численно равны номеру группы, т.е. +1, +2, +3, соответственно;
· - алгебраическая сумма степеней окисления атомов в молекуле равна нулю, в сложном ионе - заряду иона.
Запишем вычисленные степени окисления над символами элементов в уравнении реакции:
 SeO + Au+3Cl3-1 + H2+1O-2 AuO + H2+1Se+4O3-2 + H+1Cl-1
SeO + Au+3Cl3-1 + H2+1O-2 AuO + H2+1Se+4O3-2 + H+1Cl-1
 Mn+4O2-2 + Na+1O-2H+1 Mn+3O-2 (OH) -1 + Na3+1Mn+5O4-2 + H2+1O-2
Mn+4O2-2 + Na+1O-2H+1 Mn+3O-2 (OH) -1 + Na3+1Mn+5O4-2 + H2+1O-2
Для составления электронных уравнений выпишем атомы элементов, изменившие свои степени окисления, и укажем число электронов, отдаваемое или принимаемое атомами для осуществления такого изменения степеней окисления:
первая реакция:
SeO - - 4 е = Se+4
Au+3 - + 3 е = AuO
вторая реакция:
Mn+4 - + 1 е = Mn+3
Mn+4 - - 1 е = Mn+5
Восстановителями (отдают электроны) являются:
В первой реакции Se (степень окисления повышается с 0 до + 4) ……………………………………………………………………
Во второй реакции MnO2 (за счет атома Mn, степень окисления которого повышается с + 4 до + 5) ………………………………
Окислителями (принимают электроны) являются:
В первой реакции AuCl3 (за счет атома Au, понижает степень окисления с + 3 до 0)….……………………………
Во второй реакции MnO2 (за счет атома Mn , понижает степень окисления с + 4 до +3). ………………………………
Суммарное число электронов, отдаваемых в ходе реакции частицами-восстановителями, и суммарное число электронов, принимаемых в ходе реакции частицами-окислителями должны быть равны друг другу. На этом основан один из методов расстановки коэффициентов в уравнениях окислительно-восстановительных реакций, называемый методом электронного баланса.
Для обеспечения указанного электронного равенства подберем множители к электронным уравнениям процессов окисления и восстановления, найдя наименьшее общее кратное для числа отданных и присоединенных электронов и поделив его на каждое из чисел.
Запишем полученные множители справа за чертой у каждого из уравнений:
Первая реакция:
 |
SeO - - 4 е = Se+4 3
Au+3 - + 3 е = AuO 4
Вторая реакция:
 |
Mn+4 - + 1 е = Mn+3 1
Mn+4 - - 1 е = Mn+5 1
Расстановку коэффициентов проведем в следующей последовательности:
· - перенесем полученные в электронном балансе множители в левую и правую части уравнения реакции к формулам соответствующих веществ;
· - уравняем атомы металлов;
· - уравняем кислотные остатки;
· - уравняем атомы водорода.
Итоговые коэффициенты в уравнениях данных реакций таковы:
Первая реакция:
 3Se + 4AuCl3 + 9H2O 4Au + 3H2SeO3 + 12HCl
3Se + 4AuCl3 + 9H2O 4Au + 3H2SeO3 + 12HCl
Вторая реакция:
 2MnO2 + 3NaOH MnO(OH) + Na3MnO4 + H2O
2MnO2 + 3NaOH MnO(OH) + Na3MnO4 + H2O
Для проверки их правильности просуммируем число атомов кислорода в левой и правой части уравнения:
..9.... = ..9...
..7.... = .7.....
Значит коэффициенты расставлены верно.
Для определения типа рассматриваемой окислительно-восстановительной реакции воспользуемся следующей классификацией:
· - межмолекулярные окислительно-восстановительные реакции (атом-окислитель и атом-восстановитель входят в состав разных веществ);
· - внутримолекулярные окислительно-восстановительные реакции (атом-окислитель и атом-восстановитель входят в состав одного и того же вещества, являясь атомами разных элементов);
· - реакции диспропорционирования (атом-окислитель и атом-восстановитель являются атомами одного и того же элемента в промежуточной степени окисления).
Рассматриваемые в задаче окислительно-восстановительные реакции относятся к типам:
первая межмолекулярные, т.к. атом-окислитель и атом-восстановитель входят в состав разных веществ ……..…………………………………………………………………………............ ………………………………………………………………………………………………………….............
вторая диспропорционировани,т.к. атом-окислитель и атом-восстановитель являются атомами одного и того же элемента в промежуточной степени окисления ……………………………………………………………………………………………………………………………………………………………..
. Задача N 7
Составьте схему гальванического элемента, напишите электронные уравнения электродных процессов и суммарное уравнение соответствующей окислительно-восстановительной реакции. Вычислите концентрацию раствора электролита или ЭДС.
| Номер задачи | Металл 1-го электрода | Электролит 1-го электрода | Концентрация электролита 1-го электрода | Металл 2-го электрода | Электролит 2-го электрода | Концентрация электролита 2-го электрода | ЭДС |
| Mn | Mn(NO2) 3 | 1,00 | Tl | TlNO3 | 0,10 | ? |
Решение
Гальванический элемент - это электрохимическая система, в которой энергия окислительно-восстановительной реакции трансформируется в электрическую энергию, т.е. такая система служит в качестве химического источника тока.
Анодный процесс заключается в окислении металла, характеризующегося более отрицательной величиной электродного потенциала Е0, в катодном процессе участвует частица-окислитель, присутствующая в катодном электролите.
Для металлов, приведенных в условии задачи:
Е0Mn2+ /Mn......... = -1,180В,
Е0Tl+ /Tl = -0,336В
(таблицу стандартных электродных потенциалов см. в Методических указаниях к контрольным работам по химии);
Более отрицательной величиной электродного потенциала характеризуется металл Mn., поэтому именно он и будет участником анодного процесса.
Металл анода окисляется, что можно представить в виде электронного уравнения вида:
Ме0 - m e- = Mem+
Для данного металла:
Mn0 - 2 е- = Mn2+
Катодный процесс заключается в восстановлении катионов металла, входящих в состав соли – электролита катода.
Соответствующее электронное уравнение имеет вид:
Men+ + n e- = Me0
Для системы, описанной в условии задачи:
Tl + + 1 е- = Tl0
суммарное уравнение
Mn0 - 2 е- = Mn2+
 Tl + + 1 е- = Tl0
Tl + + 1 е- = Tl0
__________________________
Mn0 + 2 Tl + = Mn2+ + 2Tl0
Mn + 2 TlNO3 = Mn(NO3)2 + 2Tl
Электрохимическая схема - это условная запись, в которой представлена информация о аноде и катоде с указанием металлов, состава электролитов, а также особенностях конструкции данного
гальванического элемента:

 Металл I | Электролит I || Электролит II | Металл II
Металл I | Электролит I || Электролит II | Металл II
(с более .. (с менее
отриц.Е0) отриц.Е0)
АНОД КАТОД
Для рассматриваемого в задаче гальванического элемента электрохимическая схема имеет вид:
Mn | Mn(NO3) 2 || TlNO3 | Tl
а н о д к а т о д
Чтобы вычислить ЭДС гальванического элемента, необходимо найти разность потенциалов катода и анода:
ЭДС = Е катода - Е анода
Каждый из указанных потенциалов можно вычислить по формуле Нернста:

где Е0 – стандартный электродный потенциал металла анода или катода, n - число электронов, отдаваемых восстановителем или принимаемых окислителем, С - концентрация электролита, моль/л.
Следовательно, ЭДС гальванического элемента может быть представлена следующей формулой:
ЭДС = (Е  мет. катода +
мет. катода +  lg Cэл-та катода) – (Е
lg Cэл-та катода) – (Е  мет. анода +
мет. анода +  lgCэл-та анода)
lgCэл-та анода)
Подставляем численные данные условия задачи и производим необходимые вычисления:
Е  мет. катода = -0,336В
мет. катода = -0,336В
Cэл-та катода = 0,10моль/л
lg Cэл-та катода = -1
n = 1(для катодного процесса)
Е  мет. анода = -1,180В
мет. анода = -1,180В
Cэл-та анода = 1,00моль/л
lgCэл-та анода = 0
n = 2(для анодного процесса)
ЭДС = 0,785В
ЭДС = (-0,336+  lg 0,10) – (-1,180+
lg 0,10) – (-1,180+  lg 1,00)
lg 1,00)
Неизвестная величина: ЭДС = 0,785В
Задача N 9
Как будет происходить электролиз водного раствора электролита …NiBr2……….? Приведите уравнение диссоциации электролита и поясните возможность участия каждого из образующихся ионов в электродных реакциях. Составьте электронные уравнения процессов, протекающих на инертных электродах. Вычислите массу (для твердых и жидких) или объем (для газообразных) веществ, образующихся на электродах.
Решение
Электролиз - это окислительно-восстановительная реакция, происходящая на электродах при пропускании электрического тока через расплав или раствор электролита. В таких системах электролиты подвергаются диссоциации – распаду на положительно- (катионы) и отрицательно- (анионы) заряженные ионы. Уравнение диссоциации электролита имеет вид:
KmAn = mKx+ + nAy-
Для электролита, рассматриваемого в данной задаче:
……………… NiBr2 = Ni2+ + 2Br - ……………………………….
При электролизе расплавов веществ на катоде происходит процесс восстановления катионов (процесс присоединения электронов), а на аноде - процесс окисления анионов (процесс отдачи электронов). В результате, как правило, происходит разрядка ионов, т.е. переход их в нейтральное состояние:
Кx+ + xe = K0 (на катоде)
Ay- - ye = A0 (на аноде)
Если электролизу подвергается водный раствор, то необходимо учитывать возможность участия воды, как в катодном, так и в анодном процессе.
Преимущественное участие молекул воды в катодном процессе:
2 H2O + 2e = H2 + 2 OH-
происходит в том случае, если в состав электролита входят катионы электрохимически активных металлов:
Li+, Rb+, K+, Cs+, Ra2+, Ba2+, Ca2+, Na+, Mg2+, Al3+.
Такие катионы требуют для своей разрядки значительно больше энергии, чем ее затрачивается на выделение водорода из воды, поэтому получить эти металлы электролизом водных растворов их соединений невозможно.
Поскольку в состав электролита, указанного в условии задачи, входят катионы ... Ni2+......, то электронное уравнение катодного процесса имеет вид:
.................Ni2+ +2е- = Ni2+
Если в состав электролита входят анионы кислородсодержащих кислот:(NO3-, NO2-, SO32-, SO42-, PO43-, CO32- и т.п.), а также фторид-анион F-, то по тем же энергетическим причинам в анодном процессе участвуют анионы электролита, а молекулы воды:
2 H2O - 4e = O2 + 4 H+
В состав рассматриваемого в задаче электролита входят анионы .. 2Br - ......., поэтому электронное уравнение анодного процесса выглядит следующим образом:
........................ 2Br - - 2е - = Br0 .............
Продуктами данного электролиза являются:)
- непосредственно выделяющиеся на электродах металлический никель (Ni),
- а также результаты вторичных взаимодействий между ионами, входящими в состав исходного электролита и не принимающие участие в электродных реакциях и ионами, образующимися в результате электродных реакций ........................................... NiBr2...............................................................
Для вычислений массы m (для газов - объема V) веществ, образующихся на электродах в результате электролиза, необходимо воспользоваться законом Фарадея:
 или (для газов):
или (для газов): 
где m - молярная масса, г/моль
Vm- молярный объем, равный 22.4 л/моль при н.у.
I - сила тока, А
z - число электронов в уравнении электродного процесса
t - время проведения электролиза, секунды
F - постоянная величина (число Фарадея),
равная 96500 Кл/моль
В условии задачи дано: I = ...5....... A, t = ....2ч15 мин...... или 8100 сек
Первый продукт электролиза … Br2 формула) является … жидким …..(твердым, жидким или газообразным) веществом, поэтому для него необходимо вычислить … массу …..(массу или объем). Подставляем в соответствующую формулу необходимые значения: m = ...80*2=160....... г/моль, z = ...2........
Для твердых или жидких веществ: 
Для газообразных веществ: 
Второй продукт электролиза …Ni…(формула) является … твердым..(твердым, жидким или газообразным) веществом, поэтому для него необходимо вычислить … массу …..(массу или объем). Подставляем в соответствующую формулу необходимые значения: m = .59........ г/моль, z = ...2........
Для твердых или жидких веществ: 
Для газообразных веществ: 
Третий продукт электролиза … .............(формула) является … газообразным …..(твердым, жидким или газообразным) веществом, поэтому для него необходимо вычислить объем …..(массу или объем). Подставляем в соответствующую формулу необходимые значения: m = ......... г/моль, z = ...........
Для твердых или жидких веществ: 
Для газообразных веществ: 
Четвертый продукт электролиза …………(формула) является …………………..(твердым, жидким или газообразным) веществом, поэтому для него необходимо вычислить ………………..(массу или объем). Подставляем в соответствующую формулу необходимые значения: m = .......... г/моль, z = ...........
Для твердых или жидких веществ: 
Для газообразных веществ: 
[1] 1 кДж = 1000 Дж
|
из
5.00
|
Обсуждение в статье: Для приведенной в условии задачи реакции |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

