 |
Главная |
Калибровка калориметра и определение теплоты растворения соли
|
из
5.00
|
Кафедра химии
Лабораторная работа
Калибровка калориметра и определение теплоты растворения соли
по дисциплине «Общая, неорганическая и физическая химия»
Специальность1-53 01 01 Автоматизация технологических процессов и производств
по направлениям:
1-53 01 01-04 Автоматизация технологических процессов и производств
(химическая промышленность)
1-53 01 01-06 Автоматизация технологических процессов и производств
(пищевая промышленность)
Проверил Выполнил
студенты группы АТПП -
________________________ ________________________
«____» ____________2018 г.
«––––» ––––––––––––––––2018
Могилев 2018
1. Цель работы – познакомиться с устройством калориметра, выполнить калибровку лабораторного калориметра простейшего типа, определить тепловой эффект растворения соли.
2. Приборы и реактивы:
- Стакан емкостью 600 – 800 мл (калориметрическим сосуд).
- Другой стакан большего размера, играющий роль термостата.
- Термометр с ценой деления 0,1º, закрепленный в штативе.
- Стеклянная палочка для перемешивания.
- Запаянная стеклянная ампула с налитой водой.
- Электрическая плитка.
- Термостойкий стакан с термометром на 100º для нагревания ампулы.
- Мерный цилиндр на 500-1000 мл для отмеривания воды для калориметра.
- Навеска соли.
3. Теоретическое введение.
1. Раздел физической химии, занимающийся тепловыми эффектами химических реакций, называется термохимией.
1) Тепловые эффекты различных процессов измеряются с помощью специальных высоко точных приборов – калориметров. Простейший тип калориметра – с изотермической оболочкой. Имеющиеся в нашем лабораторном практикуме устройства относятся именно к этому типу.
Определение тепловых эффектов в калориметре основано на использовании следующих двух уравнений, получаемых на основе I начала термодинамики (при условии P = const):
Qp = КΔТ, (1)
ΔН = – КΔТ .(2)
В этих уравнениях:
- Qp – количество теплоты, подведенной к калориметру при его калибровке от внешнего источника (электрический нагреватель, нагретое тело);
- ΔН – тепловой эффект химической реакции, происходящей в калориметре (например, теплота растворения соли в воде);
- ΔТ – изменение температуры калориметра при проведении изучаемого процесса;
- К – константа калориметра, которая по своему смыслу является теплоемкостью всех частей калориметра, которые соприкасаются с раствором и воспринимают вводимую теплоту или тепловой эффект реакции:
К =  miCpi. (3)
miCpi. (3)
В уравнении (3) mi – масса, а Cpi – удельная теплоемкость этих частей калориметра.
Константа калориметра К в принципе могла бы быть рассчитана теоретически по уравнению (3) исходя из массы и теплоемкости составляющих его частей, однако на практике такие расчеты могут дать лишь приближенные значения. Поэтому ее определяют экспериментально путем калибровки калориметра.
Существует несколько способов калибровки калориметра.
1. Электрический метод калибровки считается самым точным, хотя реализовать на практике все его возможности очень непросто. Он основан на пропускании электрического тока через нагреватель, помещенный внутрь калориметрического сосуда. Этот нагреватель изготавливают из проволоки с минимальным температурным коэффициентом сопротивления, так чтобы его сопротивление (R) и сила проходящего тока (I) мало изменялись в процессе нагревания. Теплоотвод по соединительным проводам также должен быть минимальным. Введенная теплота рассчитывается по уравнению Qp = IUt, где U – разность потенциалов на концах нагревателя, t – время пропускания тока, или по эквивалентному ему уравнению Qp = I2 R t.
2. Метод смешения основан на введении в калориметрический сосуд нагретого (или охлажденного) до определенной температуры T3 тела с известной теплоемкостью Cp¢. Это тело, отдавая тепло калориметру, само охлаждается до температуры калориметра T2 (рис. 2). В случае нагретого тела количество подведенной к калориметру теплоты рассчитывается по уравнению
Qp = Cp¢(T3–T2). (4)
Этот метод калибровки калориметра, ввиду его простоты и удобства, используется в нашем лабораторном практикуме.
3. Иногда используется метод определения К по растворению навески вещества с хорошо известной теплотой растворения. В этом случае для расчетов используется уравнение (2), а тепловой эффект процесса растворения рассчитывается по уравнению ΔН = nΔНраств, в котором интегральная молярная теплота растворения стандартного вещества ΔНраств определяется по термодинамическим таблицам [5] для заданного разбавления раствора.
4. Методика выполнения (ход работы).
В нашем лабораторном практикуме изотермический калориметр (рис.1) представляет собой стакан (1) емкостью 600 – 800 мл, служащий калориметрическим сосудом. Он помещается в другой стакан (2), играющий роль термостата. Тепловая изоляция снизу и воздушная прослойка сбоку калориметрического сосуда обеспечивают достаточные для учебных целей изотермические условия в процессе выполнения экспериментов. В стакан (1) наливается 400 мл дистиллированной воды (3) комнатной температуры. Стакан (2) помещается на столе, под него также кладут слой теплоизолирующего материала (асбест, несколько слоев бумаги). В стакан опускается термометр (4) с ценой деления 0,1º, закрепленный в штативе; при этом шарик термометра располагается приблизительно на уровне середины высоты налитой воды, ближе к стенке стакана, чтобы не мешать перемешиванию жидкости стеклянной палочкой (5), конец которой защищен резиновой трубкой.
При проведении калибровки калориметра или измерении тепловых эффектов получают кривые температура – время. Общий вид таких кривых показан на рис.2.
При осторожном перемешивании жидкости палочкой производятся измерения зависимости температуры калориметра T от времени t (начальный период 1). Измерения производятся каждую минуту, количество измерений должно составлять не менее 10. Точность отсчета температуры ± 0,01º. Чем меньше температурный ход калориметра, тем точнее будут результаты, т.к. уменьшается поправка на теплообмен калориметра с внешней средой. При калибровке калориметра главный период (2) начинается в момент (t1) опускания в калориметр нагретого тела или навески растворяемой соли.

Рисунок 1 – Схема простейшего лабораторного калориметра
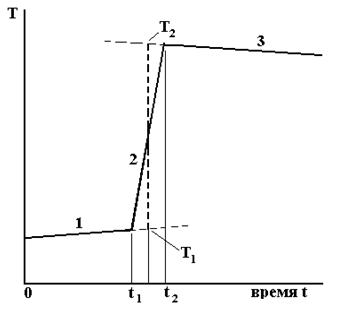
Рисунок 2 – График температура T – время t для калориметрического опыта
В методе смешения в качестве нагретого тела в нашем практикуме используется запаянная стеклянная ампула с налитой водой. Эта ампула содержит 10 г стекла с общей теплоемкостью 1 (Дж/г·К)·10 (г) = 10 Дж/К и 5 г воды с общей теплоемкостью 4,2 (Дж/г·К)·5 (г) = 21 Дж/К, так что ее суммарная теплоемкость Cp¢ равна 31 Дж/К. Ампула нагревается в течение 5 – 7 минут в воде, нагретой почти до кипения; температура воды, т.е. температура ампулы время t°С3, измеряется термометром с точностью ± 0,5º. Ампула извлекается из горячей воды и переносится в калориметр как можно быстрее, чтобы предотвратить появление значительных ошибок за счет ее быстрого охлаждения на воздухе. В течение главного периода, когда температура калориметра быстро изменяется, ее измерения производятся каждые 0,5 минуты при непрерывном и достаточно интенсивном перемешивании жидкости. При этом необходимо соблюдать осторожность, чтобы не разбить шарик термометра и ампулу и не разбрызгать жидкость.
По окончании быстрого изменения температуры (t°С2) ее измерения снова производят через 1 минуту, интенсивность перемешивания жидкости можно опять уменьшить. Начинается заключительный период калориметрического опыта (3), который длится 10-15 минут.
В случае необходимости повторения измерений заключительный период предыдущего опыта может рассматриваться как начальный период следующего, если повышение температуры не привело к значительному увеличению температурного хода калориметра (не более 0,1 – 0,2º за 10 минут).
Константа калориметра К рассчитывается, исходя из уравнения (1):
К = 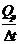 =
=  (5)
(5)
Для этого необходимо обработать полученные результаты и определить величину изменения температуры калориметра Δ t°С и количество введенной в калориметр теплоты Qp.
С этой целью на миллиметровой бумаге строится график (рис.2), его масштаб по оси температуры составляет: 1º = 100 мм. При построении этого графика и при выполнении изложенных ниже расчетов нет необходимости переходить от измеренной термометром температуры в градусах Цельсия (t°С) к абсолютной температуре (T,К), удобнее строить этот график в координатах t°С – время t. Поэтому ниже все расчеты представлены в градусах Цельсия (t°С).
На этом графике все три периода калориметрического опыта четко различаются: начальный период (0 – t1), главный (t1 – t2) и заключительный (после t2). Для более точного определения ΔT необходимо хотя бы приближенно учесть поправку на теплообмен калориметра с внешней средой. То, что такой теплообмен существует, видно по температурному ходу линий 1 и 3 на рис.2. Для этого линии 1 и 3продолжаются (пунктир на рис.2) и на середине отрезка между t1 и t2 восстанавливается перпендикуляр. Тогда его отрезок, заключенный между точками T2(°С) и T1(°С), дает искомую величину Δ Т°С= T2–T1.
Количество введенной в калориметр теплоты Qp рассчитывается, исходя из теплоемкости ампулы Cp¢ (31 Дж/К) и изменения ее температуры T3 – T2 по уравнению (4).
Результаты первого опыта сразу же наносятся на график (рис. 2), по нему определяется величина Δ t°С и рассчитывается константа калориметра К. Эти результаты показываются преподавателю для внесения возможных изменений в технику выполнения работы и обработки результатов. Для увеличения базы измеренных величин допускается использование результатов, полученных разными студентами на разных калориметрических установках. В этом случае очень небольшие систематические различия в величинах К для разных установок выступают в качестве составляющих случайных ошибок.
Нижний предел величины К может быть оценен по теплоемкости воды 4,2(Дж/г·К)·400(г) = 1680 (Дж/К) и стеклянных частей калориметра – приблизительно 1(Дж/г·К)·100(г) = 100 (Дж/К). Он составляет 1780 Дж/К. Если экспериментальная величина К оказывается меньше этой оцененной величины, то это свидетельствует о грубых ошибках в работе или в расчетах.
Для определения теплоты растворения соли получают кривые температура – время (рис. 2). В калориметр наливается 400 мл дистиллированной воды (можно использовать из опыта по калибровке) и при осторожном перемешивании жидкости палочкой производятся измерения зависимости температуры калориметра T от времени t (начальный период 1). Измерения производятся каждую минуту, количество измерений должно составлять не менее 10. Главный период (2) начинается в момент (t1) опускания в калориметр навески растворяемой соли. В течение главного периода, когда температура калориметра быстро изменяется, ее измерения производятся каждые 0,5 минуты при непрерывном и достаточно интенсивном перемешивании жидкости. По окончании быстрого изменения температуры (t°С2) ее измерения снова производят через 1 минуту, интенсивность перемешивания жидкости можно опять уменьшить. Начинается заключительный период калориметрического опыта (3), который длится 10-15 минут.
Результаты опыта сразу же наносятся на график (рис. 2), по нему определяется величина Δ t°С и рассчитывается ΔН (уравнение 2). После этого рассчитывается интегральная теплота растворения (ΔНm) и полученное значение сравнивается со справочной величиной [5, с.46].
5. Результаты измерений и расчетов представляются в виде таблиц 1 – 3.
Таблица 1 – Данные калориметрических опытов
| № опыта | Результаты измерения температуры t° в зависимости от времени t | |||||||||||||||||||||||||||
| Начальный период | Главный период | Заключительный период | ||||||||||||||||||||||||||
| Время, мин | ||||||||||||||||||||||||||||
| Калибровка калориметра | ||||||||||||||||||||||||||||
Продолжение таблицы 2
| Определение теплоты растворения соли | ||||||||||||||||||||||||||||
Таблица 2 – Результаты обработки данных калориметрических опытов и расчета константы калориметра К (метод смешения)
| Номер опыта | Т°3 – Т°2 | Qp | Т°1 | Т°2 | Δ Т° | К Дж/К |
Таблица 3 – Результаты определения теплоты растворения соли
| Номер опыта | m ( ), г | Т°1 | Т°2 | Δ Т° | ΔН, кДж | ΔНm, кДж/моль |
6. Заключение (выводы) – проведено ознакомление:
- с основными задачами, решаемыми термохимией,
- с устройством и методами калибровки калориметра,
- выполнена калибровка лабораторного калориметра методом смешения,
- определена теплота растворения соли.
7. Список литературы:
1) Общие требования и правила оформления текстовых документов: СТП СМК 4.2.3-01-2011. – Могилев: МГУП, 2011. – 43 с.
2) Скуратов С.М., Колесов В.П., Воробьёв А.Ф. Термохимия. В 2-х частях М.: МГУ.– Ч.1,1964. –302 с. – Ч.2, 1966.– 434 с.
Поляченок О.Г., Поляченок Л.Д. Определение константы калориметра методом смешения и по теплоте растворения соли». Методические указания для выполнения лабораторной работы в практикуме по физической и коллоидной химии для студентов технологических специальностей вузов. – Могилев: МГУП, 2007. – 12 с.
4) Поляченок О.Г., Поляченок Л.Д. Физическая и коллоидная химия. Практикум. Учебное пособие. Минск: Лаб. полиграфии УО БГТУ, 2006. – 380 с. – С. 72–93.
5) Краткий справочник физико-химических величин / под ред. А. А. Равделя, А. М. Пономаревой. – 8-е изд. – Л.: Химия, 1983. – 252 с.
Вопросы для зачета лабораторной работы.
1. Из каких основных частей состоит калориметр с изотермической оболочкой?
2. Напишите два уравнения, на использовании которых основано определение константы калориметра и тепловых эффектов в калориметре.
3. Что такое константа калориметра К, и почему ее нельзя рассчитать теоретически?
4. Назовите основные способы калибровки калориметра и поясните их сущность. Как рассчитывается константа калориметра в каждом способе.
5. Нарисуйте схему простейшего лабораторного калориметра и поясните его устройство.
6. Нарисуйте и поясните график температура t°С – время t для калориметрического опыта.
7. Какое нагретое тело используется в нашем практикуме для калибровки калориметра, и какова его теплоемкость?
8. Как учитывается поправка на теплообмен калориметра с внешней средой?
9. Как рассчитать константу калориметра в методе смешения.
10. Как определяется теплота растворения соли?
|
из
5.00
|
Обсуждение в статье: Калибровка калориметра и определение теплоты растворения соли |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

