 |
Главная |
Медно-цинковый гальванический элемент
|
из
5.00
|
Медно-цинковый гальванический элемент состоит из медной и цинковой пластин, опущенных соответственно в растворы сульфатов меди и цинка, которые отделены друг от друга пористой перегородкой, пропускающей только анионы SO42-. При разомкнутой внешней электрической цепи на поверхности металлов устанавливаются равновесия:
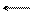  Zn Zn2+ + 2e, Zn Zn2+ + 2e,
 Сu Cu2+ + 2e. Сu Cu2+ + 2e.
|
Поскольку стандартный потенциал цинкового электрода более электроотрицателен, чем потенциал медного электрода, то при замыкании внешней цепи электроны будут переходить от цинка к меди. В результате равновесие на цинковом электроде сместится вправо, в сторону анодного процесса (окисления цинка):
| Zn – 2e → Zn2+. |
Пришедшие по внешней цепи электроны сместят равновесие на медном электроде в сторону катодного процесса (восстановления ионов Сu2+):
| Сu2+ +2е → Cu. |
Суммируя электродные реакции, получим:
| Zn + Cu2+ = Cu + Zn2+. |
Вследствие этой химической реакции в гальваническом элементе возникает движение электронов во внешней цепи (электрический ток), т.е. происходит превращение химической энергии в электрическую.
Используя уравнение Нернста, можно рассчитать ЭДС медно-цинкового элемента:
Еэ =Eк – Ea = ECu2+ / Cu – EZn2+ / Zn = E°Cu2+ / Cu – E°Zn2+ / Zn +
(0,059/2)·lg[c(Cu2+)/c(Zn2+)] = Е°э + (0,059/2)·lg[c(Cu2+)/c(Zn2+)],
где Еэ – ЭДС гальванического элемента в В, Е°э = (Е°к – Е°а) - стандартная ЭДС элемента в В, n = 2 – количество электронов, участвующих в катодном и анодом процессах.
Экспериментально определенная ЭДС всегда меньше вычисленной, поскольку при протекании тока в цепи происходит смещение потенциалов – катода в область более электроотрицательных значений, а анода - в область более положительных значений. Такое изменение электродных потенциалов называется поляризацией. Чтобы максимально уменьшить поляризацию необходимо измерять ЭДС гальванических элементов высокоомным вольтметром, чтобы ток в цепи был минимальным.
Электролиз
Электролизом называются процессы, протекающие на электродах под действием постоянного электрического напряжения, подаваемого от внешнего источника. При этом происходит превращение электрической энергии в химическую. Анод подключается к положительному полюсу источника напряжения, а катод – к отрицательному. В производстве применяется электролиз как с растворимыми анодами (металлическими, кроме золота и платиновых металлов), так и с нерастворимыми, инертными анодами (графит, золото, платиновые металлы).
Зависимость между количествами прошедшего через электролит электричества и веществ, полученных или израсходованных на электродах определяется законами Фарадея:
1) масса вещества, испытавшего электрохимическое превращение, прямо пропорциональна количеству прошедшего через электролит электричества:
| m = kQ, |
где m – масса вещества в граммах, Q – количество электричества в кулонах (Кл) (Q – заряд; Q = Iτ, где , I – ток в А, τ - время в с; А·с = Кл), k – электрохимический эквивалент, показывающий, сколько грамм вещества выделится или разложится при прохождении через электролит заряда в один кулон;
2) при одинаковых количествах электричества, прошедших через электролиты, массы веществ, прореагировавших или образовавшихся на электродах, относятся друг к другу как молярные массы их эквивалентов:
| m1/Mэ1 = m2/Mэ2 = … =mn/Mэn, |
где mi – массы веществ в граммах, Mэi – эквивалентные массы в г/моль. Для разложения или выделения одного моля эквивалентов вещества на электроде через него должен пройти один моль электронов, заряд которого равен постоянной Фарадея F:
F = NAe = 6,02 · 1023 моль-1 · 1,6 · 10-19Кл = 96485Кл/моль.
Записывая первый закон Фарадея для одного моля эквивалентов вещества, получим
| K = Mэ/F. |
При электролизе расплавов индивидуальных солей в электролитах содержится по одному виду катионов и анионов, поэтому на катодах происходит восстановление катионов металлов, а на анодах - окисление анионов. Например, при электролизе расплава хлорида натрия на аноде протекает восстановление ионов Na+:
| Na++e → Na, |
а на аноде - окисление ионов Сl-:
| 2Cl- - 2e → Cl2. |
Суммарный процесс можно записать следующим образом:
NaCl → Na + 1/2 С12.
При электролизе водных растворов электролитов возможно протекание нескольких электродных реакций, так как кроме катионов и анионов растворённых веществ в растворах присутствуют ионы Н+ и ОН-, образующиеся при диссоциации воды. На катодах в первую очередь восстанавливаются катионы металлов с наиболее положительными электродными потенциалами. Потенциал реакции восстановления ионов Н+, рассчитанный по формуле (38) принимает значения от -0,83 до 0 В (при изменении рН от 14 до 0). Катионы металлов, потенциал которых более положителен, чем потенциал водородного электрода (в ряду напряжений металлы расположенные правее водорода), в растворах восстанавливаются в первую очередь, а восстановления ионов Н+ не происходит. Таким образом восстанавливаются ионы Au3+, Hg2+, Ag+, Cu2+ и другие (Е которых >0).
Катионы металлов, потенциал которых отрицательнее потенциала выделения водорода (катионы щелочных, щелочно-земельных металлов и алюминия, Е которых <-0,83В) в водных растворах не восстанавливаются, т.к. на катоде происходит восстановление ионов Н+ .
Если в растворе содержатся катионы металлов, потенциал которых лежит в области значений потенциала восстановления ионов Н+ (ионы Sn2+, Pb2+, Ni2+, Cd2+, Zn2+ и других металлов, находящихся в ряду напряжений между алюминием и водородом), то на катоде одновременно происходит восстановление ионов Н+ и катионов металлов по реакции:
| Меn+ + nе → Ме. |
При протекании параллельных реакций на катоде часть количества электричества расходуется на осаждение металла, а другая часть - на восстановление ионов водорода. Доля от общего количества электричества, которая расходуется на выделение одного из веществ, называется выходом по току данного вещества. Выход по току металла рассчитывается по формуле:
| BT(Me) = Q(Me)/Q, |
где Q – общее количество электричества, Кл; Q (Me) – количество электричества, затраченное на выделение металла, Кл. Сумма выходов по току металла и водорода составляет 1.
На анодах протекают реакции окисления восстановителей и в первую очередь идут реакции с растворимыми анодами по уравнению, обратному (49). При использовании нерастворимых анодов происходит окисление анионов, причем в первую очередь окисляются анионы, не содержащие кислород (анионы Вг-, I-, Cl-, S2-). Если в составе анионов содержится кислород (NO3-, SO42-, PO43- и др.), то на нерастворимых анодах окисляются ионы ОН- с выделением кислорода:
| 4ОН- - 4е → О2 + 2Н2О. |
Коррозия металлов
Коррозия металлов - это разрушение металлов в результате их взаимодействия с окружающей средой. По механизмам протекания коррозионных процессов различают химическую и электрохимическую коррозию. Химическая коррозия протекает в газовых средах без конденсации влаги и при повышенных температурах (в печах), а также в растворах неэлектролитов. При этом происходит прямое гетерогенное взаимодействие металлов с окислителями сред.
При электрохимической коррозии происходит анодное окисление металлов и катодное восстановление окислителей на различных участках поверхности металлов, что сопровождается переходом электронов от анодных участков к катодным. Основными окислителями служат кислород и катионы водорода. При коррозии с выделением водорода (с водородной деполяризацией) на катодных участках протекает следующая реакция:
| 2Н+ + 2е → Н2. |
Если окислителем является кислород (с кислородной деполяризацией), то катодный процесс в нейтральной и щелочной средах протекает по уравнению (1), а в кислой - по уравнению (2):
| (1) (2) | О2 + 2Н2О + 4е → 4ОН- , О2 + 4Н+ + 4е → 2Н2О. |
Коррозия возможна только при условии, что EMen+ / Me < Еок, т.к. процесс коррозии – это окисление металла (анодный процесс). Для определения возможности протекания коррозии нужно знать потенциал катодного процесса восстановления окислителя Еок. При коррозии с водородной деполяризацией Еок = Ен+/н рассчитывается по уравнению
ЕH+/H = -0,059рН.
Если коррозия протекает с кислородной деполяризацией, то Еок рассчитывается по уравнению Нернста для кислородного газового электрода (при 298К):
| Ео2/oH- = 1,23 – 0,059рН. |
Окислители играют двойную роль в процессах коррозии. С одной стороны, они могут восстанавливаться и этим ускорять коррозию металлов, а с другой стороны, могут вызывать явление пассивации некоторых металлов (хрома, титана, алюминия и др.) в результате образования защитных оксидных плёнок.
|
из
5.00
|
Обсуждение в статье: Медно-цинковый гальванический элемент |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

