 |
Главная |
Тема 10. Коллоидные растворы. Строение мицеллы. Коагуляция
|
из
5.00
|
Основные понятия: коллоидные растворы, виды устойчивости коллоидных растворов, их причину и факторы, вызывающие ее нарушении, мицелла, правило Панета-Фаянса правило Шульце-Гарди.
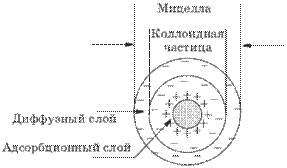
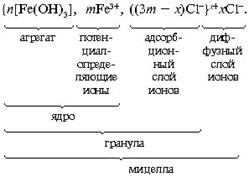
Мицелла состоит из электронейтрального агрегата, окруженного двойным электрическим слоем. Агрегат и потенциалопределяющие ионы образуют ядро. Агрегат вместе с адсорбционным слоем называют гранулой (частицей). Заряд гранулы равен сумме зарядов потенциалопределяющих ионов и прочно связанных противоионов. Если гранула заряжена положительно, при электрофорезе она движется к катоду; если гранула заряжена отрицательно – к аноду.
В общем виде строение мицеллы можно представить следующим образом:
 | |||
 | |||
Пример 30. Строение структурной единицы лиофобных коллоидов – мицеллы – может быть показано лишь схематически, поскольку мицелла не имеет определенного состава. Рассмотрим строение коллоидной мицеллы на примере гидрозоля иодида серебра, получаемого взаимодействием разбавленных растворов нитрата серебра и иодида калия:
AgNO3 + KI ––> AgI + KNO3
Коллоидная мицелла золя иодида серебра образована микрокристаллом иодида серебра, который способен к избирательной адсорбции из окружающей среды катионов Ag+ или иодид-ионов. Если реакция проводится в избытке иодида калия, то кристалл будет адсорбировать иодид-ионы; при избытке нитрата серебра микрокристалл адсорбирует ионы Ag+. В результате этого микрокристалл приобретает отрицательный либо положительный заряд; ионы, сообщающие ему этот заряд, называются потенциалопределяющими, а сам заряженный кристалл – ядром мицеллы. Заряженное ядро притягивает из раствора ионы с противоположным зарядом – противоионы; на поверхности раздела фаз образуется двойной электрический слой. Некоторая часть противоионов адсорбируется на поверхности ядра, образуя т.н. адсорбционный слой противоионов; ядро вместе с адсорбированными на нем противоионами называют коллоидной частицей или гранулой. Остальные противоионы, число которых определяется, исходя из правила электронейтральности мицеллы, составляют диффузный слой противоионов; противоионы адсорбционного и диффузного слоев находятся в состоянии динамического равновесия адсорбции – десорбции.
Схематически мицелла золя иодида серебра, полученного в избытке иодида калия (потенциалопределяющие ионы – анионы I–, противоионы – ионы К+) может быть изображена следующим образом:
{ m [AgI] · nI– · (n-x)K+}x– · x K+
При получении золя иодида серебра в избытке нитрата серебра коллоидные частицы будут иметь положительный заряд: { m [AgI] · nAg+ · (n-x)NO3–}x+ · x NO3–
Пример 31. Коллоидный раствор гидроксида железа (III)получен по реакции:
FeCl3 + 3NaOH = Fe(OH)3(тв.) + 3NaCl
При некотором избытке а) FeCl3, б) NaOH. Составьте схему строения мицеллы золя гидроксида железа (III) для случая а) и б). Определите знак заряда коллоидных частиц.
Решение. а) FeCl3→ Fe3+ + 3Cl-
стабилизатор
{m[Fe(OH)3] · nFe3+· 3(n-x)Cl-}3x+ 3xCl-
Знак заряда гранулы положительный.
б) NaOH→Na+ + OH-
{m[Fe(OH)3] · nOH- · (n-x)Na+}x- xNa+
Знак заряда коллоидных частиц отрицательный.
Коагуляция – потеря коллоидными системами агрегативной устойчивости. Коагуляция коллоидных растворов может быть вызвана воздействием различных факторов: концентрированием дисперсной фазы, диализом, механическим воздействием, изменением температуры, различными видами излучений, добавлением электролитов.
Наибольшее теоретическое и практическое значение имеет разрушение золя при добавлении электролита. Минимальная концентрация электролита, по достижении которой начинается коагуляция, называется порогом коагуляции.
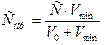
где V0 – объем золя, л; Vmin – минимальный объем раствора электролита, вызывающий коагуляцию золя, л; С – концентрация электролита в растворе, моль/л. Величина, обратная, порогу коагуляции, называется коагулирующей способностью: КС = 1/Спор
Коагулирующее действие электролитов подчиняется правилу Шульце-Гарди, теоретически обоснованному Дерягиным и Ландау: коагуляцию вызывают ионы с зарядом, противоположным заряду гранулы, и коагулирующая способность тем выше, чем выше заряд коагулирующего иона.
Пример 32. Для коагуляции 100мл золя иодида серебра потребовалось 3мл 0,2М сульфата натрия и 4мл 0,3М хлорида натрия. Коагулирующая способность какого электролита – коагулятора (ЭК) больше? Каков знак заряда частица золя? Катионы или анионы вызывают коагуляцию золя?
Решение.
1. Вычислим порог коагуляции каждого электролита-коагулятора так:

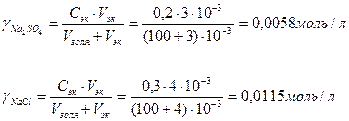
2. Определим коагулирующую способность:
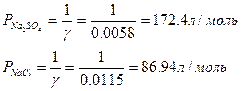
Коагулирующая способность Na2SO4>NaCl. Так как заряд катионов одинаков, а коагулирующая способность различна, значит, коагуляцию золя вызывают анионы: SO42->Cl-. Следовательно, согласно правилу Шульце-Гарди золь иодида серебра заряжен положительно и частица при электрофорезе перемещается к катоду.
Пример 33. Коагуляция 10 мл гидрозоля железа (III) наступила при добавлении к нему 2 мл раствора сульфата натрия с молярной концентрацией 1,25ммоль/л. Вычислите порог коагуляции и коагулирующую способность электролита.
Решение. Для расчета порога коагуляции воспользуемся формулой:
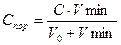 ,
,
Применительно к данной задаче 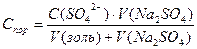 ;
;
Где С(SO42-) = C(Na2SO42-) = 1,25ммоль/л = 1,25·10-3моль/л
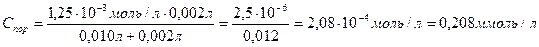 Величину коагулирующей способности вычисляют по формуле:
Величину коагулирующей способности вычисляют по формуле:
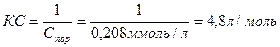
Ответ: Спор=0,208ммоль/л, КС = 4,8л/моль
Пример 34. Для коагуляции золя хлорида серебра, полученного при недостатке нитрата серебра, использовались растворы хлоридов калия, железа (III) и магния. Какой из них будет иметь наиболее низкий порог коагуляции? почему?
Решение. Мицелла в данном случае несёт отрицательный заряд, поэтому коагуляция вызывается катионом. Чем выше заряд катиона - тем ниже порог коагуляции. Следовательно, самый низкий порог будет у хлорида железа(III).
Пример 35. Порог коагуляции отрицательно заряженного гидрозоля As2S3 под действием KCl равен 4,9*10-2 моль/л. С помощью правил Шульца-Гарди и Дерягина-Ландау для этого золя рассчитайте пороги коагуляции, вызываемой следующими электролитами: K2SO4, MgCl2, MgSO4, AlCl3 и Al2(SO4)3.
Решение. Согласно правилу Шульца-Гарди, теоретически обоснованному Дерягиным и Ландау, порог коагуляции обратно пропорционален заряду противоиона в шестой степени. Для KCl (заряд K = +1) порог составляет 4,9*10-2 моль/л K2SO4 – противоион тот же, порог тот же. Для MgCl2, MgSO4 – противоион Mg2+ , порог равен 4,9*10-2/26 = 7,6*10-4. AlCl3 и Al2(SO4)3 – противоион Al3+ , порог равен 4,9*10-2/36 = 6.7*10-5.
Пример 36. В электрическом поле гранула золя карбоната железа перемещается к аноду(+). Напишите формулу мицеллы золя, если он был получен смешиванием растворов нитрата железа и карбоната калия. Одинаковы ли исходные концентрации электролитов, если объемы растворов одинаковы?
Решение. {n[FeCO3] · mCO32- · (m-2x)K+}2x-2xK+
Концентрации разные (концентрация карбоната калия выше, чем соли железа).
Пример 37. Коагулирующая способность сульфата натрия по отношению к данному коллоидному раствору выше коагулирующей способности хлорида кальция. Как заряжены частицы золя?
Решение. По правилу Шульце-Гарди коагулирующая способность электролита тем выше, чем больше заряд коагулирующего иона. У Na2SO4 заряд анионов (SO42-) больше, чему CaCl2 (ионов Cl-), значит, коагулирующими ионами являются анионы. Следовательно, частицы коллоидного раствора заряжены положительно.
Пример 38. Коллоидный раствор иодида серебра получен при некотором избытке KI по реакции:
KI + AgNO3 = AgI + KNO3
Его коагулируют растворами сульфата натрия и ацетата кальция. У какого электролита коагулирующая способность выше?
Решение. Т.к. стабилизатором является KI (AgI→ Ag+ + I-), то мицелла имеет строение:
{m[AgI] · nI- · (n-x)K+}x- xK+
Коллоидная частица (гранула) заряжена отрицательно. Следовательно, коагулирующими ионами являются катионы. Т.к. заряд иона Са2+ больше заряда иона Na+, то коагулирующая способность ацетата кальция выше, чем сульфата натрия.
Пример 39. Какие золи: гидроксида железа(III) (при избытке FeCl3), иодида серебра (при избытке AgNO3), иодида серебра (при избытке KI), следует смешать, чтобы произошла взаимная коагуляция?
Решение. Взаимная коагуляция возможна при смешивании золей с противоположными знаками заряда гранул. Гранулы золя гидроксида железа (III) заряжены положительно
{m[Fe(OH)3] · nFe3+ · 3(n-x)Cl-}3x+
Гранулы золя иодида серебра при избытке AgNO3 (потенциалопределяющие ионы Ag+) заряжены положительно: {m[AgI] · nAg+ · (n-x)NO3-}x, а при избытке KI (потенциал-определяющие ионы I- ) заряжены отрицательно: {m[AgI] · nI- · (n-x)K+}x-.
Следовательно, взаимная коагуляция возможна при сливании золей а) гидроксида железа(III) и иодида серебра при избытке KI, и б) иодида серебра (при избытке AgNO3) и иодида серебра (при избытке KI).
Типовые задачи.
36. Коагуляция 1,5 мл золя сульфида золота наступила при добавлении к нему 570 мл раствора хлорида натрия концентрацией 0,2 моль/л. Вычислите порог коагуляции золя ионами натрия и коагулирующую способность электролита.
37. Частицы золя при электрофорезе перемещаются к аноду. Коагулирующая способность какого из веществ: Na2SO4, CaCl2 или K3PO4 – будет наибольшей по отношению к данному золю? Дайте пояснения.
38. Получены два золя иодида серебра из раствора AgNO3 и KI с молярными концентрациями по 0,05моль/л каждый. Один золь получен приливанием раствора AgNO3 объемом 16мл к раствору KI объемом 20мл, другой раствора KI объемом 16мл к раствору AgNO3 объемом 20мл. Будут ли наблюдаться какие-либо явления при смешивании этих золей? Ответ мотивируйте. Напишите формулы мицелл золя.
39. Золь кадмия сульфида получен смешиванием растворов Na2S и Cd(NO3)2. Пороги коагуляции электролитов к данному золю оказались равными (ммоль/л): Спор(Ca(NO3)2)=265, Cпор (NaCl) = 250, Cпор (MgCl2) = 290, Cпор (Na3PO4) = 0,4, Cпор (Na2SO4) = 15, Cпор (AlCl3) = 300. Какой из электролитов Na2S или Cd(NO3)2, взят в избытке для получения золя? Составьте схему строения мицеллы золя.
|
из
5.00
|
Обсуждение в статье: Тема 10. Коллоидные растворы. Строение мицеллы. Коагуляция |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

