 |
Главная |
Аналитические реакции сурьмы (III).
|
из
5.00
|
Соли сурьмы гидролизуются в водных растворах с образованием осадков малорастворимых основных солей сурьмы.
Соединения сурьмы окрашивают пламя газовой горелки в голубой цвет.
Реакции с щелочами и раствором аммиака:
Na[SbCl4] + 3 NaOH- → Sb(OH) 3 ↓ + 4 NaCl
[SbCl4]- + 3 OH- → Sb(OH) 3 + 4 Cl-
Na[SbCl4] + 3 NH3∙H2O → Sb(OH) 3 ↓ ( белый )+ 3 NH 4 Cl + NaCl
[SbCl4]- + 3 NH3∙H2O → Sb(OH) 3 ↓ ( белый )+ 3 NH 4 Cl +Cl-.
· Осадок Sb(OH)3 растворяется в щелочах (NaOH):
Sb(OH)3 + NaOH →Na [Sb(OH) 4 ]-
Sb(OH)3 + OH- → [Sb(OH) 4 ]-
и в кислотах:
Sb(OH)3 + 4H С l → [SbCl 4 ]- + H+ + 3 H2O
При действии щелочи в присутствии Н2О2 сурьма (III) окисляется до сурьмы (V), давая белый осадок
SbO(OH)3:
Sb ( OH )3 + H 2 О2 → SbO ( OH ) 3 + H 2 О
3. Реакция гидролиза.
SbCl3 + 2H2O = Sb(OH)2Cl +2HCl
Sb3+ + H2O + Cl- = SbOCl ↓ ( белый хлопьевидный ) + 2 H +
при рН≈ 3-4.
· Свежевыпавший осадок оксохлорида сурьмы растворяется (лучше – при нагревании) в растворах HCl, винной кислоты Н2С4Н4О6 и ее солей:
SbOCl+ 2 HСl + Cl- → [SbСl 4 ]- + H2O (обратная реакция)
SbOCl + Н2С4Н4О6 = [SbO(С4Н4О6)]- + HСl + H+.
3.Реакция с тиосульфатом натрия.
3SbCl3 + 3 Na2S2O3 + 3H2O = Sb2S3↓ (оранжевый осадок) + 3H2SO4 + 6NaCl
3 Sb3++ 3 S2O32- 3H2O= Sb2S3↓ (оранжевый осадок) = 6Н++ SO42-
4. Реакция с сульфид – ионами:
2 Na[SbCl4] +3 Н 2 S → Sb 2 S3 ↓ ( оранжевый ) + 2 NaCl + 6HCl
2 [Sb С l4]- + 3 S2- → Sb 2 S3 ↓ ( оранжевый ) + 8 Cl -
· Осадок растворяется в избытке S2-:
Sb2S3 + 3 S2- → 2 SbS 3 3- ,
· в концентрированной HCl при нагревании:
Sb2S3 +8 HCl → 2 H[Sb С l 4 ] + 3 H2S,
· в растворах щелочей:
Sb2S3 +4 NaOH → Na[Sb(OH) 4 ] + Na3SbS3
5. Реакции восстановления сурьмы (III) до сурьмы (0) в кислой среде:
Na[Sb С l4] + Al0 → Sb 0 + AlCl3+ NaCl
[Sb С l4]- + Al0 → Sb 0 + Al3+ + 4 Cl-;
При взаимодействии сурьмы (III) с фосфорно – молибденовой гетерополикислотой образуется продукт реакции синего цвета – «молибденовая синь», экстрагируемый амиловым спиртом. С метилфлуороном С13Н4О2(ОН)3СН3 сурьма (III) в присутствии Н2О2 и HCl дает продукт красного цвета (капельная реакция на фильтровальной бумаге). Такие окислители, как KMnO4, K2Cr2O7, KВrO3 и другие, окисляют в растворах сурьму (III) до сурьмы (V).
Аналитические реакции сурьмы (V).
1. Реакция с щелочами и аммиаком:
Na [SbСl6] + 5 Na OH → SbО(OH) 3 ↓ (белый) + 6 Na Cl + H2О
[ Sb С l 6 ]- + 5 OH - → Sb О( OH ) 3 ↓ (белый) + 6 Cl - + H 2 О
· Осадок растворяется в избытке щелочи:
SbО(OH)3 + NaOH + H2О → Na[Sb(OH) 6 ],
· а также в сильных кислотах:
SbО(OH)3 +6 HCl → H[SbСl 6 ] + 4H2О
2. Реакция гидролиза:
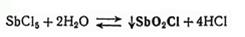
Sb5++Cl- + 2H2O = SbO2Cl
· Осадок растворяется в избытке HCl и в растворах винной кислоты и ее солей.
3. Реакция с сульфид – ионами.
Реакция проводится в кислой среде:
2Na[SbС l6]-+ 5H2S → Sb2S5 ↓(оранжевый ) + 2NaCl + 10 HCl
2[SbС l6]- + 5S2- → Sb2S5 ↓(оранжевый ) + 12Cl-
· Осадок растворяется в избытке S2-:
Sb2S5 + 3 S2- → 2 SbS43-,
растворяется в щелочах:
2 Sb2S5 + 6 NaOH = Na[Sb(OH)6] + 5 NaSbS3,
· в концентрированной HCl (при нагревании) с выделением свободной серы и восстановлением сурьмы (V) до сурьмы (III):
Sb2S5 + 8 HCl → 2 H[SbС l4] +3 Н 2 S +2 S↓
4. Реакция восстановления Sb(V) до Sb(0).
Сурьма (V), как и сурьма (III), восстанавливается в кислой среде металлическим магнием, цинком, алюминием, оловом, железом до свободной сурьмы (0).
[SbС l6]- + Al0 → Sb0 + Al3+ + 6 Cl-;
[SbС l6]- + Zn0 → Sb + Zn2+ + 6 Cl-
Признаки реакции: Поверхность металла чернеет вследствие выделения осадка свободной сурьмы.
5. Реакция с родамином Б.
Сурьма (V) в солянокислых растворах реагируют с органическим реагентом – родамином Б (условно как L+Cl-):
L+Cl- + [SbС l6]- = L+[SbС l6]- + Cl-
Признаки реакции: образуется сине-фиолетовое соединение (ионного ассоциата) состава L+[SbСl6]-
Образовавшийся ионный ассоциат экстрагируется из водной фазы бензолом или изопропанолом, при этом органический слой окрашивается в фиолетово-синий цвет.
6. Реакция с иодидами:
2I- + [SbСl6]- → [SbСl4] - + I2 + 2Cl- (определяют I2)
55.Аналитические реакции катионов VI группы по кислотно – основной классификации ( Cu 2+ , Cd 2+ , Hg 2+ , Co 2+ , Ni 2+ ).
Аналитические реакции катионов меди(II) С u 2+ .
Акво-ионы меди(II) [Cu(H2O)n]2+ окрашены в голубой цвет, поэтому растворы солей меди(II) имеют голубую окраску с разными оттенками (от голубой до сине-зеленой). В водных растворах акво-ионы меди(II) частично гидро-лизуются с образованием растворимых гидроксоаквокомплексов состава [Сu(Н2O)n-m(OH)m]2-mпо схеме:
[Сu(Н2O)n]2+ +mH2O = [Cu(H2O)n.m(OH)m]2-m + mH3O+
Реакция с щелочами.При прибавлении раствора щелочи к раствору соли меди(II) выпадает осадок гидроксида меди(II) Си(ОН)2, имеющий окраску от сине-зеленой до голубой:
CuSО4 + 2КОН → Сu(ОН)2↓ + K2SO4
Cu2++2OH-→Сu(ОН)2
При кипячении смеси раствора с осадком гидроксид меди(II) разлагается, теряя воду, до черного оксида меди(II) СuО:
Сu(ОН)2 → СuО + Н2O
Осадок Сu(ОН)2 растворяется в кислотах, в растворах аммиака (с образованием комплекса [Cu(NH3)4]2+ синего цвета), комплексообразующих органических кислот (лимонная, винная), частично растворим в концентрированных щелочах с образованием гидроксокомплексов меди(II).
Реакция с аммиаком (фармакопейная).При прибавлении раствора аммиака к раствору, содержащему соль меди(II), вначале выпадает осадок основной соли меди (сине-зеленого цвета), который растворяется в избытке аммиака с образованием комплексного катиона [Cu(NH3)4]2+ ярко-синего цвета. Так, из раствора хлорида меди(II) СuСI2 аммиак осаждает голубой оксихлорид меди(II) Сu(ОН)Сl:
CuCl2 + NH3. Н2O → Cu(OH)Cl + NH4CI
Cu2+ + Cl- + OH-→ Cu(OH)Cl
В избытке аммиака осадок растворяется:
Cu(OH)Cl + 4NH3. H2O → [Cu(NH3)4]2+ + ОН- + СI- + 4Н2O
Раствор окрашивается в ярко-синий цвет.
В кислой среде комплексный тетрамминмедь(II)-катион разрушается:
[Cu(NH3)4]2+ + 4Н3O+ → [Cu(H2O)4]2+ + 4NH4+
и окраска раствора из ярко-синей переходит в голубую (цвет аквокомплекса меди(II)).
Мешают катионы Со2+, Ni2+, олово(II).
Реакция с гексацианоферратом ( II ) калия.Катионы Сu2+ образуют с ферроцианидом калия K4[Fe(CN)6] в слабокислой среде красно-коричневый осадок гексацианоферрата(II) меди Cu2[Fe(CN)6]
2CuCl2 + K4 [Fe(CN)6 ] → Cu2 [Fe(CN)6 ]↓ + 2К2SO4
2Cu2+ + [Fe(CN)6]4- → Cu2[Fe(CN)6]
Осадок не растворяется в разбавленных кислотах, но растворяется в 25%-м водном аммиаке:
Cu2[Fe(CN)6] + 12NH3 + 4Н2O → (NH4)4[Fe(CN)6] + 2[Cu(N3)4](OH)2
Мешают катионы, также образующие окрашенные осадки ферроцианидов (Fe3+, Со2+, Ni2+).
Реакцию катионов меди(II) с ферроцианидом калия можно проводить капельным методом на фильтровальной бумаге.
Реакция с тиосульфатом натрия.При кипячении смеси подкисленного раствора соли меди(II) с избытком тиосульфата натрия Na2S2O3 происходит восстановление меди(II) до меди(I) с образованием сульфида меди(I) Cu2S. В результате выпадает темно-бурый осадок, представляющий собой смесь сульфида меди(1) Cu2S и свободной серы. Реакция, по-видимому, протекает по схеме:
2CuCl2 + 2Na2 S2O3 + 2Н2O → Cu2S ↓+ S + 4НCl+ 2Na2SO4
2Cu2+ + 2S2O32- + 2Н2O → Cu2S + S + 4Н+ + 2SO42-
В литературе встречаются и другие схемы, описывающие эту реакцию.
Реакция с купроном (1-бензоиноксимом).Катионы Сu2+ при взаимодействии с органическим реагентом — купроном (обычно в аммиачной среде) образуют хлопьевидный зеленый осадок внутрикомплексного соединения состава CuL. 2H2O, где H2L — условное обозначение купрона — 1-бензоиноксима:

Реакция протекает по схеме:
Cu2+ + H2L + 2Н2O → CuL(H2O)2 + 2Н+
Протоны, очевидно, отщепляются от обеих гидроксильных групп молекулы купрона. Осадок не растворяется в избытке аммиака.
Реакцию можно проводить капельным методом на фильтровальной бумаге. Предел обнаружения ~0,1 мкг.
Реакция восстановления меди ( II ) металлами до металлической меди (фармакопейная). Металлы, расположенные в ряду напряжений металлов левее меди, восстанавливают катионы меди(II) Сu2+ до металлической меди. Чаще всего для этого применяют металлические алюминий, цинк, железо. При внесении этих металлов в растворы солей меди(II) поверхность металлов покрывается тонким слоем выделяющейся металлической меди красноватого цвета:
CuCl2 + Zn → Cu + ZnCl2
Cu2+ + Zn → Cu + Zn2+
Cu2+ + Fe → Cu + Fe2+
3Cu2+ + 2Al → 3Cu + 2Al3+
Окрашивание пламени газовой горелки.Соли меди окрашивают пламя газовой горелки в изумрудно-зеленый цвет.
Аналитические реакции катиона кадмия Cd 2+ .
Акво-ионы кадмия [Cd(H2O)n]2+ в водных растворах бесцветны.
Реакция с щелочами и аммиаком.При прибавлении раствора щелочи или аммиака к раствору соли кадмия выпадает белый осадок гидроксида кадмия:
CdCl2 + 2NaOH → Cd(OH)2+ 2NaCl
Cd2+ + 2OH- → Cd(OH)2
Осадок нерастворим в избытке щелочи, но растворяется в избытке аммиака с образованием бесцветного аммиачного комплекса [Cd(NH3)4]2+:
Cd(OH)2 + 4NH3 → [Cd(NH3)]2+ + 2OH-
Осадок гидроксида кадмия растворяется в кислотах:
Cd(OH)2 + 2Н3O+ → [Cd(H2O)4 ]2+
Реакция с сульфид-ионами.Катионы Cd2+ образуют с сульфид-ионами S2- в слабо кислых или щелочных растворах желтый осадок сульфида кадмия CdS:
CdCl2 + Na2S → CdS + 2NaCl
Cd2+ + S2- → CdS
Осадок нерастворим в щелочах и в растворе сульфида натрия, частично растворяется в насыщенном растворе хлорида натрия с образованием хлоридного комплекса кадмия [CdCl4]2-:
CdS+ 4Cl-→ [CdCl4]2- + S2-
Сульфид кадмия нерастворим в кислотах, за исключением НСI, в которой он растворяется с образованием хлоридного комплекса кадмия:
CdS + 4HCl→ H2[CdCl4] + H2S
Аналитические реакции катиона ртути (II) Hg2+.
Акво - ионы ртути (II) [Hg(H2O)n]2+ в водных растворах бесцветны. Все соединения ртути (II) сильно ядовиты, поэтому при работе с ними следует принимать меры предосторожности!
Реакция с щелочами (фармакопейная).
3. Hg Cl 2 + 2 Na OH → HgO↓(желтый) + Н2О + NaCl
Hg2+ + 2 OH- → HgO↓(желтый) + Н2О
Растворение осадка
· Осадок HgO растворяется в азотной кислоте, в растворах хлоридов и иодидов щелочных металлов с образованием соответственно Hg(NO3)2, HgCl2 и комплекса [HgI4]2-:
HgO + 2 HNO3 → Hg(NO3)2 + H2O
HgO +2 Cl- + H2O → HgCl2 + 2 OH-
HgO +4 I- + H2O → [HgI4]2- + 2 OH-
2. Реакция с аммиаком .
HgCl2 + 2 NH3 → HgNH2Cl↓( белый ) + NH4Cl
2 Hg(NO3)2 + 4 NH3 + H2O → [O Н g2NH2]NO3↓( белый ) + 3 NH4NO3
· Осадки растворяются (лучше – при нагревании) в избытке аммиака; но только в присутствии солей аммония, с образованием бесцветного комплексного катиона тетрамминртути (II) [Нg(NH3)4]2+.
· После выпадения осадков в пробирки добавляют по 3-4 капли водного раствора соли аммония (NH4Cl или NH4NO3) и по каплям – водный раствор аммиака при перемешивании до полного растворения осадков:
HgNH2Cl + 2 NH3 + NH4+ → [ Н g(NH3)4]2+ + Cl-
[O Н g2NH2]NO2 + 4 NH3 +3 NH4+ → 2 [ Н g(NH3)4]2+ +NO3- + H2O
3. Реакция с иодидом калия (фармакопейная).
HgCl 2 + 2 KI → HgI 2 ↓(красный) + 2 KCl
Hg2+ + 2 I- → HgI2↓(красный)
HgI 2 + 2 I - → [ HgI 4 ]2- (бесцветный)
4. Реакция с сульфид - ионами (фармакопейная).
Реакция протекает в несколько стадий. Вначале образуется белый осадок, постепенно изменяющий окраску через желто – красную и бурую на коричнево-черную при избытке сульфид – ионов.
3 HgCl2 + 2 H2S → 2 HgS * HgCl2↓(белый) + 4 HСl
2 HgS * HgCl2 + H2S → 3 HgS↓(коричнево-черный) + 2 НСl
Аналогично протекает реакция HgCl2с сульфидом натрияNa2S.
· HgSне растворяется в разбавленной азотной кислоте, но растворим в царской водке (смесьHCl+HNO3).
3 HgS +6 H С l + 2 HNO3 → 3 HgCl2 + 2 NO + 3S + 4 H2O
5. Реакция с хлоридом олова (II).
Катионы Hg2+восстанавливается олово (II) вначале доHg22+, а затем – до металлической ртутиHg0.
2 Hg2+ + [SnCl4]2- + 4 Cl- → Hg2Cl2↓(белый) + [SnCl6]2-
Hg2Cl2 + [SnCl4]2- → 2 Hg0 (темный) + [SnCl6]2-
6. Реакция с металлической медью.
Катионы Hg2+восстанавливаются металлической медью до металлической ртути.
Hg2+ + Cu0 → Hg0 (темный) + Cu2+
Признаки реакции: На медную поверхность наносят каплю раствора соли ртути (II). На поверхности возникает темное пятно, которое при протирании фильтровальной бумагой становится серебристо-блестящим.
7. Реакция с хромат – ионами.
Hg2+ + CrO42- → HgCrO4↓(желтый)
Катионы Hg2+ с ортофосфат – ионами образуют белый осадок Hg3(PO4)2; с дифенилкарбазидом и дифенилкарбазоном – комплекс сине-фиолетового цвета; с дитизоном – желто-оранжевый или красный комплекс, в зависимости от условий проведения реакции .
Аналитические реакции катионов кобальта (II) С o 2+
Акво-ионы кобальта(II) октаэдрической конфигурации [Со(Н2O)6]2+ окрашены в розовый цвет, поэтому разбавленные водные растворы солей кобальта(II) также имеют розовую окраску. Однако при упаривании водных растворов солей кобальта(II) их фиолетовая окраска меняется на синюю, характерную для комплексов кобальта(II) тетраэдрической структуры.
Соединения кобальта(II) сравнительно легко окисляются до соединений кобальта(III), причем в ряде случаев — уже кислородом воздуха (растворенным в воде), что необходимо учитывать при проведении качественных реакций на кобальт(II). В водных растворах кобальт(II) и кобальт(III) присутствуют исключительно в форме комплексных соединений. Комплексы кобальта(III) устойчивее комплексов кобальта(II), хотя известны и стабильные комплексы кобальта(II).
Реакция с щелочами.Катионы Со2+ при реакции с щелочами вначале образуют синий осадок гидроксосоли кобальта(II) (например, CoOHCI), которая затем переходит в розовый осадок гидроксида кобальта(II) Со(ОН)2. Так, при взаимодействии хлорида кобальта(II) со щелочью реакция протекает по схеме:
СоС12 + NaОН- → CoOHCI+NaСI
СоС12 + ОН- → CoOHCI+СI- синий
CoOHCI + ОН- → Со(ОН)2 + СI- розовый
Розовый гидроксид кобальта(II) Со(ОН)2 медленно буреет вследствие окисления кислородом воздуха до черно-бурого гидроксида кобальта(III) состава Со(ОН)3:
2Со(ОН)2 + 0,5О2 + Н2O → 2Со(ОН)3
Если к розовому осадку Со(ОН)2 прибавить пероксид водорода Н2O2, то реакция окисления Со(ОН)2 в черно-бурый Со(ОН)3 протекает практически мгновенно:
2Со(ОН)2 + Н2O2 → 2Со(ОН)3
Действие смеси Н2O2 со щелочью на раствор соли кобальта(II) сразу приводит к образованию черно-бурого осадка Со(ОН)3:
2СоСI2 +4OН- + Н2O2 → 2Со(ОН)з +4СI-
Реакция с аммиаком.IIри реакции катионов Со2+ с аммиаком также вначале образуется синий осадок основной соли. Дальнейшее прибавление раствора аммиака приводит к растворению осадка с образованием гексамминкобальт(II)-катионов [Со(NH3)6] грязно-желтого цвета (раствор — желтого цвета):
СоСI2 + NH3. Н2O → CoOHCI + NH4CI
CoOHCl + 5NH3 + NH4CI → [Co(NH3)6 ]CI2 + H2O
На воздухе раствор постепенно принимает вишнево-красный цвет вследствие окисления кобальта(II) до кобальта(III) с образованием хлоропентамминкобальт(III)-анионов [Co(NH3)5CI]2- вишнево-красного цвета:
2[Co(NH3)6]CI2 + O2 + 2Н2O → 2[Co(NH3)5CI](OH)2 + 2NH3
В присутствии пероксида водорода и солей аммония реакция окисления [Co(NH3)6]2+ до [Co(NH3)5CI]2+ протекает практически мгновенно:
2[Co(NH3)6]CI2 + Н2O2 + 2NH4CI → 2[Co(NH3)5CI]CI2 + 4NH3 + 2Н2O
Реакция с тиоцианат-ионами.Катионы Со2+ в слабо кислой среде реагируют с тиоцианат-ионами NCS" с образованием синего комплекса — тетратиоцианатокобальтат(11)-иона [Co(NCS)4]2~:
СоCl2 + 4NH4 SCN ↔(NH4)2 [Co(NCS)4 ]+ 2 NH4Cl
Co2+ + 4SCN-→ [Co(SCN)4] 2-
Комплекс в водных растворах неустойчив и равновесие комплексообразования смещено влево в сторону образования розового аквокомплекса кобальта(II). Поэтому реакцию проводят при избытке тиоцианат-ионов, чтобы сместить равновесие вправо.
Реакция с сульфид-ионами.Катионы Со2+ при реакции с сульфид-ионами образуют черный осадок сульфида кобальта(II) CoS:
СоCl2 + NaS2→ CoS + 2 NaCl
Со2+ + S2- → CoS
Свежевыпавший осадок CoS растворяется в минеральных кислотах, однако при стоянии он превращается в форму, трудно растворимую в разбавленной НСI, но растворимую в кислотах в присутствии окислителей.
Реакция с солями цинка — образование «зелени Ринмана».Если на листок фильтровальной бумаги нанести несколько капель раствора нитрата цинка Zn(N03)2 и несколько капель раствора нитрата кобальта Co(NO3)2, после чего листок подсушить и озолить (например, поместить его в фарфоровый тигель и внести в пламя газовой горелки), то образуется зола зеленого цвета — «зелень Ринмана» состава CoZnO2:
Zn(NO3)2 + Co(NO3)2 →CoZnO2 + 4NO2 + O2
Реакция с 1-нитрозо-2-нафтолом — реактивом Ильинского).Кобальт(II) в этой реакции вначале окисляется до кобальта(III), который с 1-нитрозо-2-нафтолом образует внутрикомплексное соединение, выделяющееся в виде пурпурно-красного осадка. Если 1-нитрозо-2-нафтол, который в растворе может существовать, как полагают, в двух таутомерных формах, условно обозначить через HL

то реакцию можно описать схемой (после окисления кобальта(II) до кобальта(III)):
Co3++3HL → CoL3+2H+
Реакцию проводят в нейтральной или слабо кислой среде. Мешают катионы меди(II) Сu2+.
Реакция с нитрозо-Я-солью (фармакопейная). Нитрозо-R-соль, которую, как и реактив Ильинского, можно представить в двух таутомерных формах

при взаимодействии с кобальтом(III), возникающем в кислой среде вследствие окисления кобальта(II) до кобальта(III), образует внутрикомплексное соединение состава СоL3' (HL' — условное обозначение молекулы нитрозо-R-соли, как указано в вышеприведенной схеме) красного цвета:
Co3++3HL' = CoL'3 + 3H+
Реакцию проводят в кислой среде при нагревании. Раствор окрашивается в красный цвет. При достаточно больших концентрациях из раствора выпадает красный осадок внутрикомплексного соединения.
Реакция довольно чувствительна: предел обнаружения равен 0,05 мкг.
Аналитические реакции катионов никеля(II) Ni 2+ .
Аквокомплексы никеля(II) [Ni(H2O)6]2+ окрашены в зеленый цвет, поэтому водные растворы солей никеля(II) имеют зеленую окраску. В растворах никель(II) присутствует только в форме комплексных соединений.
Реакция с щелочами.Катионы никеля(II) Ni2+ осаждаются щелочами из водных растворов в виде малорастворимого гидроксида никеля(II) Ni(OH)2 зеленого цвета:
Ni(NO3)2+ 2NaOH → Ni(OH)2+ 2NaNO3
Ni2+ + 2OH- → Ni(OH)2
Осадок растворяется в растворах кислот и аммиака:
Ni(OH)2 + 2Н+ → Ni2+ + 2Н2O
Ni(OH)2 + 6NH3 → [Ni(NH3)6]2+ + 2OН-
Реакция с аммиаком.Аммиак осаждает из растворов солей никеля(II) светло-зеленые осадки оксисолей никеля(II), например:
Ni(NO3)2 + NH3.Н2O → NiOHNO3 + NH4NO3
NiCl2 + NH3. H2O → NiOHCI + NH4CI
2NiSO4 +2NH3 . H2O → (NiOH)2SO4 +(NH4)2SO4ит. д.
В избытке аммиака осадки оксисолей никеля(II) растворяются с образованием комплексных гексамминникель(II)-катионов синего цвета, например:
NiOHCI + 6NH3 → [Ni(NH3)6]2+ + ОН- + СI-
Гексамминникель(II)хлорид [Ni(NH3)6]CI2, гексамминникель(II)нитрат [Ni(NH3)6](NO3)2, гексамминникель(II)сульфат [Ni(NH3)6]SO4 хорошо растворяются в воде. Некоторые другие гексааммиакаты никеля(II), такие, как фиолетовый гексамминникель(II)бромид [Ni(NH3)6]Br, голубой гексамминникель(II)перхлорат [Ni(NH3)6](CIO4)2, в воде малорастворимы.
Методика. В пробирку вносят 2—3 капли раствора хлорида никеля(II) NiCI2, (или нитрата Ni(NO3)2, или
Реакция с диметилглиоксимом (реактивом Чугаева).Катионы Ni при реакции с диметилглиоксимом (реактивом Чугаева) при рН ≈ 6—9 образуют малорастворимое в воде внутрикомплексное соединение розово-красного цвета — бис-диметилглиоксиматоникелы(II) (старое название — «никельдиметилглиоксим»):
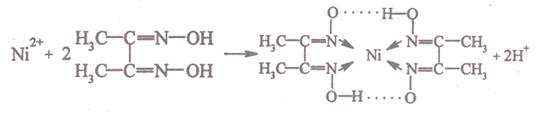
(здесь точками обозначены водородные связи О . . . . . Н).
Обычно реакцию проводят в среде аммиака.
Осадок растворяется в сильных кислотах и щелочах, нерастворим в растворах аммиака.
Катионы кобальта(II) в малых концентрациях не мешают определению никеля. Мешают катионы Сu2+, Pb2+, Fe2+, Fe3+. Разработаны методики для устранения их мешающего действия.
Эта реакция, впервые предложенная Л. А. Чугаевым, является наиболее характерной на катионы никеля(II) и высокочувствительной: предел обнаружения равен 0,16 мкг, предельное разбавление — 3.105 мл/г. Чувствительность реакции повышается в присутствии небольших количеств окислителей (бром, иод и др.), переводящих никель(II) в никель(III), комплекс которого с диметилглиоксимом имеет еще более интенсивную окраску.
|
из
5.00
|
Обсуждение в статье: Аналитические реакции сурьмы (III). |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

