 |
Главная |
Кинетические параметры
|
из
5.00
|
Кинетическая кривая. Флуоресцентные красители обеспечивают флуоресценцию, прямо пропорциональную количеству ПЦР-продукта - репортерную флуоресценцию. Механизмы генерации репортерной флуоресценции различаются в зависимости от типа real-time PCR.
Кинетическая кривая PCR в координатах "Уровень репортерной флуоресценции — цикл амплификации" имеет сигмоидную форму (Рис. 5).
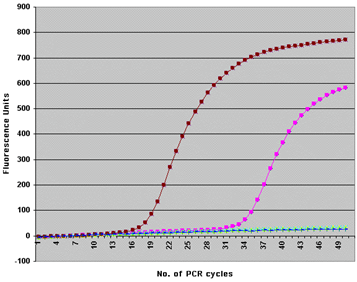
Рис 5. Пример кинетических кривых RealTime PCR (по материалам www.molbiol.ru).
В ней можно выделить три стадии:
1. Стадию инициации (когда PCR-продукты еще не детектируется флуоресцентной меткой).
2. Экспоненциальную стадию (в которой наблюдается экспоненциальная зависимость количества флуоресценции от цикла PCR).
3. Плато (стадию насыщения).
Экспоненциальная стадия PCR описывается уравнением:
Pn = P0 * E n (1) ( www.molbiol.ru),
где Pn - количество молекул продукта/репортерной флуоресценции к циклу n, P0 - исходное количество молекул, содержащих амплифицируемый фрагмент (template), E - эффективность амплификации. В идеальных условиях E = 2, т.е. на каждом цикле цепной реакции происходит удвоение количества продукта.
Прологарифмируем обе части уравнения 1 и преобразуем его к виду:
n = - (1/log E) * log P0 + log Pn/log E (2) ( www.molbiol.ru)
Назовем пороговым циклом (threshold cycle, C(T)) такой цикл n, на котором достигается некий заданный уровень репортерной флуоресценции - пороговая флуоресценция PC(T)=const. Для n=C(T) уравнение 2 принимает вид:
C(T) = - (1/log E) * log P0 + log PC(T)/log E (3) ( www.molbiol.ru),
т.е. значение С(T) прямо пропорционально логарифму количества субстрата (по материалам www.molbiol.ru).. Таким образом, real-time PCR позволяет сравнивать количества субстрата при условии, что эффективность реакции и заданный уровень пороговой флуоресценции одинаковы для каждой из сравниваемых реакций [19].
Базовый уровень флуоресценции. Это тот уровень флуоресценции, который наблюдается в реакционной смеси до появления репортерного сигнала. Как правило, управляющие программы real-time PCR позволяют задать базовый уровень несколькими способами. Необходимо выбрать такой способ, при котором:
1. Обеспечивается минимальный уровень флуоресценции до появления репортерного сигнала.
2. Начало экспоненциальной фазы детектируется с наибольшей точностью.
В общем случае, базовую линию следует выбирать как среднее значение флуоресценции в достаточно широком диапазоне циклов до появления репортерной флуоресценции (т.е. до начала детекции экспоненциальной фазы). При выборе диапазона желательно также избегать и циклы вне экспоненциальной фазы, в которых наблюдаются скачки флуоресценции.
Для SYBR Green, как правило, хорошо работает расчет базового уровня по среднему значению в диапазоне циклов с 3 по 7 (первые 2 цикла не влючают в диапазон, поскольку на них может наблюдаться более сильная флуоресценция из-за недостаточно стабилизировавшейся реакции).
Более осторожно нужно выбирать базовую линию при TaqMan амплификации, поскольку к началу PCR в смеси может наблюдаться довольно высокий уровень флуоресценции от "сломанных проб" (в которых произошла диссоциация маркера от тушителя). Если "сломанные пробы" не превалируют, это не представляет большой опасности, и базовая флуоресценция постепенно сходит на нет (обычно к 3-7 циклу). Как уже было сказано выше, в таком случае начальный цикл диапазона нужно выбирать такой, в котором флуоресценция от "сломанных проб" уже достигла минимума.
В некоторых случаях флуоресценция от "сломанных" проб наблюдается и на более поздних стадиях PCR, к 20-25 циклу. Такой эффект нежелателен, поскольку он создает трудности при выборе базовой линии, что может привести к "маскировке" начала экспоненциальной фазы. В таком случае рекомендуется собирать реакцию заранее и инкубировать ее в холодильнике 1 час или более до добавления ДНК (если реакции инкубируются в темноте и при температуре около +4oC, максимальное время инкубации практически неограничено) [20].
Свидетельствами того, что базовый уровень выбран некорректно, являются:
1. Значительное "провисание" кривой флуоресценции ниже нулевого уровня.
2. Положительное значение флуоресценции в точке перегиба (т.е. начала экспоненциальной фазы).
"Провисание" часто является следствием включения в расчетный диапазон циклов, при которых уже наблюдается начало экспоненциальной фазы или, наоборот, начальная флуоресценция. Однако "провисание" может быть вызвано также и выбором слишком узкого диапазона циклов, так что разброс базовой флуоресценции в нем оказывается существенно меньше, чем в среднем по всем циклам.
Положительное значение флуоресценции в точке перегиба также обычно "исправляется" расширением диапазона циклов. Такой эффект также может наблюдаться, если расчет ведется по минимальным, а не по средним значениям диапазона.
Напомним, что вытекающая из уравнения (1) зависимость, отражаемая уравнением (3) позволяет сравнивать результаты различных экспериментов лишь при условии, что PC(T)= const. Таким образом, уровень пороговой флуоресценции PC(T) должен быть одинаков для всех сравниваемых образцов.
Пороговый уровень флуоресценции. Репортерная флуоресценция наиболее точно отвечает зависимости 3 в самом начале детекции экспоненциальной фазы. На более поздних этапах вклад стохастических эффектов в кинетику реакции становится все более значительным. Поэтому пороговый уровень флуоресценции выбирают в самом начале экспоненциальной фазы, когда стохастические процессы не столь велик.
Существует три основных способа выбора уровня пороговой флуоресценции:
а) на глаз;
б) по превышению над стандартным отклонением кинетической кривой;
в) по второй производной кинетической кривой.
При выборе "на глаз" за пороговый уровень выбирают минимальный уровень флуоресценции, который во всех проведенных с данной парой праймеров реакциях соответствует началу экспоненциальной фазы. Хотя пороговый уровень должен быть как можно ниже, при его достижении реакция должна уже "устаканиться" - на первом цикле экспоненциальной фазы погрешность определения репортерной флуоресценции обычно достаточно высока (в том числе и из-за того, что выбор baseline также имеет определенную погрешность). Обычно оптимальными являются пороговые уровни порядка 0.05-0.1 единиц флуоресценции, в зависимости от способа задания базовой линии и от того, как ведет себя реакция. Выбор "на глаз" является наиболее корректным с точки зрения уравнения 3, при условии, что базовая линия выбрана одинаково и измерения проводятся одновременно. Таким образом, с нашей точки зрения, им имеет смысл пользоваться, когда необходимо сравнить данные в одной плашке (или, в крайнем случае, нескольких экспериментов, выполненных с использованием одинаковых реактивов, субстратов, на одной и той же машине с небольшим промежутком времени) - например, при отладке реакции. При сравнении более разнородных данных определение "на глаз" будет некорректным. Принцип двух других методов состоит в том, чтобы стандартизировать выбор порога не по абсолютному значению, а по поведению кривой. Выбор порога по превышению над стандартным отклонением кинетической кривой - это установка порога таким образом, чтобы превышение порогового уровня над базовым уровнем (threshold над baseline) было достаточно малым, но уже статистически достоверным. Обычно выбирают значения в диапазоне 8-10 стандартных отклонений. Недостатком такого метода является то, что поскольку стандартное отклонение - это усредненная величина по всей кинетической кривой, в каких-то конкретных случаях порог может оказаться слишком низким (когда реакция еще не "устаканилась") или, наоборот, слишком высоким (когда уже наблюдаются какие-то отклонения). Этих недостатков лишен следующий метод выбора порога - по второй производной кинетической кривой. В таком случае, из всех скачков уровня флуоресценции за пороговый уровень выбирается наиболее резкий скачок - абсолютный максимум второй производной. Этот способ наименее чувствителен к способу выбора базовой линии и различиям условий реакции (по материалам www.molbiol.ru).
Анализ кривой плавления. Оценку качества реакции проводят по специфичности амплификации, определяемой из кривой плавления (для SYBR Green).Кривая должна быть построена в диапазоне температур от температуры отжига (при более низких температурах это делать не имеет смысла) до температуры полной денатурации - примерно 95OC. Для этого после окончания ПЦР реакционную смесь нагревают и непрерывно измеряют флуоресценцию. По достижении температуры плавления продукта амплификации флуоресценция резко снижается.
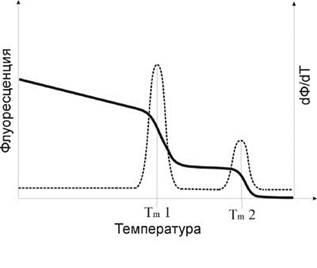
Рис. 6. Пример кривой плавления [7].
Каждое резкое уменьшение флуоресценции на графике соответствует числу полосок, получаемых на электрофорезе, то есть числу разных типов ампликонов. Для облегчения работы с полученной информацией проводят дифференциальный анализ кривой плавления. Такой способ визуализации полученных данных гораздо удобнее для понимания и анализа.
Применение кривых плавления не ограничивается только детекцией продуктов амплификации с помощью бромистого этидия и SYBR Green I. При использовании кривых плавления в системах с ДНК-зондами (Taq-man assay, beacons) возможно различать точечные мутации, расположенные внутри областей связывания ДНК-матрицы и зонда. Наличие таких мутаций способно привести к изменению температуры плавления зонда и к изменениям в графике кривой плавления [11]. Использование кривых плавления не требует от оператора амплификатора никаких дополнительных манипуляций с пробирками, а интерпретация полученных данных автоматизирована и формализована.
В идеальном случае, в реакциях с матрицей мы должны наблюдать один пик (соответствующий плавлению специфического продукта), а контроль "праймеры без ДНК" - слабые, затухающие стохастические колебания во всем диапазоне температур.
Обработка данных. Методы обработки данных real-time PCR основаны на применении уравнения (3).Основной принцип обработки данных Real-time PCR – это - метод калибровочного графика.
Этот метод предполагает построение калибровочного графика в координатах C(T) - log P0 с серией разведений ДНК-стандарта, из которого находят концентрацию субстрата (P0) в экспериментальных образцах.
Точность метода зависит от того, насколько условия PCR (и, прежде всего, эффективность амплификации) серии стандартов близки к условиям PCR экспериментальных образцов. Поэтому при выборе стандартов необходимо руководствоваться следующими правилами:
а) сдержание примесей в стандартном препарате должно быть сходно с таковым в экспериментальном препарате;
б) для амплифицируемого фрагмента в стандартной ДНК должна быть близка к таковой в экспериментальной ДНК;
в) серия разведений стандартной ДНК должна охватывать весь диапазон возможных концентраций субстрата в экспериментальной ДНК.
Если достаточно определить лишь относительную концентрацию субстрата, для построения калибровочного графика удобно использовать серию разведений одного из экспериментальных образцов. В тех случаях, когда образцы могут сильно отличаться по примесям и доле амплифицируемого фрагмента в реакционной смеси, имеет смысл при наладке эксперимента приготовить серию разведений каждого из них и сравнить эффективности.
В тех случаях, когда требуется оценить "абсолютное" количество субстрата, выбор стандартов для градуировочного графика представляет собой более сложную задачу, поскольку с одной стороны, необходимо знать точное число. Для определения количества матрицы в RT-PCR предложены следующие варианты стандартов:
1. очищенный RT-PCR-продукт;
2. рекомбинантная ДНК;
3. рекомбинантная РНК с последующей обратной транскрипцией;
4. синтетический олигонуклеотид, содержащий амплифицируемую последовательность.
При использовании очищенных препаратов в реакцию всегда необходимо добавлять неспецифические ДНК, чтобы приблизить условия реакции к экспериментальным. Для RT-PCR это могут быть, например, обратные транскрипты бактериальной РНК, polyA-РНК, тРНК или рРНК. Однако насколько бы условия реакции со стандартными образцами не были приближены к экспериментальным, "абсолютное" определение по-прежнему остается расчётом относительно стандарта.
|
из
5.00
|
Обсуждение в статье: Кинетические параметры |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

