 |
Главная |
Способы выражения концентрации.
|
из
5.00
|
Государственное образовательное учреждение
Высшего профессионального образования
« ПЕТЕРБУРГСКИЙ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ПУТЕЙ СООБЩЕНИЯ
МИНИСТЕРСТВА ПУТЕЙ СООБЩЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ»
Кафедра «Инженерная химия и естествознание»
Х И М И Я
Методические указания
К выполнению контрольных работ
Для студентов заочной формы обучения
Специальностей
ПТМ, ПТЭ, МТ, СЖД, ПГС, ВиВ, УПП, ЭУС, ЭУТ
Часть 2
САНКТ-ПЕТЕРБУРГ
2006
ХИМИЯ РАСТВОРОВ
Раствором называется термодинамически устойчивая гомогенная система переменного состава, состоящая из двух или более компонентов.
Компонентом называется химически однородная часть системы, способная существовать вне ее.
В дальнейшем все рассмотрения будут касаться двух компонентных растворов, состоящих из растворителя и растворенного вещества.
Тот компонент, который сохраняет свое агрегатное состояние, принимается за растворитель.
Если оба компонента сохраняют свое агрегатное состояние, то за растворитель принимается тот компонент, которого больше.
Согласно Д.И. Менделееву, образование раствора протекает в три стадии:
1. Дробление растворяемого вещества до отдельных молекул. Эта стадия требует энергетических затрат и ее тепловой эффект (ΔH1) положителен.
2. Сольватация. Процесс взаимодействия молекул растворяемого вещества с молекулами растворителя. Если растворитель вода, то этот процесс называется гидратация. На этой стадии энергия выделяется и ее тепловой эффект (ΔH2) отрицателен.
3. Диффузия сольватированных (гидратированных) молекул растворяемого вещества в толщу растворителя. На этой стадии тепловой эффект отсутствует.
Таким образом, тепловой эффект растворения складывается из двух величин (ΔH1 и ΔH2) и может быть как положительным, так и отрицательным в зависимости от соотношения первых двух стадий растворения т.е.:
ΔHраств = ΔH1 + ΔH2 1.1
Растворимость
Мерой растворимости вещества служит величина, называемая растворимость и обозначаемая Р. Ее определяют следующим образом: растворимость (Р) есть число грамм вещества способного раствориться в 100 граммах растворителя. Растворимость меняется с изменением температуры. Если ΔHраств >0, то с повышением температуры растворимость растет. Если ΔHраств <0, то с повышением температуры растворимость уменьшается.
С точки зрения растворимости все растворы делятся:
1. разбавленные, когда растворенного вещества в растворе меньше чем его растворимость;
2. насыщенные, когда количество растворенного вещества совпадает с его растворимостью;
3. пересыщенные, когда растворенного вещества в растворе больше чем его растворимость.
Как известно, все вещества растворяются по-разному:
1. Вещество считается хорошо растворимым или просто растворимым, если его растворимость больше или равна 1 (  ).
).
2. Вещество считается малорастворимым, если 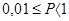 .
.
3. Вещество считается трудно растворимым, если  .
.
4. Вещество считается нерастворимым, если.  .
.
Способы выражения концентрации.
Однако, выше приведенные классификации растворов не дают количественной меры содержания вещества в растворах, особенно в разбавленных. Поэтому вводят понятие концентрации раствора.
Концентрацией раствора называется количество растворенного вещества, содержащегося в определенном объеме или массе раствора или растворителя.
Наиболее употребительными являются следующие способы выражения концентрации растворов:
1. Массовая доля. Она показывает отношение массы растворенного вещества к массе раствора. Если массовая доля выражена в процентах, то на практике ее называют процентной концентрацией. Она показывает, сколько грамм растворенного вещества содержится в 100 граммах раствора и обозначается - %
2. Моляльная или моляльность. Она показывает, сколько молей растворенного вещества приходится на килограмм растворителя. Чаще всего ее обозначают m и она имеет размерность М/кг или М/1000г.
3. Молярная или молярность. Она показывает, сколько молей растворенного вещества содержится в 1-ом литре раствора. Ее обозначают М и она имеет размерность М/л.
4. Нормальная или нормальность. Она показывает, сколько моль эквивалентов растворенного вещества содержится в литре раствора. Ее обозначают Н и она имеет размерность Моль Эквивалент/л (МЭ/л).
5. Мольная доля. Она показывает долю молекул данного сорта от общего количества молекул раствора. Ее обозначают xi . Индекс 1 всегда относится к растворителю. Сумма всех мольных долей раствора равна 1, т.е.:
 . 1.2
. 1.2
Однако, часто вместо xi для обозначения мольной доли используется Ni.
|
из
5.00
|
Обсуждение в статье: Способы выражения концентрации. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

