 |
Главная |
Атомистическая теория Дальтона.
|
из
5.00
|
Введение
Зарождение теории строения вещества
· Атомистическая теория Дальтона
· Модель атома Томсона
· Атом Резерфорда
· Атом Бора
Строение многоэлектронных атомов.
Периодический закон Менделеева.
Спектр
· Спектр излучения
· Спектр поглощения
Заключение
Список литературы
Введение.
Мысль о том, что вещество построено из мельчайших частиц, высказывалась еще древнегреческими учеными. Они-то и назвали эти
Частицы атомами (от греческого слова, означающего «неделимый»).
Древние греки предполагали, что атомы имеют форму правильных многогранников: куба («атомы земли»), тетраэдра («атомы огня»), октаэдра («атомы воздуха»), икосаэдра («атомы воды»). Поэтому и состоящий из них мир неисчерпаемо богат в своих свойствах и качествах. Цепляясь друг за друга крючками и крючочками, атомы образуют твердые тела. Атомы воды гладкие и скользкие, поэтому она растекается и не имеет формы. Атомы вязких веществ обладают заусеницами. Воздух – это пустота, в которой носятся отдельные редкие атомы. Атомы огня острые и колючие, поэтому огонь жжется. Прошло почти более двадцати столетий, прежде чем были получены экспериментальные подтверждения идеи атомистического строения вещества.
Зарождение теории строения вещества.
Атомистическая теория - современная теория строения вещества - зародилась еще в Древней Греции. Древнегреческие мыслители интересовались на первый взгляд отвлеченным вопросом: можно ли делить вещество бесконечно на все меньшие и меньшие части, или же оно состоит из некоторых неделимых частиц, не поддающихся дальнейшему делению?
Основное направление мысли древнегреческих философов, следовавших взглядам Платона и Аристотеля, основывалось на представлении о непрерывности материи. Однако некоторые древнегреческие философы, особенно Демокрит, не соглашались с такой точкой зрения и считали, что материя состоит из мельчайших неделимых частиц, которые Демокрит называл атомами, что и значит “неделимые”. Атомистические представления лежали также в основе естественной философии римского поэта и философа Лукреция, жившего в первом веке до нашей эры. Им была написана знаменитая поэма “О природе вещей”, в которой он подробно развивал атомистические взгляды на природу материи.
Даже если было бы доказано, что материя имеет атомное строение, возник бы вопрос, чем отличаются друг от друга атомы различных веществ.
Лукреций считал, что у атомов и веществ, имеющих горький вкус, на поверхности есть зазубринки, которые царапают язык, тогда как атомы веществ с приятным вкусом должны иметь гладкую поверхность.
Атомистические представления о природе веществ не намного продвинулись вперед за последующие 18 веков, прошедших со времен Лукреция. Научная мысль в Европе много веков находилась под влиянием философских идей Платона и Аристотеля, которые не разделяли атомистических воззрений на природу материи. И хотя об атомистических представлениях время от времени вспоминали, в прежние времена сторонники любой конкретной теории строения материи искали подтверждения своих взглядов главным образом в интуиции. Однако и на протяжении этого долгого периода медленно, с перерывами, шла экспериментальная работа. Часто ею двигали ошибочные взгляды: например, алхимики считали, что простые металлы, наподобие свинца, можно превратить в драгоценные металлы. Тем не менее, накапливались сведения о том, как химические вещества реагируют друг с другом, и разрабатывались более количественные методы изучения химических реакций. Это подготовило почву для новых, более содержательных формулировок в рамках атомистической теории.
Атомистическая теория Дальтона.
Джон Дальтон (1766 - 1844) большую часть своей жизни преподавал в школе и в колледже в Манчестере. Возможно потому, что сам Дальтон не был химиком, он подошел к ее проблемам с иных позиций, чем химики его времени. Его атомистическая теория, опубликованная в период 1803-1807 гг., прочно основывалась на экспериментальных наблюдениях. Она оказалась столь успешной, что с этого времени заняла господствующее положение в науке и почти не потребовала дальнейшего пересмотра.
Основные постулаты теории Дальтона заключались в следующем:
1. Каждый элемент состоит из чрезвычайно мелких частиц, называемых атомами.
2. Все атомы одного элемента одинаковы.
3. Атомы различных элементов обладают разными свойствами, в том числе имеют разные массы.
4. Атомы одного элемента не превращаются в атомы других элементов в результате химических реакций; атомы не создаются и не разрушаются в химических реакциях.
5. Соединения образуются в результате комбинации атомов двух или
нескольких элементов.
6. В данном соединении относительные количества атомов разных сортов и сорта этих атомов всегда постоянны.
Теория Дальтона позволяет мысленно нарисовать картину строения материи. Мы представляем себе элемент состоящим из мельчайших частиц, называемых атомами. Атомы являются основными структурными единицами материи, это мельчайшие частицы элемента, которые могут соединяться с другими элементами. Соединения состоят из атомов двух или нескольких элементов, образующих определенные сочетания друг с другом.
Модель атома Томсона.
Первую модель атома в 1903 г. предложил Джозеф Джон Томсон (1856 – 1940), создав ее вскоре после открытия им же в 1895 – 1897 гг. электрона. Длительность времени открытия электрона определяется продолжительностью проведения большой серии многосложных экспериментов, которые он вместе со своими сотрудниками проводил в Кавендишской лаборатории, которую с 1884 г. он же и возглавлял.
Представление об электроне, как мельчайшей заряженной частице созрело не сразу. Известно, что в экспериментах электроны предстают делокализованными, т.е. как бы размазанными по всему объему пространства атома. Кроме того, почти сразу же стало понятно, что масса электрона является переменной величиной; опыт Кауфмана, проведенный несколькими годами позже, подтвердил то, о чем Томсон только смутно догадывался. Позже он выведет формулу для массы электрона, движущегося со скоростью, сопоставимой со скоростью света, которая количественно давала те же результаты, что и релятивистская формула. У него же в экспериментах пока получалось так, что величина массы тесно была связана с зарядом.
При измерении величины заряда Томсон колебался, какую величину от измеренной необходимо отнести на счет массы, а какую на счет заряда. Поэтому Томсон не особенно торопился с выводами о существовании объекта, форму которого он себе плохо представлял. В 1897 г. он мог уверенно говорить лишь о том, что отношение электрического заряда к массе для частиц, которые образуют катодные лучи, намного больше, чем для ионов водорода. Если предположить, что заряды их по абсолютной величине равны, то, рассудил Томсон, масса катодных частиц должна быть намного меньше массы атомов водорода. Когда представление об электроне у него более или менее сложилось, он предложил модель «пудинга с изюмом». Согласно этой модели, отрицательные электроны, образуя правильные конфигурации, «плавают» в эфирной среде, заряженной положительно. О существовании положительного ядра атома он тогда ничего не подозревал; ядро было открыто несколько лет спустя.
Теперь наш дальнейший интерес сосредоточится на той самой модели Томсона, которая послужила прототипом для представления о реальном атоме. Дело в том, что исходная модель была воссоздана в обычных лабораторных условиях макромира с помощью плавающих в ванне с водой намагниченных металлических иголок, которые закреплялись на крохотных пробковых плотиках. Опыт показал, что три близлежащие диполя в свободном плавании располагаются в вершинах правильного треугольника (3 + 0). Четыре диполя распределяются по вершинам квадрата (4 + 0). Пять диполей могут образовывать уже две устойчивые модификации: либо все пять занимают вершины правильного пятиугольника (5 + 0), либо четыре диполя занимают вершины квадратов, а один находится в центре (1 + 4).
Однако шесть диполей не располагаются по вершинам правильного шестиугольника, т.е. конфигурация 0 + 6 существовать не может; имеется лишь один устойчивый вариант, когда пять диполей находятся в вершинах правильного пятиугольника, а один в центре (1 + 5). Нет и варианта типа 0 + 7, но есть только 1 + 6. Зато из восьми диполей получается два варианта 1 + 7 и 2 + 6. Если число диполей не превосходит 15, то все они распределяются по двум подгруппам – внутренней и внешней. Для системы 14-го порядка образуется конфигурация 5 + 9, где кольцо из 5 диполей является внутренним по отношению к кольцу из 9 диполей. Для 15 диполей существует единственная конфигурация 1 + 5 + 9. Таким образом, возникает серия из трех подгрупп, например, 2 + 7 + 11 = 3 + 7 + 10 = 3 + 7 + 10 = 20. Это продолжается до конфигурации до 1 + 5 + 9 + 12 = 27, когда возникает четыре подгруппы. Количество возможных дипольных конфигураций, распределенных по одной, двум, трем и четырем подгруппам, которые Майеру удалось смоделировать в эксперименте, приведены в табл. 21 (в нее не вошли конфигурации с первым кольцом из пяти элементов: 5 + 0 = 5, 5 + 9 = 14, 5 + 9 + 12 = 26, 5 + 9 + 13 = 27 и т.д.)
Первое, о чем следует помнить, когда вы рассматривайте табл. 21, так это то, что она прекрасно демонстрирует принцип заполнения электронами энергетических уровней s, p, d орбиты в атоме. Неважно, что в этой дипольной модели отсутствует ядро; оно может повлиять только на число электронов, которые разместятся иначе в каждой из подгрупп. Но ядро не вносит какого-то принципиального изменения в сам ход заполнения уровней. Поскольку все приведенные в таблице числовые данные определялись экспериментальным способом, который нельзя назвать прецизионным, у нас, конечно, нет никаких гарантий, что какая-нибудь, пусть не очень устойчивая, конфигурация в таблице пропущена. Величина устойчивости магнитной системы в данном случае никак не измерялась.
Таблица 21
| 1 | 2 | 3 | 4 |
| 1 + 0 = 1 | 2 + 0 = 2 | 3 + 0 = 3 | 4 + 0 = 4 |
| 1 + 4 = 5 | 2 + 6 = 8 | 3 + 7 = 10 | 4 + 8 = 12 |
| 1 + 5 = 6 | 2 + 7 = 9 | 3 + 8 = 11 | 4 + 9 = 13 |
| 1 + 6 = 7 | - | - | - |
| 1 + 7 = 8 | - | - | - |
| 1 + 5 + 9 = 15 | 2 + 7 + 10 = 19 | 3 + 7 + 10 = 20 | 4 + 8 + 12 = 24 |
| 1 + 6 + 9 = 16 | 2 + 8 + 10 = 20 | 3 + 7 + 11 = 21 | 4 + 8 + 13 = 25 |
| 1 + 6 + 10 = 17 | 2 + 7 + 11 = 20 | 3 + 8 + 10 = 21 | 4 + 9 + 12 = 25 |
| 1 + 6 + 11 = 18 | - | 3 + 8 + 11 = 22 | 4 + 9 + 13 = 26 |
| - | - | 3 + 8 + 12 = 23 | - |
| - | - | 3 + 8 + 13 = 24 | - |
| 1 + 5 + 9 + 12 = 27 | 2 + 7 + 10 + 15 = 34 | 3 + 7 + 12 + 13 = 35 | 4 + 9 + 13 + 14 = 40 |
| 1 + 5 + 9 + 13 = 28 | 2 + 7 + 12 + 14 = 35 | 3 + 7 + 12 + 14 = 36 | 4 + 9 + 13 + 15 = 41 |
| 1 + 6 + 9 + 12 = 28 | - | 3 + 7 + 13 + 14 = 37 | 4 + 9 + 14 + 15 = 42 |
| 1 + 6 + 10 + 12 = 29 | - | 3 + 7 + 13 + 15 = 38 | - |
| 1 + 6 + 10 + 13 = 30 | - | - | - |
| 1 + 6 + 11 + 12 = 30 | - | - | - |
| 1 + 6 + 11 + 13 = 31 | - | - | - |
| 1 + 6 + 11 + 14 = 32 | - | - | - |
| 1 + 6 + 11 + 15 = 33 | - | - | - |
Возможно, кто-то найдет в ней и другие погрешности, однако данный эксперимент поддается усовершенствованию. Например, намагниченные иголки можно заменить массивными (размером с бильярдный шар) многополюсными электромагнитами, управляемыми как по числу полюсов, так и по величине напряженности магнитного поля. С помощью многоэлементной системы, состоящей из сотен таких плавающих магнитов, можно изучать конфигурации и степень устойчивости возникающих кольцевых структур, за счет регулировки величины токов. Сняв электромагниты с пробковых плотиков и разместив их в погруженные в воду сферы (соответствующим образом уравновешенные в воде), можно попытаться изучить характер объемных конфигураций. Такая модель будет близка к реальным условиям нахождения свободных электронов в пространстве трех измерений. Во всяком случае, нельзя отрицать, что результаты, полученные с помощью данной модели, имеют исключительно важное значение для понимания процессов, происходящих внутри атомов. Томсон о табл. 21 писал: «Я думаю, что эта таблица дает определенные указания для объяснения некоторых свойств атомов» [42, с. 74] и он, конечно же, прав.
Во-вторых, модель имеет обычные для наших масштабов размеры; они несопоставимы ни с астрономическими размерами Солнечной системы, ни с атомными. Тем не менее, модель ведет себя в соответствии с квантовой механикой. В ней существуют определенные стационарные состояния: когда количество диполей превысит какой-то порог, система скачком изменяет свою конфигурацию, вплоть до перехода «лишнего» диполя на внутренний уровень (ядра ведь нет, поэтому «возбужденные» диполи падают на нижний уровень, а не на верхний). При желании кольца с магнитными диполями можно раскрутить с помощью внешнего вращающегося магнитного поля подобно тому, как раскручивается ротор во вращающемся магнитном поле статора. Такая вращающаяся квантовая система будет походить уже на синхронизованные системы типа вышерассмотренных спутниковых систем Юпитера и Сатурна или троянской системы из астероидов. Качественно движение небесных тел мало чем будет отличаться от движений магнитиков, плавающих в ванне с водой или погруженных в воду, хотя количественные характеристики прочности связи, запаса устойчивости и прочие параметры, могут различаться на много порядков. Главное, что необходимо здесь понять, дискретность не является какой-то прерогативой микромира. Все, что происходит внутри атома, с той или иной точностью можно смоделировать на объектах любого масштаба. Мысль, будто законы физики каким-то образом зависят от абсолютных размеров системы, ошибочна.
Нужно заметить, что постановку эксперимента с магнитными диполями, плавающими в ванне с водой, осуществил не Томсон. Он даже не смог как следует сослаться на автора этого чудного эксперимента, сказав только, что «опыт впервые произведен, насколько мне известно, профессором Майером». К слову сказать, Томсон не любил читать научные статьи своих коллег и предпочитал либо сам присутствовать при проведении эксперимента, либо просил кого-нибудь, чтобы тот рассказал ему об уже проведенных опытах. Кто такой профессор Майер, предложивший и осуществивший столь «простой и изящный опыт», как выразился Томсон, история умалчивает. Единственное, о чем можно сейчас уверенно сказать, так это то, что Майер был наделен дюжим конструктивистским талантом. Но спасибо и Томсону, который вовремя обратил внимание на эксперимент Майера и осмыслил его ценность для понимания характера атомных явлений.
Далее события разворачивались следующим образом. Томсон в 1906 г. получает Нобелевскую премию «за вклад, который он внес своими теоретическими и экспериментальными исследованиями прохождения электричества через газы». К прославленному лауреату едут учиться молодые физики со всего света. На короткий период с сентября 1911 г. по март 1912 г. к нему приезжает и Нильс Бор (1885 – 1962). Отношения у них не заладились с первых же дней, да это и понятно. С 1909 г. и до самого приезда в Кембридж к Томсону Бор был страшно увлечен экзистенциальной философией Сёрена Кьеркегора. О его книге «Этапы жизненного пути» Бор писал своему брату: «… Я склонен даже считать, что это одна из прекраснейших вещей, которые мне когда-либо приходилось читать». Томсон же являл собой ярчайший пример воплощения рационализма и ему был, конечно, абсолютно чужд тот негативизм, который проистекал из философии Кьеркегора, и которым были заряжены мозги Бора. Иррациональное состояние душевного настроя молодого человека, который приехал в Кембридж на стажировку, Томсон и почувствовал. Эпистемологию Бора можно охарактеризовать его же собственной фразой, смысл которой передается словами: чтобы идея получила право на существование, она должна быть достаточно сумасшедшей. Бора и вправду тянуло, если не к сумасшедшим, то уж, во всяком случае, к парадоксальным и крайне необычным объяснениям формально-феноменологического характера.
Натянутые отношения между всемирно известным ученым и никому неизвестным стажером повлекли за собой отъезд Бора к Резерфорду в Манчестер. Ко времени прибытия в Манчестер произошли следующие события. В 1908 г. один из сотрудников Резерфорда по фамилии Гейгер построил прибор для подсчета количества альфа-частиц (сейчас этот прибор называют счетчиком Гейгера). «Имея возможность считать альфа-частицы, – вспоминает Петр Капица, – Резерфорд стал изучать целый ряд явлений, которые прежде не поддавались исследованию. В 1910 г. к нему в лабораторию приехал работать молодой ученый по имени Марсден. Он попросил Резерфорда дать ему какую-нибудь очень простую задачу. Резерфорд поручил ему считать альфа-частицы, проходящие через материю, и найти их рассеяние. При этом Резерфорд заметил, что, по его мнению, Марсден ничего особенного не обнаружит. Свои соображения Резерфорд основывал на принятой в то время модели атома Дж. Дж. Томсона. В соответствии с этой моделью атом представлялся сферой размером 10–8 см с равнораспределенным положительным зарядом, в которую были вкраплены электроны. Гармонические колебания последних определяли спектры лучеиспускания. Нетрудно показать, что альфа-частицы должны были легко проходить через такую сферу, и особенного рассеяния их нельзя было ожидать. Всю энергию на своем пути альфа-частицы тратят на то, чтобы выбивать электроны, т. е. ионизовать окружающие атомы.
Марсден под руководством Гейгера стал делать свои наблюдения и скоро заметил, что большинство альфа-частиц проходит через материю, но все же существует заметное рассеяние, а некоторые частицы как бы отскакивают назад. Когда это узнал Резерфорд, он сказал: "Это невозможно. Это так же невозможно, как для пули невозможно отскочить от бумаги"… Изучая закон распределения отразившихся альфа-частиц, Резерфорд постарался определить, какое распределение поля внутри атома необходимо, чтобы объяснить закон рассеяния, при котором альфа-частицы могли бы даже возвращаться обратно. Он пришел к выводу, что это возможно тогда, когда весь заряд сосредоточен в центре, а не распределен по всему объему атома. Размер этого центра, названного им ядром, очень мал: порядка 10–13 см в диаметре. Но куда же тогда поместить электроны? Резерфорд решил, что отрицательно заряженные электроны надо распределить кругом – они могут удерживаться благодаря вращению, центробежная сила которого уравновешивает силу притяжения положительного заряда ядра. Следовательно, модель атома есть не что иное, как некая Солнечная система, состоящая из ядра – Солнца и электронов – планет. Так он создал свою модель атома.
Эта модель встретила полное недоумение, так как она противоречила некоторым тогдашним, казавшимся незыблемыми, основам физики. Резерфорд, конечно, понимал, что на основе максвелловской теории электроны, вращаясь вокруг центра, неминуемо должны испускать свет, терять свою кинетическую энергию и рано или поздно упасть на ядро. Идти вразрез с основами максвелловской теории в то время было чрезвычайно трудно. Поэтому модель атома Резерфорда вначале не была признана. Так продолжалось два года. В это время к Резерфорду приехал работать молодой датский ученый Нильс Бор. Они часто обсуждали эту модель атома. Для Бора также было ясно, что принципы строения этой модели не находятся в соответствии с теми законами, которые было принято тогда считать основными. И Бор начал работать над этим парадоксом. Он верил в экспериментальную обоснованность модели Резерфорда, но надо было найти ей теоретическое обоснование» [43, с. 220 – 221].
По складу характера Резерфорд был типичным представителем ученого-организатора. Капица вспоминает: «Пока работающий не начинал получать конкретных результатов, он мало обращал внимания на работу. Мелочной опекой он не занимался. Он часто приходил к нам в лабораторию на короткое время и неизменно делал замечание вроде: "Что вы тут все время топчетесь на одном месте, когда же будут результаты?"» Математику и математическую физику он знал в самом скромном объеме и практически никогда не облекал свои физические идеи в математическую форму. Поэтому, когда «эксперимент по рассеянию альфа-частиц, сделанный учеником Резерфорда Мардсеном (1910), однозначно указал на существование тяжелого ядра в центре атома», «Резерфорд так ясно себе представлял все происходящее во время столкновения частиц, что для него противоречие даже с фундаментальными законами электродинамики не послужило препятствием для установления планетарной модели атома» [43, с. 233].
В это время к нему на стажировку приезжает Бор с некоторыми идеями Томсона о слоистом строении атома. Следует заметить, что к марту 1912 г. Томсон, учтя экспериментальные данные Мардсена по рассеянию альфа-частиц и соображения Резерфорда, рассчитал новую стационарную модель атома, в центре которого находилось положительно заряженное ядро, а по периферии отрицательно заряженные электроны. Томсон не принял идею Резерфорда о вращающихся электронах – уж слишком она противоречила теории Максвелла. Но, чтобы неподвижные электроны не упали на ядро, он слегка изменил закон Кулона, добавив к нему отрицательное слагаемое, пропорциональное отношению r0/r3, где r0 = 10–8 см. Теперь закон Кулона, который для электрически заряженных тел заменяет всемирный закон тяготения, у него выглядел так:
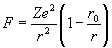
Этой моделью с небольшой коррекцией Томсон пользовался до конца своих дней, так и не приняв динамическую модель атома Резерфорда — Бора (про Мардсена, как водится в истории науки, все позабыли). Электромагнитное излучение в этой модели происходило от того, что какой-нибудь неравновесный, возбужденный электрон начинал колебаться внутри атома. Когда колебания переходили какие-то границы, перевозбужденный электрон покидал пределы атома. Электрон Томсона, как и в модели Майера, был диполем, что не так уж и далеко от истины, поскольку реальные электроны действительно обладают спиновой ориентацией.
Обязательная годичная стажировка, которую должны проходить все будущие преподаватели университетов, для Бора закончилась женитьбой, так что у Резерфорда в Манчестере он пробыл всего несколько весенних месяцев. Потом был медовый месяц. В октябре он получил должность внештатного преподавателя (приват-доцента) Копенгагенского университета и, после какого-то адаптационного периода, начал писать работу «О строении атомов и молекул», которая прославила его в веках. В ней использовалась формула Бальмера для описания спектров излучения атомов, открытая 28 лет назад, но сообщенная Бору Хансеном в феврале 1913 г. Она сыграла решающую роль для построения динамической модели атома. В начале марта Бор пересылает часть своей статьи Резерфорду и просит его содействия в ее публикации.
Резерфорд в ответном послании от 20 марта пишет: «Ваши мысли относительно причин возникновения спектра водорода очень остроумны и представляются хорошо продуманными, однако сочетание идей Планка со старой механикой создает значительные трудности для понимания того, что же все-таки является основой такого рассмотрения. Я обнаружил серьезное затруднение в связи с Вашей гипотезой, в котором Вы, без сомнения, полностью отдаете себе отчет; оно состоит в следующем: как может знать электрон, с какой частотой он должен колебаться, когда он переходит из одного стационарного состояния в другое? Мне кажется, что Вы вынуждены предположить, что электрон знает заблаговременно, где он собирается остановиться» [44, т. 2, с. 556]. Резерфорд выдвигал и другие аргументы против, но, в конце концов, сдался, принял от молодого приват-доцента революционную работу, которую из-за большого объема было решено разбить на части и опубликовать тремя статьями в течение 1913 г
Атом Резерфорда.
Эрнест Резерфорд родился 30 августа 1871 года в семье новозеландского фермера. Окончив школу в Хавелоке, где в это время жила его семья, он получил стипендию для продолжения образования в колледже провинции Нельсон, куда поступил в 1887 году. Через два года он сдал экзамен в Кентерберийский колледж – филиал Новозеландского университета в Крайчестере. Резерфорд окончил колледж в 1893 году с отличием и получил степень магистра по физике и математике. В это время Резерфорд занялся изучением магнитного действия электромагнитных волн. В 1894 году в «Известиях философского института Новой Зеландии» появилась его первая печатная работа «Намагничивание железа высокочастотными разрядами». В 1895 году оказалась вакантной стипендия для получения научного образования, первый кандидат на эту стипендию отказался по семейным обстоятельствам, вторым кандидатом был Резерфорд. Приехав в Англию, Резерфорд получил приглашение Дж. Дж. Томсона работать в Кембридже в лаборатории Кавендиша. Так начался научный путь Резерфорда.
Резерфорд, продолжая свою работу над магнитным детектором, вместе с тем заинтересовался исследованиями Томсона по электропроводимости газов. В 1896 году появляется совместная работа Томсона и Резерфорда «О прохождении электричества через газы, подвергнутые действию лучей Рентгена». В 1897 году выходит в свет заключительная статья Резерфорда «Магнитный детектор электрических волн и некоторые его применения». После этого он полностью сосредоточивает свои силы на исследовании нового разряда. В том же, 1897 году появляется его новая работа «Об электризации газов, подверженных действию рентгеновских лучей, и о поглощении рентгеновского излучения газами и парами». Вероятно, Резерфорд и Томсон вообще были одними из первых ученых, проявивших интерес к рентгеновским лучам и считавших открытие Рентгена исключительно важным и многообещающим.
В воскресенье 1 марта 1896 года Анри Беккерель обнаружил, что уран непрерывно испускает проникающее излучение неизвестной природы, которая оказалась совершенно отличной от природы рентгеновских лучей. Тем самым он обнаружил существование радиоактивности, начавшее новую эпоху в истории науки и человечества.
Сообщение об открытии Беккерелем радиоактивности произвело большой эффект в Кавендишской лаборатории, и Резерфорд решил немедленно заняться изучением этих загадочных лучей. Сначала ему казалось, что существует какая-то связь между урановыми и рентгеновскими лучами. Излучение урановых препаратов, как и рентгеновские лучи, производило ионизацию воздуха. Такое сходство в воздействии излучений на окружающую среду привело Резерфорда к мысли об опытном сравнении рентгеновских и беккерелевых лучей, что могло дать наиболее достоверные и точные сведения об их физических свойствах. Результатом этого явилась большая статья «Излучение урана и созданная им электропроводность».
Опыты продолжались почти год. Они показали, что сходства между двумя исследовавшимися излучениями, несмотря на их одинаковое ионизирующее действие, нет. Резерфорд также смог убедиться также в том, что предположение Беккереля о сходстве урановых лучей со световыми ошибочно. Излучение урана вопреки заявлению Беккереля (правда, не подкрепленному опытами) не обнаружило свойств, характерных для света. Оно не подчинялось законам световой оптики: отражению, преломлению и поляризации.
В результате этих работ Резерфорда были открыты a-частицы. Резерфорд поместил радиоактивный источник в магнитное поле и получил три вида излучений, испускаемых ураном: a-, b-частицы и g-лучи.
Уже при проведении этих опытов Резерфорд предвидел, что a-частицы помогут исследовать структуру атома в качестве мощных инструментов для проникновения в атом.
В сентябре 1898 года Резерфорд был приглашен в университет Мак-Гила в Монреале (Канада) в качестве профессора кафедры теоретической физики. В Монреале он пробыл до 1907 года. Здесь он сделал фундаментальные открытия: им была открыта эманация теория и разгадана природа так называемой «индуцированной радиоактивности»; совместно с Содди он открыл радиоактивный распад и его закон. Здесь им была написана книга «Радиоактивность». В Монреале он начал тщательные исследования природы a-частиц, закончившееся уже в Манчестере полной разгадкой их природы. Здесь же он начал свои исследования по происхождению a-частиц через вещество.
Огромный размах научной работы Резерфорда в Монреале принес ему славу первоклассного исследователя. Им было опубликовано как лично, так и совместно с другими учеными 66 статей, не считая книги «Радиоактивность». Он получает приглашение занять кафедру в Манчестере. 24 мая 1907 года Резерфорд вернулся в Европу. Начался новый период в его жизни.
Почти немедленно по прибытии в Манчестер Резерфорд начал систематические исследования рассеяния a-частиц веществом. Он установил, что каждая a-частица, попадая на экран из сернистого цинка, создает вспышку света. Поэтому для исследования рассеяния a-частиц был сконструирован прибор, изображенный схематически на рис.1 (стр. 18). С помощью свинцового коллиматора выделялся узкий конус a-частиц из радиоактивного источника. Испытав рассеивание в золотой фольге, a-частицы ударялись затем в экран из сернистого цинка и регистрировались с помощью небольшого микроскопа, в который можно было наблюдать вспышки света. Вращая детектор, можно было изменять относительное число a-частиц, рассеянных под различными углами q. Прибор помещался внутри откачанной камеры с целью устранить поглощение a-частиц в воздухе. Эти опыты были проведены Гейгером и Марсденом под руководством Резерфорда. Исследуя угол рассеяния, Гейгер установил, что наиболее вероятный угол рассеяния пропорционален атомному весу и обратно пропорционален кубу скорости частицы.
Но наиболее поразительным оказался факт, открытый Гейгером и Марсденом в 1909 году, – существование больших углов рассеяния. Некоторая, очень небольшая часть a-частиц (примерно одна из восьми тысяч) рассеивается на угол, больший прямого, отбрасываясь таким образом обратно к источнику. Тонкая пластина (толщиной примерно 4·10-4 см) отбрасывала a-частицы, летящие с большой скоростью. Как раз в том же, 1909 году Резерфорд и Ройдс неопровержимо доказали, что a-частицы являются дважды ионизированными атомами гелия. Для таких тяжелых быстро движущихся частиц рассеивание на углы, большие прямого, казалось весьма невероятным. Резерфорд по этому поводу говорил: «Это было самое невероятное событие, с которым мне когда-либо приходилось сталкиваться. Это было почти также невероятно, как если бы вы выстрелили 15-дюймовым снарядом в лист папиросной бумаги, а снаряд вернулся бы назад и попал в вас».
Одно из возможных объяснений аномального рассеяния состояло в том, что оно складывается из многих небольших углов отклонений, вызванных атомами рассеивающегося вещества.
Согласно предложенной Томсоном модели атома, a-частицы должны были бы свободно проходить сквозь атомы золота и только отдельные a-частицы могли слегка отклоняться в кулоновском поле электрона. И здесь Резерфорд обратился к планетарной модели.
Когда a-частица проходит мимо заряженного ядра, то под воздействием кулоновской силы, пропорциональной заряду ядра и заряду a-частицы и обратно пропорциональной квадрату расстояния между ними, оно движется по гиперболе, удаляясь по ее ветви после прохождения мимо ядра. Ее прямолинейный путь, таким образом, искривляется, и она отклоняется на угол рассеяния j.
7 марта 1911 года Резерфорд сделал в философском обществе в Манчестере доклад «Рассеивание a- и b-лучей и строение атома». В докладе он, в частности, говорил: «Рассеивание заряженных частиц может быть объяснено, если предположить такой атом, который состоит из центрального электрического заряда, расположенного в точке и окруженного однородным сферическим распределением противоположного электричества равной величины. При таком устройстве атома a- и b-частицы, когда они проходят на близком расстоянии от центра атома, испытывают большие отклонения, хотя вероятность такого отклонения мала».
Резерфорд рассчитал вероятность такого отклонения и показал, что она пропорциональна числу атомов n в единице рассеивающего материала, толщине рассеивающей пластинки и величине b2, выраженной следующей формулой:
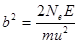 где Ne–заряд в центре атома, Е–заряд отклоняемой частицы, m–ее масса, u–ее скорость. Кроме того, эта вероятность зависит от угла рассеяния j так, что число, рассеянных частиц на единицу площади пропорционально
где Ne–заряд в центре атома, Е–заряд отклоняемой частицы, m–ее масса, u–ее скорость. Кроме того, эта вероятность зависит от угла рассеяния j так, что число, рассеянных частиц на единицу площади пропорционально 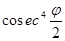 . Этот «закон косеканса» был проверен экспериментально Гейгером, и был найден справедливым в пределах экспериментальных ошибок.
. Этот «закон косеканса» был проверен экспериментально Гейгером, и был найден справедливым в пределах экспериментальных ошибок.
Важным следствием теории Резерфорда было указание на заряд атомного центра, который Резерфорд положил равным ±Ne. Заряд оказался пропорциональным атомному весу. «Точное значение заряда центрального ядра не было определено,–писал Резерфорд,–но для атома золота оно приблизительно равно 100 единицам заряда».
В 1913 году Гейгер и Марсден предприняли новую экспериментальную проверку формулы Резерфорда, подсчитывая рассеивание частиц по производимым ими сцинтиляционным вспышкам. «Это была трудная, кропотливая работа, – характеризовал Резерфорд работу своих сотрудников, – так как нужно было считать много тысяч частиц. Результаты Гейгера и Марсдена весьма близко согласуются с теорией». Из этих утомительных и кропотливых исследований и возникло представление о ядре как устойчивой части атома, несущей в себе почти всю массу атома и обладающей положительным (Резерфорд еще в 1913 году считал знак заряда неопределенным) зарядом. При этом число элементарных зарядов оказалось пропорциональным атомному весу.
Тем не менее классические модели строения атома страдали весьма глубокими недостатками. С их помощью никак не удавалось объяснить спектральные закономерности и устойчивость движения электронов внутри атома. Рано или поздно электроны в модели Резерфорда должны были прекратить движение, что прекращало существование атома. В действительности же атомы существовали, не обращая внимания на мрачные пророчества теории. Налицо было вопиющее противоречие между теорией и действительностью, причем противоречие на уровне самой исходной, самой бедной по содержанию – категорией существования. Спектральные закономерности еще можно было как-то надеяться вывести, представляя очень хитрым образом движение электронов вокруг ядра. Здесь же теория подрубалась под корень.
Атом Бора.
Идеи о непримиримости законов классической механики и электродинамики во всей их полноте к исследованию внутреннего строения атома высказывались и до Бора. Мысли о необходимости учета квантового характера излучения были также не новыми. Тем не менее именно Нильс Бор заслуженно считается пионером квантовой теории атома. Имена его предшественников на этом пути – Никольсона, Штарка, Бьеррума и других, на которых Бор не устает ссылаться в своих первых статьях, сейчас мало кому известны. Это можно объяснить тем, что упомянутые авторы достигали только частных результатов, не объединенных в сколько-нибудь стройную систему, которая могла бы служить программой целого круга исследований и допускала бы количественную проверку на опыте.
Нильс Бор родился 7 октября 1885 года в семье профессора физиологии Копенгагенского университета Христиана Бора. В 1903 году Бор поступил в Копенгагенский университет. Еще в студенческие годы Бор выполнил конкурсную работу по поверхностному натяжению. Работа была удос<
|
из
5.00
|
Обсуждение в статье: Атомистическая теория Дальтона. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

