 |
Главная |
Надлежащие практики в фармации
|
из
5.00
|
СИСТЕМА КОНТРОЛЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ
Лекарственные средства - особый вид продукции, потребляемой населением. От её качества и безопасности во многом зависит жизнь и здоровье человека. Поэтому все лекарственные средства, произведенные на территории Российской Федерации и ввезенные из-за границы, подвергаются государственному контролю.
Контроль качества лекарственных средств
В соответствии с действующим законодательством «контроль качества лекарственных средств при их гражданском обороте проводится уполномоченными федеральными органами исполнительной власти и органами исполнительной власти субъектов Российской Федерации».
При этом практикуются следующие формы контроля:
. Предварительный контроль при регистрации ЛС (организация проведения экспертизы качества, эффективности и безопасности ЛС, сбор и анализ информации о побочных эффектах применения ЛС).
. Выборочный контроль проводится на основании планов выборочного контроля качества Росздравнадзора, формируемого по результатам сбора и анализа информации о качестве ЛС.
. Повторный выборочный контроль при выявлении несоответствия лицензионным требованиям и условиям производства и внутризаводского контроля качества продукции, несоблюдения правил оптовой и розничной торговли лекарственными препаратами, правил хранения.
При государственной регистрации заявленные лекарственные средства проходят тщательную экспертизу с целью обеспечения гарантии соответствия современным требованиям безопасности, качества и эффективности. Но этим дело не ограничивается. Для того чтобы зарегистрированные препараты могли производиться, владелец регистрационного удостоверения должен получить соответствующую лицензию на промышленный выпуск данного лекарственного средства и строго соблюдать лицензионные условия. То же самое касается дистрибуции, реализации, хранения и уничтожения лекарственных средств.
В последнее время в регистрационную систему были внесены значительные изменения в направлении ее сближения с международной практикой и сокращения различий в отношении отечественных и зарубежных препаратов (Административный регламент Росздравнадзора по регистрации лекарственных средств, 2006).
В 2005 г. в целях совершенствования системы контроля качества в его структуре организовано Федеральное государственное учреждение «Научный центр экспертизы средств медицинского применения» (НЦЭСМП) Росздравнадзора» с 15 филиалами в субъектах РФ, осуществляющее экспертизу ЛП.
Государственный контроль начинается задолго до регистрации лекарственного препарата как такового. Другими словами, он начинается практически уже на этапе научных разработок, т.е. лабораторных, доклинических и клинических испытаний.
Надлежащие практики в фармации
Работники фармацевтической отрасли, задействованные на всех этапах жизненного пути препарата (рис. 1), от разработки до уничтожения, призваны соблюдать правила и другие нормативные документы, которые составляют нормативно-правовую базу. Эта база находится в состоянии модернизации и совершенствования. Более того, грядущая интеграция России в ВТО диктует необходимость гармонизации отечественной нормативно-правовой базы с международной практикой обращения лекарственных средств.
Уже сейчас в фармации активно внедряются надлежащие практики (правила), которые, исходя из сокращений, можно объединить в одну формулу GxP,
где х - различные сферы применения практики (правил).
Это - надлежащие:
лабораторная практика (GLP)
клиническая практика (GCP)
производственная практика (GMP)
практика хранения (GSP)
практика дистрибуции (GDP)
аптечная практика (GPP)
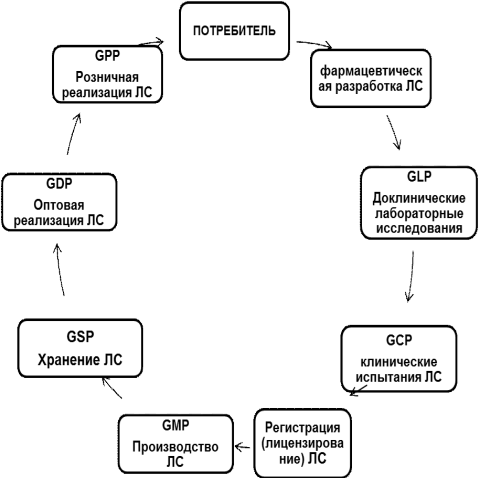
Рис. 1. Этапы жизненного цикла ЛС
Согласно современным представлениям «на каждом этапе разработки, изготовления и распределения лекарственных средств принимаются специфические для этого этапа меры по недопущению ошибок и отклонений в работе, которые могут отрицательно повлиять на качество.
Таким образом, взаимосвязь перечисленных стандартов GxP составляет систему обеспечения качества лекарственных средств, охватывающую весь жизненный цикл препарата.
На фармацевтический рынок РФ поступают лекарственные средства, произведенные как в условиях соблюдения международных стандартов GMP, так и лекарственные средства из развивающихся стран, в которых предприятия работают по национальным стандартам. Как правило, препараты из стран СНГ выпускаются на предприятиях, не аттестованных на соответствие GMP.
В РФ из 400 производителей лекарственных средств только 30 располагают производственными площадками, соответствующими международным правилам надлежащей производственной практики (Голикова Г.А., 2010). ФЗ «Об обращении лекарственных средств» установлен срок перехода отечественных производителей на требования GMP - начало 2014 г.
<http://www.medbrak.ru/ckkls/index.htm>
3.1.3 Правила GLP
GLP (Good Laboratory Practice) - качественная лабораторная практика. Это стандарты, на основании которых осуществляется планирование, проведение доклинических исследований, составление протоколов и оформление отчетов исследований. Важнейшее место в правилах GLP отводится контролю за проведением испытаний и требованиям к вивариям и качеству животных. Соблюдение правил GLP позволяет обеспечивать достоверность результатов исследований и их воспроизводимость.
Концепция GLP зародилась в США в 1970-е годы, когда сотрудники FDA (Администрации по пищевым и лекарственным продуктам Департамента здравоохранения США), не удовлетворенные качеством выполнения и обработки результатов экспериментальных исследований, начали разработку ее основных принципов. Впервые Правила СLР были сформулированы в США в 1976 г. и вступили и силу с 1979 г.
Правила GLP включают в себя:
- требования к организации испытаний;
требования к личному составу исследователей;
требования к помещениям, в которых проводятся испытания и содержатся животные;
требования к качеству животных, к условиям их содержания и кормления;
требования к лабораторному оборудованию и к его калибровке;
требования к испытуемому и контрольному веществу;
-требования к составлению и проведению подробной стандартной методики экспериментальных работ (SOP - standard operating procedure) и к порядку проведения испытаний (протокол);
- требования к регистрации данных и оформлению отчета;
требования к службе контроля за качеством испытаний;
стандартные методики экспериментальных работ.
Правила GLP, впервые разработанные в США, очень быстро получили признание в других странах мира. Практически все развитые страны в настоящее время регламентируют создание, испытания и производство препаратов своими национальными правилами и нормами, в основе которых лежат требования GLP.
Российские нормативные документы, регламентирующие производство лекарственных средств
В Российской Федерации создание, проведение доклинического и клинического испытания, а также производство лекарственного средства регламентируется несколькими основными нормативными документами.
. В основе лежит Федеральный закон от 12 апреля 2010 г № 61-ФЗ «Об обращении лекарственных средств». В этом законе отражены все стороны касающиеся создания, испытаний, производства, организации продаж и т.д. лекарственных средств.
. Приказ Министерства здравоохранения и социального развития РФ от 23 августа 2010 г. № 708н "Об утверждении Правил лабораторной практики", а также с учетом рекомендаций Current protocols in pharmacology.
. Национальный стандарт Российской Федерации ГОСТ Р-53434-2009 «Принципы надлежащей лабораторной практики»
.1.5 Государственная фармакопея РФ
Основой нормативно-правовой базы по стандартизации лекарственных средств, обеспечивающей качество, эффективность и безопасность препаратов в соответствии с современными требованиями является Государственная фармакопея.
В Стратегии развития фармацевтической промышленности РФ на период до 2020 г. отмечается необходимость «модернизации и утверждения Фармакопеи РФ, гармонизированной с Европейской фармакопеей».
Впервые в законодательный акт (ФЗ «Об обращении лекарственных средств») включена глава, посвященная Государственной фармакопее, которая определяет регулярное раз в 5 лет переиздание фармакопеи и выпуск приложений в промежуточный период.
Фармакопея является важнейшим научно-методическим руководством для производителей при разработке внутренних спецификаций качества и для регуляторных и экспертных органов - при оценке этих спецификаций в составе регистрационных досье.
Частные фармакопейные статьи на субстанции и препараты были включены в ГФ X, изданную почти 40 лет назад. Отсутствие в ГФ XI стандартов, регламентирующих качество субстанций и готовых лекарственных форм, явилось ее существенным недостатком и обусловило необходимость выпуска ГФ XII, содержащую регламенты, фармакопейные требования к качеству ЛС, гармонизированных с европейскими директивами и ведущими зарубежными фармакопеями (Eur. Ph., Br.Ph., USP).
3.1.6 Международные и региональные сборники унифицированных требований и методов испытаний лекарственных средств
Систематически через 5-8 лет осуществляют выпуск национальных фармакопей такие крупные государства, как США (USP), Великобритания (Br.Ph). Западноевропейские государства, входящие в ЕС выпускают европейскую фармакопею - Ph.Eur.
Ряд стран СНГ также имеют свои фармакопеи - Державна фармакопея Украïни, государственная фармакопея республики Беларусь, Государственная фармакопея республики Казахстан.
В 2006 г. Ph.Eur получила статус «наблюдателя» в нашей стране, что предполагает возможность использования материалов Ph.Eur. в качестве национальных фармакопейных стандартов. Однако состояние всех составляющих элементов системы обеспечения качества в стране и отсутствие монографий на готовые лекарственные формы в Ph.Eur обусловливает необходимость разработки национальных подходов к оценке качества лекарственных средств.
В результате проведенных исследований свыше 2000 монографий USP 31 и Ph.Eur. 7.0. установлено, что методология стандартизации субстанций отличается в USP и Ph.Eur.
В табл. 1 в качестве примера показаны различия подходов в использовании аналитических методов для установления подлинности неорганических веществ.
Таблица 1 - Качественные реакции подтверждения подлинности натрия хлорида и калия хлорида
| ФС 42-2572-95 или ГФ X ст. 362 | Eur.Ph., Br.Ph. | USP | ГФ XII | |
| Натрия хлорид | ||||
| Цинк-уранилацетат (Na+) Окрашивание пламени в желтый цвет (Na+) Серебра нитрат (Cl-) | Калия антимонат (Na+) 2метоксифенилуксусная кислота (Na+) Серебра нитрат (Cl) Калия дихромат в серной кислоте и раствор дифенилкарбазида (Cl-) | Калия антимонат (Na+) Окрашивание пламени в желтый цвет (Na+) Серебра нитрат (Cl-) | Калия антимонат (Na+) Серебра нитрат (Cl-) | |
| Калия хлорид | ||||
| Винная кислота (K+) Натрия кобальтинитрит (K+) Окрашивание пламени в фиолетовый цвет (K+) Серебра нитрат (Cl-) | Винная кислота (K+) Натрия кобальтинитрит (K+) Серебра нитрат (Cl-) Калия дихромат в серной кислоте и раствор дифенилкарбазида (Cl-) | Окрашивание пламени в фиолетовый цвет (K+) Винная кислота (K+) Серебра нитрат (Cl-) | Винная кислота (K+) Натрия кобальтинитрит (K+) Серебра нитрат (Cl-) | |
При сравнительном анализе монографий на синтетические препараты в лекарственной форме «таблетки», описанные в Br.Ph. 2009 г., и в USP 31 установлено, что методология ведущих зарубежных фармакопей (USP, Вr.Рh.) имеет существенные различия (табл.2).
Эти различия касаются концепции формирования стандарта качества, методических подходов к проведению испытаний по конкретным показателям, использования стандартных образцов в методах анализа.
Таблица 2 - Подходы к оценке качества препаратов в лекарственной форме «таблетки» в USP и Br.Ph.
| Показатели и методы | USP | Br.Ph. |
| Подлинность | ||
| ИК-спектрометрия | 34,5 | 50 |
| Хроматографические методы | 57 (из них в 70 % монографий используется ВЭЖХ) | 45 (из них в 50 % монографий используется ВЭЖХ) |
| Спектрофотометрия | 10 (СО) | 23 (без СО) |
| Растворение | 84,5 | 30 |
| Примеси | 20 (из них в 81 % монографий используется ВЭЖХ) | 76 (из них в 49 % монографий используется ВЭЖХ, остальные - ТСХ) |
| Количественное определение | ||
| ВЭЖХ | 72 | 40 |
| Спектрофотометрия | 14 (СО) | 37 (из них в 72 % монографий используется 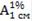 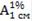 ) )
|
| Титриметрия | 10 | 17 |
3.2 ИСПЫТАТЕЛЬНАЯ ЛАБОРАТОРИЯ (ЦЕНТР) ПО КОНТРОЛЮ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ - ЧАСТЬ СИСТЕМЫ КОНТРОЛЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ
.2.1 Понятие об испытательной лаборатории (центре) по контролю качества лекарственных средств
Обеспечение качества лекарственных средств - первостепенная задача государства. Этого требуют федеральные законы РФ «Об обращении лекарственных средств» <http://www.medbrak.ru/doc.php?A=5&ID=55&SO=1&O=8&P=0&BA=4&> и «О защите прав потребителей» <http://www.medbrak.ru/doc.php?A=5&ID=79&SO=1&O=8&P=0&BA=4>. Для предотвращения оборота фальсифицированных и недоброкачественных лекарственных средств созданы государственные учреждения - испытательные лаборатории (центры) по контролю качества лекарственных средств. <http://www.medbrak.ru/ckkls/index.htm>
Испытательные лаборатории должны быть аккредитованы в системе контроля качества лекарственных средств.
Испытательные лаборатории работают непосредственно под руководством департамента здравоохранения субъекта федерации и в тесном взаимодействии с Федеральным и территориальным управлением Росздравнадзора, Роспотребнадзора, Прокуратурой и правоохранительными органами.
3.2.2 Правила GPCL
Перед испытательными лабораториями могут стоять разные задачи, однако в своей деятельности они должны руководствоваться общепризнанными в мире рекомендациями GPCL (надлежащая практика для национальных лабораторий качества лекарственных средств), касающимися планирования, проведения документального оформления и правильной оценки результатов, полученных в ходе лабораторных исследований.
Соответствующие рекомендации ВОЗ - GPCL - для лабораторий по контролю качества лекарственных средств были обновлены совсем недавно, в 2010 г. - (Надлежащая практика ВОЗ для лабораторий по контролю качества лекарственных средств - WHO good practices for pharmaceutical quality control laboratories. World Health Organization. WHO Technical Report Series, No. 957, 2010. Annex 1).
В структуре стандарта GPCL предусмотрены следующие модули:
· организационная часть, содержащая 3 раздела (политика в области качества испытательной лаборатории, цель, задача, миссия, руководство по качеству с изложением общих положений и принципов);
· модуль руководящих документов, определяющих порядок проведения испытаний, управление документацией и данными, проведения внутренних проверок и метрологическое обеспечение;
· модуль рабочих инструкций, определяющих правила заполнения журналов, протоколов испытаний, ведения архива и номенклатуру документов;
· модуль действующих инструкций, определяющих должностные обязанности персонала, участвующего в системе управления качеством испытательной лаборатории;
· модуль стандартных операционных процедур, описывающих все виды услуг.
3.2.3 Структура испытательной лаборатории (центра) по контролю качества лекарственных средств
В настоящее время испытательные лаборатории - это современные, хорошо оснащенные <http://www.medbrak.ru/ckkls/structure.htm> организации, состоящие из высококвалифицированных специалистов, работающих в системе контроля качества лекарственных средств.
Лаборатория обычно подразделяется на следующие отделы:
· химических методов анализа;
· физико-химических методов;
· микробиологических методов и активности антибиотиков;
· административная группа;
· материально-технического обеспечения;
· обеспечения качества;
· исследования биофармацевтических параметров;
3.2.4 Основные задачи испытательной лаборатории (центра) по контролю качества лекарственных средств
Основные задачи испытательной лаборатории (центра) по контролю качества лекарственных средств заключаются в следующем:
Профилактика оборота средств в аптечных и лечебно-профилактических учреждениях некачественных лекарственных средств.
Проведение исследований лекарственных средств в испытательной лаборатории Центра.
- Мониторинг неблагоприятных побочных реакций <http://www.medbrak.ru/registrator/index.htm> на применение лекарственных средств и терапевтической неэффективности препаратов.
Обеспечение учреждений здравоохранения и фармацевтических организаций методической и справочной литературой, нормативной документацией <http://www.medbrak.ru/falsifikat2/rdoc.htm> и дополнительной информацией <http://www.medbrak.ru/falsifikat2/razd.htm> по вопросам обращения лекарственных средств.
Участие в подготовке специалистов фармацевтического профиля преддипломного и последипломного образования.
Оказание на безвозмездной основе консультаций жителям соответствующего региона по вопросам качества лекарственных средств по телефонам «горячей линии» <http://www.medbrak.ru/ckkls/spravka.htm> и проведение аналитических лабораторных испытаний по их обращениям.
Информирование заинтересованных организаций, учреждений и населения, в том числе с использованием средств массовой информацией, о качестве лекарственных средств.
3.2.4 Функции испытательной лаборатории (центра) по контролю качества лекарственных средств
Лаборатория осуществляет:
· контроль качества образцов лекарственных средств, которые регистрируются в России;
· контроль качества образцов лекарственных средств, предназначенных для клинических испытаний, зарегистрированных в России;
· апробацию методов контроля лекарственных средств, которые регистрируются / перерегистрируются в России, либо тех, в методики которых вносятся изменения;
· исследование антимикробной активности образцов лекарственных средств;
· исследование эквивалентности лекарственных препаратов in vitro по профилю растворения;
· арбитражный анализ лекарственных средств, находящихся в обороте на территории России.
В настоящее время многие лаборатории на территории РФ принимают участие в «Программе переквалификации» ВОЗ согласно требованиям GPCL
3.2.5 Основные положения паспорта испытательной лаборатории (центра) по контролю качества лекарственных средств
Паспорт испытательной лаборатории (согласно ГОСТа р 51000.4-2008 «Общие требования к аккредитации испытательных лабораторий (центров)» включает следующие показатели:
1. Информационные данные:
o Наименование и фактический адрес испытательной лаборатории, телефон, факс, адрес электронной почты.
o Фамилия, имя, отчество (полностью) руководителя испытательной лаборатории.
o Наименование, юридический и фактический адрес организации, в составе которой функционирует испытательная лаборатория, телефон, факс, адрес электронной почты.
o Ведомственная подчиненность. Фамилия, имя, отчество руководителя организации (полностью). Должность руководителя организации.
2. Оснащенность испытательным оборудованием (ИО)
3. Оснащенность средствами для испытаний продукции
4. Оснащенность средствами измерений (СИ) для аттестации испытательного оборудования (при проведении аттестации силами испытательной лаборатории).
5. Оснащенность стандартными образцами (СО).
6. Состояние производственных помещений.
7. Перечень нормативных документов (НД), устанавливающих требования к испытуемой продукции и методы ее испытаний.
3.2.6 Общие требования к компетентности испытательной лаборатории (центра) по контролю качества лекарственных средств
Согласно требованиям ГОСТа P ИCO/МЭК 17025-2006 правильность и надежность испытаний, проводимых испытательной лаборатории (центра) по контролю качества лекарственных средств определяют следующие факторы:
· человеческий фактор
· помещения и условия окружающей среды
· методы испытаний и калибровка и оценка пригодности метода
· оборудование
· отбор образцов
· прослеживаемость измерений
· обращение с объектами испытаний и калибровка
Перечень оборудования, необходимого при проведении аккредитации на техническую компетентность испытательной лаборатории (ГОСТ р 51000.4-2008)
1. Лабораторное оборудование и приборы <http://www.euro-test.ru/cgi-bin/catalog.cgi?level1=300>
Системы пробоподготовки, термостатирующее оборудование, весовая техника, электрохимические анализаторы, спектрофотометрическое оборудование, хроматографическое оборудование, другие контрольно-измерительные приборы: Примерный перечень: кондуктометр, прибор для определения температуры плавления; рН-метр; аналитические электронные весы; рефрактометр; поляриметр; УФ-спектрофотометр; ИК-спектрометр; аналитический и полупрепаративный жидкостный хроматограф; другое вспомогательное оборудование и современные компьютеры, которые соединены в локальную сеть и подключены к сети Іnternet.
2. Специализированное оборудование и приборы <http://www.euro-test.ru/cgi-bin/catalog.cgi?level1=500>
- прибор для определения истираемости таблеток и капсул;
прибор для определения растворения таблеток и капсул;
прибор для определения линейных размеров и стойкости таблеток к раздавливанию;
прибор для определения насыпного объема;
3. Лабораторная мебель
4. Мерная посуда и средства измерений из стекла
Мерной лабораторная посуда (бюретки, пипетки, колбы мерные, мензурки, пробирки, цилиндры и др.) и средствах измерения из стекла (ареометры, термометры, вискозиметры и др).
5. Лабораторная посуда и инструментарий
Посуда из термо- и химстойкого стекла марок: ТС, ТХС, ХС, Simax, DURAN, а также кварца, корунда, фарфора. ГСО, стандарт-титры, фильтры и фильтровальная бумага, индикаторы и лабораторный инструментарий.
лекарственный средство контроль качество
3.2.8 Требования к оборудованию испытательной лаборатории
1. Лаборатория должна располагать оборудованием всех видов для правильного проведения испытаний и / калибровки, включая отбор проб, подготовку объектов испытаний или калибровки, обработку и анализ данных испытаний или калибровки.
. Оборудование и его программное обеспечение, используемое для проведения испытаний, калибровки и отбора образцов, должны обеспечивать требуемую точность и соответствовать техническим требованиям, предъявляемым к данным испытаниям или калибровки.
. Все средства измерений, используемые для испытаний, включая средства для вспомогательных измерений, имеющих значительное влияние на точность и достоверность результатов испытания, должны быть калиброваны перед вводом в эксплуатации.
3.2.9 Метрология - наука об измерениях
Измерения и мероприятия по обеспечению их единства и точности объединяются единым понятием “Метрологическое обеспечение”, которое традиционно определяют как деятельность по установлению и применению научных и организационных основ, технических средств, правил и норм для достижения единства и требуемой точности различных способов определения значений физических величин.
Практическая метрология - раздел метрологии, посвященный изучению вопросов практического применения в различных сферах деятельности теоретических исследований в рамках метрологии и положений законодательной метрологии.
Единство измерений как одно из слагаемых Метрологического обеспечения - это такое состояние измерений, при котором результаты выражены в узаконенных единицах и погрешности измерений известны с заданной вероятностью. Единство измерений необходимо для того, чтобы можно было сопоставить результаты измерений, выполненных в разных местах, в разное время, с использованием разных методов и СИ.
3.2.10 Законодательные акты РФ об обеспечении единства измерений
Нормативные правовые акты Российской Федерации, принятые в целях обеспечения единства измерений:
1. Федеральный закон РФ 2008 года No.102-ФЗ “ Об обеспечении единства измерений”
2. Постановление Правительства Российской Федерации от 31.10.2009 г. №879 «Об утверждении Положения о единицах величин, допускаемых к применению в Российской Федерации».
. Постановление Правительства Российской Федерации от 02.11.2009 г. №884 «Об утверждении Положения о Государственной службе стандартных образцов и свойств веществ и материалов».
4. Постановление Правительства Российской Федерации от 20.04.2010 г. «О перечне средств измерений, поверка которых осуществляется только аккредитованными в установленном порядке в области обеспечения единства измерений государственными региональными центрами метрологии <http://www.rostest.ru/services/metrology/index.php>».
. Постановление Правительства Российской Федерации от 23.09.2010 г. №734 «Об эталонах единиц величин, используемых в сфере государственного регулирования обеспечения единства измерений».
3.3 ВИДЫ ВЕСОВ И ИХ ПОВЕРКА
В лаборатории обычно используются следующие виды весов: лабораторные (прецизионные), аналитические, технохимические, а также в определенных случаях - компараторы массы.
3.3.1 Весы лабораторные, прецизионные
Это широкий ряд моделей, подходящих для решения любых задач: от простого взвешивания до определения массы дорогостоящих материалов, сложного формулирования, счета штук мелких деталей, определение веса образца в тяжелом контейнере.
Предназначены для статистического измерения массы в лабораториях с точностью до 0,001 г.
Также весы могут осуществлять следующие операции: подсчет, разбраковка по массе, память тары, взвешивание под весами, взвешивание животных, суммирование.
3.3.2 Аналитические электронные весы
Профессиональные модели весов для проведения особо сложных исследований с точностью до 0,1 мг. Весовая система - электромагнитная самокалибровка. Выполняют до 20 единиц измерения, полный набор прикладных программ (включая формулирование, гидростатическое взвешивание, дифференциальное взвешивание, коррекция выталкивающей силы воздуха, калибровка пипеток), графический дисплей с "оконным" интерфейсом пользователя, интерфейс RS-232 для подключения к ПК или принтеру с возможностью протоколированием в стандарте GLP.
3.3.3 Технохимические весы
Главная деталь технохимических весов (рис. 4) - это равноплечий рычаг (коромысло), в котором укреплены три призмы: средняя - опорная, две концевые - грузоподъемные; к ним подвешены чашки на сережках с укрепленными в них подушками. Средняя опорная призма опирается на плоскую подушку, укрепленную на колонке весов. К ней прикреплен отвес, с помощью которого весы устанавливают горизонтально. Специальное приспособление для остановки колебаний и отделения призм от подушек (что предохраняет их от порчи, так как весы должны находиться в покое, когда не производится взвешивание или когда на чашки весов кладут взвешиваемые предметы и разновески) называется арретиром, а положение весов, при котором призмы не лежат на подушках - арретированным. Предельная нагрузка технохимических весов обычно 200 - 500 г. Точность взвешивания 0,01 г.
Высокая точность технохимических весов достигнута выработанным веками совершенством их конструкции, продуманностью и тщательным выполнением каждой детали. Сказанное обусловливает необходимость исключительно бережного обращения с весами, строжайшего выполнения правил взвешивания. Квалифицированного химика сразу можно отличить от неопытного работника, понаблюдав за тем, как он взвешивает.
3.3.4 Компараторы массы (масскомпараторы)
Компараторы массы предназначены для определения массы с высокой точностью методом сличения. Компараторы массы применятся для поверки и калибровки гирь, для определения массы деталей, требующих высокой точности изготовления, массы дорогостоящих материалов.
Компараторы массы используются в лабораториях государственных метрологических служб, а также в промышленности для весового контроля высокой точности, как, например, при изготовлении деталей авиационных двигателей внутреннего сгорания или при изготовлении гирь высокой точности.
3.3.5 Калибровка весов
Калибровка весов - это совокупность операций, выполняемых с целью приведения метрологических характеристик весов к заданным параметрам.
По типу калибровки весы делятся на:
· весы с внешней калибровкой (калибровка весов осуществляется оператором с использованием гирь соответствующего класса точности. Для большинства весов гиря в комплект поставки не входит и заказывается, в случае необходимости, отдельно;
· весы с автоматической калибровкой встроенной гирей (необходимость калибровки весов определяется оператором, процедура калибровки выполняется встроенным в весы механизмом);
· весы с самокалибровкой встроенной гирей (весы определяют необходимость проведения калибровки и проводят ее самостоятельно, без участия оператора).
В отличие от поверки, которую осуществляют органы государственной метрологической службы (ГМС), калибровка может проводиться любой метрологической службой (или физическим лицом) при наличии надлежащих условий для квалифицированного выполнения этой работы.
Калибровка - добровольная операция и ее может выполнить также и метрологическая служба самого предприятия. Это еще одно отличие от поверки, которая, как уже указано выше, обязательна и подвергается контролю со стороны органов ГМС.
Однако добровольный характер калибровки не освобождает метрологическую службу предприятия от необходимости соблюдать определенные требования. Главная из них - прослеживаемость, т.е. обязательная «привязка» рабочего средства измерений к национальному государственному эталону. Таким образом, функцию калибровки следует рассматривать как составную часть национальной системы обеспечения единства измерений. А если учесть, что принципы национальной системы обеспечения единства измерений гармонизированы с международными правилами и нормами, то калибровка включается в мировую систему обеспечения единства измерений.
3.3.6 Средства калибровки
Средства калибровки - калибровочные гири и наборы гирь соответствующего номинала и класса точности.
Гиря - это мера массы, воспроизводящая с определенной точностью единицу массы.
Согласно ГОСТ 7328-2001 в зависимости от нормируемых значений метрологических характеристик калибровочные гири и наборы гирь подразделяются на семь классов точности:
Е1, Е2, F1, F2 , M1, M2, M3 .
Разделяют также на гири и наборы эталонные, общего назначения и калибровочные гири (с сертификатом о калибровке). Разделение обусловлено параметрами указанными в выше названном ГОСТе, такие как шероховатость поверхности, магнитная проницаемость и т.п. характеристики.
3.3.7 Поверка средств измерений
Поверка средств измерений - совокупность операций, выполняемых органами Государственной метрологической службы (органами ГМС) или другими уполномоченными на то органами и организациями с целью определения и подтверждения соответствия средств измерений установленным техническим требованиям.
В соответствии с Законом РФ «Об обеспечении единства измерений» средства измерений, подлежащие государственному метрологическому контролю и надзору, подвергаются поверке при выпуске из производства или ремонта, при ввозе по импорту и эксплуатации. Допускается продажа только поверенных средств измерений.
Результат поверки - подтверждение пригодности средств измерений к применению или признание средства измерений непригодным к применению. Если средство измерений по результатам поверки признано пригодным к применению, то на него и (или) техническую документацию наносится оттиск поверительного клейма и (или) выдается «Свидетельство о поверке». Если по результатам поверки средство измерений признано непригодным к применению, оттиск поверительного клейма и (или) «Свидетельство о поверке» аннулируются и выписывается «Извещение о непригодности» или делается соответствующая запись в технической документации.
3.3.8 Виды поверок
В России применяются следующие виды поверок средств измерений: первичная, периодическая, внеочередная, инспекционная и экспертная.
Первичной поверке средства измерений утвержденных типов, которые произведены или отремонтированы в России, ввезены по импорту за исключением ситуации действия соответствующего соглашения (договора) о взаимном признании результатов поверки.
Периодической поверке подлежат находящиеся в эксплуатации (или хранящиеся) средства измерений. Перечень таких средств измерений с учетом областей действия государственного метрологического надзора составляют владельцы этих средств. Поверочные интервалы устанавливаются на основе действующих законодательных положений.
Внеочередную поверку проводят при эксплуатации (хранении) средств измерений в случае:
· повреждения знака поверительного клейма, а также утраты свидетельства о поверке;
· ввода в эксплуатацию средств измерений после длительного хранения (более одного межповерочного интервала);
· проведения повторной настройки, известного или предполагаемого ударного воздействия на средство измерений или неудовлетворительной работы прибора.
· продажи (отправки) потребителю средств измерений, не реализованных по истечении срока, равного половине межповерочных интервалов на них;
· применения средств измерений в качестве комплектующих по истечении срока, равного половине межповерочных интервалов на них.
Инспекционную поверку проводят для выявления пригодности к применению средств измерений при осуществлении государственного метрологического надзора.
Экспертную поверку проводят при возникновении спорных вопросов по метрологическим характеристикам, исправности средств измерений и пригодности их к применению.
Методика поверки
Методика поверки средств измерений - основной документ на поверку средств измерений, представляющий собой алгоритм проведения поверки, документированный в соответствии с установленными правилами.
Сейчас это трудно представить, но методика поверки как официальный, общепризнанный документ, устанавливающий единые подходы к поверке средств измерений одного типа, отсутствовали до середины ХХ века. Не имея методики поверки, поверители в каждом случае проводили поверку, руководствуясь собственными знаниями, личным опытом, наработками. Надо ли говорить, что в отсутствие единой методики поверки один поверитель мог с чистой совестью клеймить прибор, в то время когда другой мог признать его негодным. Начатая в 40-50 годах стандартизация методик стала революционным шагом к обеспечению единства измерений.
Межповерочный интервал для аналитических и лабораторных весов составляет1 год.
Методика поверки лабораторных и аналитических весов состоит из следующих этапов:
. Внешний осмотр
. Опробование
. Определение метрологических характеристик:
Для аналитических весов:
определение погрешности весов при симметричном и нецентральном положении груза на чашке
опреде
|
из
5.00
|
Обсуждение в статье: Надлежащие практики в фармации |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

