 |
Главная |
Термодинамические понятия – теплота и работа газа. Количество теплоты. Молярная и удельная теплоемкости газа.
|
из
5.00
|
Понятие степеней свободы молекулы. Теорема о равномерном
Распределении энергии молекулы по степеням свободы. Внутренняя
Энергия идеального газа.
Число степеней свободы – это число независимых величин с помощью которых может быть задано положение системы. (1 атом =3 ст., 2 атома =5ст. 3 атома=6ст.)
Закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная КТ/2 , а на каждую колебательную – КТ
Средняя энергия молекулы 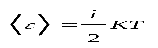
Внутренняя энергия для 1 моля 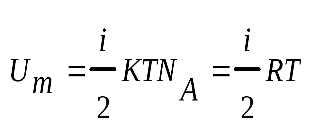
для массы m газа 
Внутренняя энергия идеального газа
При изучении тепловых явлений наряду с механической энергией тел вводится новый вид энергии — внутренняя энергия. Вычислить внутреннюю энергию идеального газа не составляет большого труда.
Наиболее прост по своим свойствам одноатомный газ, т. е. газ, состоящий из отдельных атомов, а не молекул. Одноатомными являются инертные газы — гелий, неон, аргон и др. Можно получить одноатомный (атомарный) водород, кислород и т. д. Однако такие газы будут неустойчивыми, так как при столкновениях атомов образуются молекулы Н2, О2 и др.
Молекулы идеального газа не взаимодействуют друг с другом, кроме моментов непосредственного столкновения. Поэтому их средняя потенциальная энергия очень мала и вся энергия представляет собой кинетическую энергию хаотического движения молекул. Это, конечно, справедливо, если сосуд с газом покоится, т. е. газ как целое не движется (его центр масс находится в покое). В этом случае упорядоченное движение отсутствует и механическая энергия газа равна нулю. Газ обладает энергией, которую называют внутренней.
Для вычисления внутренней энергии идеального одноатомного газа массой т нужно умножить среднюю энергию одного атома, выражаемую формулой (4.5.5), на число атомов. Это число равно произведению количества вещества  на постоянную Авогадро NA.
на постоянную Авогадро NA.
Умножая выражение (4.5.5) на 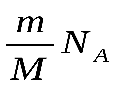 , получим внутреннюю энергию идеального одноатомного газа:
, получим внутреннюю энергию идеального одноатомного газа:
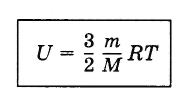 (4.8.1)
(4.8.1)
Внутренняя энергия идеального газа прямо пропорциональна его абсолютной температуре.
От объема газа она не зависит. Внутренняя энергия газа представляет собой среднюю кинетическую энергию всех его атомов.
Если центр масс газа движется со скоростью v0, то полная энергия газа равна сумме механической (кинетической) энергии 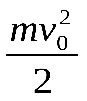 и внутренней энергииU:
и внутренней энергииU:
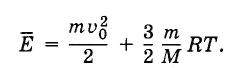 (4.8.2)
(4.8.2)
Термодинамические понятия – теплота и работа газа. Количество теплоты. Молярная и удельная теплоемкости газа.
Первое начало термодинамики. Теплоемкость
С изобретением тепловых машин, где в качестве рабочего вещества используется газ или водяной пар, возник вопрос о теплопередаче между телами, то есть как передается тепло и на что оно расходуется. Первое начало (закон) термодинамики открыто в середине XIX века в виде, близком к современному.
8.1. Первое начало термодинамики. Теплоемкость
Первое начало термодинамики: количество теплоты Q, сообщенное системе, идет на увеличение внутренней энергии системы U и на совершение системой внешней работы А:
| Q = U + A. | (8.1) |
Например, если газу под поршнем сообщить некоторое количество теплоты, он нагреется (увеличится внутренняя энергия газа) и переместит поршень (газ совершит работу). Внутренняя энергия есть функция температуры. Чем выше температура тела, тем быстрее движутся его молекулы, а, значит, больше внутренняя энергия тела. Если система получает тепло, Q > 0, если отдает, Q < 0; если работает система, A > 0, если работа над системой, A < 0.
Первое начало термодинамики, по существу, является законом сохранения энергии: полная энергия, переданная системе Q, превращается в тепловую энергию молекул системы U и в механическую энергию А. Он справедлив не только для газов, но и для жидкостей, и для твердых тел.
Если процесс медленный (равновесный), этот закон можно записать в ви-
| де бесконечно малых приращений величин (в дифференциальном виде)1: | |
| δ Q = dU + δ A. | (8.1)′ |
Пусть газ, находящийся под давлением Р медленно сдвинул поршень площади S на бесконечно малое расстояние dx. Тогда совершенная газом элементарная (бесконечно малая) работа
δ A = Fdx = PSdx = PdV.
Полная работа газа при изменении объема от V1 до V2 получается интегрированием (суммированием бесконечно малых работ):
| V 2 | |
| A = ∫ P(V )dV . | (8.2) |
V 1
Для характеристики процессов теплообмена введем понятия молярная и удельная теплоемкость вещества (не обязательно газа).
1 Внутренняя энергия – это функция состояния системы, для идеального газа зависящая только от температуры. Для равновесных процессов функция U(T) дифференцируемая и для нее определен дифференциал dU = U′(T)dT, где U′(T) – производная функции U(T) по температуре. Напротив, количество теплоты и работа не являются функциями состояния системы: нельзя сказать, что у системы такая-то теплота или такая-то работа. Для них дифференциал не определен. Поэтому бесконечно малые приращения этих величин обозначеныпо-другому.
54
Молярная теплоемкость – это отношение бесконечно малого количества теплоты, полученного молем вещества, к соответствующему приращению его температуры:
| C = | 1 | δQ | (8.3) | |
| ν | . | |||
| dT | ||||
Удельная теплоемкость – это отношение бесконечно малого количества теплоты, полученного килограммом вещества, к соответствующему прираще-
| нию его температуры: | 1 | δQ | ||
| c = | ||||
|
| . | (8.4) | ||
| m dT | ||||
Эти теплоемкости связаны между собой простым соотношением С = μс и измеряются соответственно в Дж/(моль·К) и в Дж/(кг·К).
Чем больше теплоемкость, тем медленнее вещество нагревается и медленнее остывает. Например, в холодную погоду водоемы охлаждаются медленнее окружающего воздуха и вблизи них теплее (в холодную погоду водоплавающие птицы сидят на воде). А в жару, наоборот, вода нагревается медленнее окружающего воздуха, и вблизи водоемов прохладнее. Это обусловлено тем, что теплоемкость воды гораздо больше теплоемкости воздуха.
Для газов, как правило, пользуются молярной теплоемкостью, а для жидкостей и твердых тел – удельной1. Например, из формулы (8.4) легко получить школьную формулу для количества тепла, которое нужно сообщить телу массы m, чтобы нагреть его от температуры t1 до температуры t2
δ Q = mcdT.
Считая, что масса в процессе не меняется, а теплоемкость не зависит от температуры, получим
T 2
Q = ∫ δ Q = mc ∫ dT = mc(T 2 − T 1 ) = mc T .
T 1
| Q = mc(t 2 – t 1 ). | (8.5) |
Аналогично из формулы (8.3) можно получить похожее выражение для теплоты через молярную теплоемкость и количество вещества. В термодинамике особо рассматриваются следующие молярные теплоемкости: молярная теплоемкость при постоянном объеме
| C | = | 1 | δQ | = | 1 | dU | (8.3) ′ | |||
| ν | ν | |||||||||
| V | dT | V | dT | V | ||||||
и молярная теплоемкость при постоянном давлении
1 Значения теплоемкостей обычно определяют экспериментально и приводят в справочных таблицах. Для идеального газа теплоемкости можно сравнительно легко рассчитать из классических молекулярно-кинетических принципов. Теоретический расчет теплоемкостей жидкостей и твердых тел довольно сложен, так как опирается на принципы квантовой физики.
Удельной теплоемкостью вещества называется физическая величина, численно равная количеству энергии в форме теплоты, которое надо сообщить единице массы этого вещества для увеличения его температуры на 1 Кельвин (т.е. это теплоёмкость, отнесённая к единице массы вещества):
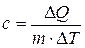 , Дж/(кг×К)
, Дж/(кг×К)
В общем случае удельная теплоемкость зависит от рода вещества и от вида термодинамического процесса, в котором телу сообщается количество теплоты.
Удельные теплоёмкости многих веществ приведены в справочниках (обычно для процесса при постоянном давлении). К примеру, удельная теплоёмкость жидкой воды при нормальных условиях — 4200 Дж/(кг·К);
льда – 2100 Дж/(кг·К).
Количество теплоты, поглощённой телом при изменении его состояния, зависит не только от начального и конечного состояний (в частности, от их температуры), но и от способа, которым был осуществлен процесс перехода между ними.
Поэтому для газов различают два вида теплоемкостей: если газ нагревают, сохраняя его объем постоянным (изохорно), говорят об удельной теплоемкости газа при постоянном объеме cV; если же газ нагревают, сохраняя постоянным его давление (изобарно), то говорят об удельной теплоемкости газа при постоянном давлении сР. У жидкостей и твёрдых тел разница между Ср и Cv сравнительно мала.
Часто пользуются молярной теплоемкостью Сμ, которая, в отличие от удельной теплоемкости, отнесена не к единице массы (1 килограмму), а к массе одного моля вещества. Очевидно, что
Cμ = mc, Дж/(моль×К)
Для газов молярную теплоемкость, рассчитанную при постоянном давлении, обозначают СР, а рассчитанную при постоянном объеме – СV. Следовательно, СР = m×cP, CV = m×cV.
Когда нагревание газа происходит при постоянном объеме, газ не совершает механической работы и все сообщаемое газу тепло идет только на увеличение его внутренней энергии DU, т.е.:
DQ = m×cV×DT = DU.
Если же нагревание газа происходит при постоянном давлении и, следовательно, объем газа увеличивается, то сообщаемое газу тепло DQ идет как на увеличение его внутренней энергии DU, так и на совершение газом работы DA над внешними телами, т.е. DQ = m×cP×DT = DU + DA.
Из сопоставления формул следует, что cP > cV, т.е. удельная теплоемкость газа при постоянном давлении больше удельной теплоемкости того же газа при постоянном объеме. При этом, согласно уравнению Майера:
CP = CV + R.
В данной работе требуется определить не абсолютные значения теплоемкостей газа, а их отношение, называемое коэффициентом Пуассона:
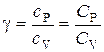 .
.
Теоретическое вычисление теплоемкости, в частности её зависимости от температуры тела, не может быть осуществлено с помощью чисто термодинамических методов и требует применения методов статистической физики.
|
из
5.00
|
Обсуждение в статье: Термодинамические понятия – теплота и работа газа. Количество теплоты. Молярная и удельная теплоемкости газа. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

