 |
Главная |
Вопрос №43. Периодические и непериодические свойства атомов элементов. Полные и неполные электронные аналоги.
|
из
5.00
|
Свойства химических элементов могут быть подразделены на непериодические и периодические. Непериодические свойства с возрастанием порядкового номера элемента изменяются более или менее монотонно на протяжении всего ряда элементов. Примером подобных свойств могут служить атомная масса элемента и длины волн характеристических линий рентгеновских спектров. Периодические свойства в значительной мере определяются электронной конфигурацией атома, которая, изменяется периодически. Подобные свойства изменяются относительно монотонно на протяжении периода; переход же к следующему периоду сопровождается скачкообразным изменением свойства. К периодическим свойствам относятся такие физические характеристики, как эффективный заряд ядра, радиус атома, энергия ионизации, сродство к электрону, электроотрицательность. Периодически изменяются также химические свойства элементов, однако сопоставление их затруднено отсутствием соответствующих количественных характеристик.
Поскольку периодические свойства зависят не только от типа заполняемых электронами валентных энергетических подуровней и числа электронов на этих подуровнях, изменения свойств элементов даже в пределах периода или подгруппы зачастую отклоняются от строгой монотонности и носят скорее характер определенной тенденции. Нарушение монотонного изменения тех или иных характеристик атомов в горизонтальных рядах p-, d- и f-элементов получило название внутренней периодичности; нарушение монотонности изменения свойств в подгруппах элементов называется вторичной периодичностью. Причины, обуславливающие вторичную и внутреннюю периодичность, будут рассмотрены ниже.
Эффективный заряд ядра
Эффективный заряд ядра (Zэфф) - это заряд, соответственно которому ядро действует на валентные электроны. При расчете эффективного заряда ядра учитываются эффекты экранирования и проникновения электрона к ядру. Эффективный заряд совпадает с истинным лишь для водорода и одноэлектронных ионов, для всех остальных атомов эффективный заряд меньше порядкового номера.
Эффект экранирования зависит от типа орбитали, занятой электроном. Наиболее слабо экранируют ядро валентные электроны внешнего электронного слоя, наиболее сильно - электроны внутренних электронных слоев. При перемещении по периоду слева направо истинный заряд ядра увеличивается от элемента к элементу на единицу, тогда как электроны, поступающие, во внешний электронный слой или на d-подуровень предвнешнего слоя (в случае d-элементов больших периодов) понижают эффективный заряд ядра меньше, чем на единицу. Таким образом, в периодах с увеличением порядкового номера эффективные заряды ядра должны расти. После завершения периода очередной электрон поступает на следующий энергетический уровень, начинает строиться новый электронный слой, внешние электроны становятся предвнешними, их экранирующее действие возрастает и эффективный заряд ядра понижается.
На атомные радиусы элементов оказывают влияние следующие факторы:
1. Эффективный заряд ядра. Увеличение Zэфф при прочих равных условиях усиливает притяжение валентных электронов к ядру и, следовательно, уменьшает радиус.
2. Число энергетических уровней, заполненных электронами. Увеличение числа электронных слоев атома способствует увеличению его радиуса.
3. Электронная конфигурация атома. Заполнение валентными электронами соответствующих энергетических подуровней делает атом более компактным, уменьшая его радиус. Можно ожидать, что наибольшее влияние на радиус будет оказывать образование электронных структур ns2, np6, nd10, nf14 и, в меньшей степени, np3, nd5, nf7. С другой стороны, заполнение электронами внутренних d- и f-подуровней благоприятствует проникновению валентных электронов к ядру. Образующиеся при этом d10 и f14 экраны как бы "придавливают" проникающий под них электрон к ядру, понижая его энергию и уменьшая радиус атома.
Электронная аналогия
Проявляется у элементов, имеющих сходные электронные формулы. Элементы, входящие в подгруппу электронных аналогов, аналогичны по конфигурации внешнего электронного слоя и достраивающихся внутренних подуровней. Отнесению к электронным аналогам не препятствуют отличия в конфигурации благородного газа, включенного в электронную формулу ([He]2, [Ne]10 и т.д.); при этом конфигурация [Xe]544f14 считается эквивалентной конфигурации благородного газа. Провал электрона также не нарушает электронную аналогию. Так, например, молибден ([Kr]364d54s1 и вольфрам [Xe]544f145d46s2) являются электронными аналогами, хотя их электронные формулы отличаются по структуре как внешнего, так и внутренних электронных слоев.
Различают полные и неполные электронные аналоги. Полные аналоги имеют аналогичные электронные конфигурации в любых степенях окисления. Неполные электронные аналоги характеризуются сходными электронными конфигурациями лишь в некоторых степенях окисления.
Вопрос №44. Электродный потенциал металла, его зависимость от состава раствора. Уравнение Нернста. Влияние комплексообразования на восстановительную способность металлов в водных растворах.
Электродный потенциал металла - разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом. (зависимость не нашел!!!!!!)
Абсолютные значения электродных потенциалов измерить не удается. Электродные потенциалы зависят от ряда факторов (природы металла, концентрации, температуры и др.). Поэтому обычно определяют относительные электродные потенциалы в определенных условиях – так называемые стандартные электродные потенциалы (Е0).
Стандартным электродным потенциалом металла называют его электродный потенциал, возникающий при погружении металла в раствор собственного иона с концентрацией (или активностью), равной 1 моль/дм3, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 250С условно принимается равным нулю (Е0 = 0; ΔG0 = 0).
Располагая металлы в ряд по мере возрастания их стандартных электродных потенциалов (Е0), получаем так называемый ряд напряжений.
Положение того или иного металла в ряду напряжений характеризует его восстановительную способность, а также окислительные свойства его ионов в водных растворах при стандартных условиях. Чем меньше значение Е0, тем большими восстановительными способностями обладает данный металл в виде простого вещества и тем меньшие окислительные способности проявляют его ионы, и наоборот. Электродные потенциалы измеряют в приборах, которые получили название гальванических элементов. Окислительно-восстановительная реакция, которая характеризует работу гальванического элемента, протекает в направлении, в котором ЭДС элемента имеет положительное значение. В этом случае ΔG0 < 0, так как ΔG0 = –nFΔE0.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
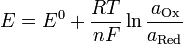 , где
, где
 — электродный потенциал, E0 — стандартный электродный потенциал, измеряется в вольтах;
— электродный потенциал, E0 — стандартный электродный потенциал, измеряется в вольтах;
 — универсальная газовая постоянная, равная 8.31 Дж/(моль·K)
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K)
 — абсолютная температура
— абсолютная температура
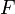 — число Фарадея, равное 96485,35 Кл/моль
— число Фарадея, равное 96485,35 Кл/моль
 — число моль электронов, участвующих в процессе
— число моль электронов, участвующих в процессе
 и
и 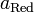 — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным, то при T = 298K получим:
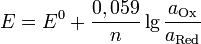
Влияние комплексообразования на восстановительную способность металлов в водных растворах. (Не НАШЕЛ!!!!)
45) Основные положения теории кислот и оснований Аррениуса. Зависимость кислотно-основных свойств соединений от степени окисления центрального атома.
Основные положения теории Аррениуса:
Определения. Кислоты — это вещества, образующие в водном растворе ионы гидратированные катионы водорода Н+ (ионы гидроксония) и анионы кислотного остатка.
Основания -- вещества, диссоциирующие в водном растворе с образованием катионов металла и гидроксид-анионов ОН−.
Соли -- вещества, диссоциирующие с образованием катиона металла и аниона кислотного остатка.
В реакции кислоты с основанием (реакция нейтрализации образуется соль и вода.
Примеры. Кислота -- HCl (кислотный остаток Cl-):
HCl + H2O ↔ H3O+ + Cl-
Основание -- NaOH:
NaOH ↔ Na+ + OH-
Реакция нейтрализации (соль - NaCl):
HCl + NaOH = NaCl + H2O
Критерии протекания реакции. Сильные кислоты реагируют с сильными основаниями. Чем слабее кислота, тем более сильное основание нужно для реакции.
Количественные характеристики Сила кислоты и основания характеризуются их константами диссоциации K.
Для кислоты HA K = [H+]·[A-]/[HA]
Для основания MOH K = [M+]·[OH-]/[MOH]
Чтобы прошла реакция между кислотой и основанием, произведение их констант диссоциации должно быть больше, чем 10-14 (ионное произведение воды).
Область применения. Она вполне удовлетворительно описывает реакции достаточно сильных кислот и оснований друг с другом и свойства их водных растворов. На основе представлений о степени и константе диссоциации было закреплено деление электролитов на сильные и слабые, введено понятие водородного показателя, распространение которого на щелочные среды требует, однако, дополнительных допущений (введения ионного произведения воды).
Теорию можно применять для описания гидролиза солей и реакции кислот и оснований с солями, однако при этом требуется весьма громоздкий аппарат -- пронная теория (см. ниже) гораздо удобнее.
Применимость теории Аррениуса-Оствальда ограничивается водными растворами. кроме того, она не позволяет объяснить наличие основных свойств аммиака, фосфина и других соединений, не содержащих гидроксогрупп.
Зависимость кислотно-основных свойств соединений от степени окисления центрального атома. (не нашел пока)
Вопрос №46. Пространственное расположение и форма s-, p-, и d-орбиталей в атоме.
Вопрос №47. Равновесия в смесях сильных и слабых электролитов. Вычисление концентраций ионов и молекул в растворах, содержащих слабые кислоты и их соли (буферные растворы).
|
из
5.00
|
Обсуждение в статье: Вопрос №43. Периодические и непериодические свойства атомов элементов. Полные и неполные электронные аналоги. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

