 |
Главная |
Решение задач на приготовление растворов с молярной и нормальной концентрацией.
|
из
5.00
|
Растворы М и Н концентрации готовятся в мерных колбах.
Задача 4. Приготовьте 250 мл 0,5 М раствора CuSO4 из безводного CuSO4
| Дано: Cм(CuSO4) = 0,5 М V (CuSO4) = 0,25 л | Решение: См=n(CuSO4)/V Находим количество молей раствора CuSO4 по формуле n(CuSO4)=См·V, тогда n(CuSO4)=0,5моль/л·0,25л=0,125моль. М(CuSO4)=160 г/моль |
| Найти: m (CuSO4)=? |
Согласно формуле n=m/M, находим массу CuSO4
m (CuSO4)= n· M=0,125 моль ·160 г/моль=20 г Ответ: Для того, что бы приготовить 250 мл CuSO4 из безводного, нужно взвесить на аналитических весах 20 г CuSO4, перенести в мерную колбу
объемом 250 мл и довести объем водой до метки.
Задача 5. Как приготовить 25 мл 0,1М раствора ZnSO4 из 5М раствора ZnSO4?
Дано:
V2 = 25 мл
M2 = 0,1 моль/л M1 = 5 моль/л Найти V1 =?
Решение:
Из следствия из закона эквивалентов следует, что при разведении растворов изменения объемов обратно пропорционально изменению концентраций и V1∙М1 = V2∙М2 , где V1∙М1-количество вещества в исходном растворе, а V2∙М2 – после разбавления.
Определяем объем исходного раствора:
V1∙5 М = 25 мл∙0,1 М отсюда V1 = 0,5 мл.
Ответ: Для приготовления 25 мл 0,1М раствора ZnSO4 из 5М необходимо отмерить в мерную колбу на 25 мл из бюретки 0,5мл 5М раствора ZnSO4 и довести объем водой до метки колбы.
Примечание: бесцветные растворы отмечают по нижнему мениску, а окрашенные по верхнему.
Задача 6. Как приготовить 200мл 0,2н раствора CuSO4 из СuSO4·5H2O? Дано:
Vраствора (CuSO4) = 200мл
СN раствора (CuSO4)= 0,2 мол экв./л.
Найти m СuSO4·5H2O.
Решение:
1) Определяем количество моль эквивалентов СuSO4·5H2O. В растворе.
СN= 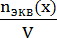 ;
;
nэкв = CN · V =0,2х0,2 =0,04 моль
2). Находим Мэкв (СuSO4·5H2O); М СuSO4·5H2O =250г/моль Мэкв (СuSO4·5H2O) = М СuSO4·5H2O/ 1·2 =250г/моль/2 = 125г/моль
3). Находим массу СuSO4·5H2O, необходимую для приготовления
раствора.
m (СuSO4·5H2O.)= n· Mэкв =0,04·125 = 5г.
Ответ:
Для приготовления 200 мл 0,2N раствора CuSO4 необходимо взвесить на аналитических весах 5 г СuSO4·5H2O , перенести навеску в мерную колбу на 200 мл и довести объем водой до метки.
Задача 7. Приготовьте 50 мл 0,025 N раствора NaOH разбавлением 1 N раствора NaOH.
| Дано: | Решение Определяем объем исходного 1N раствора NaOH по формуле
тогда
|
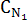 (NaOH)=1 N (NaOH)=1 N
| |
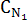 (NaOH)=0,025 N (NaOH)=0,025 N
| |
| V2(NaOH)=50 мл | |
| Найти: | |
| V1(NaOH)= ? |
Ответ: Для того, что бы приготовить 50 мл 0,025N раствор NaOH из 1N, нужно с помощью пипетки отобрать 1,3 мл 1N раствора NaOH, перенести в мерную колбу объемом 50 мл и довести до метки водой.
Задача 8. Определите эквивалентную концентрацию раствора сульфата алюминия (нормальность раствора), если 250 мл раствора содержит 27,36 г соли.
Решение:
1. Определим массу соли, содержащейся в 1 литре раствора нитрата калия. m(KNO3) = 27,36 · 4 = 109,44 г.
2. Mэкв( Al2(SO4)3 =
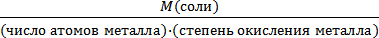
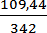 = = 0,32 моль
= = 0,32 моль
3. Определяем число моль-эквивалентов, содержащихся в 27,36 г сульфата алюминия:
nэкв(Al2(SO4)3) = 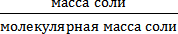 =
= 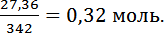
4. Концентрация раствора сэкв (Al2(SO4)3 = 0,32 моль/л или это 0,32 N. Ответ: Концентрация раствора Al2(SO4)3 0,32N
Вычислите массу глюкозы, необходимую для приготовления 0,2 моляльного раствора, содержащего 300 г воды.
Решение
Молярная масса глюкозы составляет 180 г/моль. Следовательно, растворив 180 г глюкозы в 1000 г воды, мы получили бы одномолярный раствор. Для приготовления 0,2 моляльного раствора, содержащего 300 г воды потребуется взять глюкозы :
m (глюкозы) = 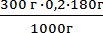 = 10,8 г глюкозы или можно составить пропорцию и решить её:
= 10,8 г глюкозы или можно составить пропорцию и решить её:
на 1000 г воды в 0,2 молярном растворе приходится (0,2∙ 180) г глюкозы, на 300 г воды в 0,2 молярном растворе приходится (х) г глюкозы
Х = m(глюкозы) = 10,8 г.
Ответ: Для приготовления 0,2 моляльного раствора необходимо 10,8г глюкозы растворить в 300 мл воды.
Задача 10. Рассчитайте мольную долю йода в растворе, содержащем 20 г йода в 500 г ССl4.
Решение
1. Определим число молей каждого компонента:
Na = 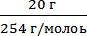 = 0,079 моль; Nb =
= 0,079 моль; Nb = 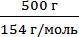 = 3,25 моль
= 3,25 моль
2. Находим мольную долю йода в растворе:
N(I2) = 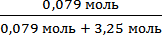 = 0,024
= 0,024
Мольная доля ССl4 равна : 1-0,024 = 0,976. Ответ: Мольная доля йода в растворе равна 0,024.
|
из
5.00
|
Обсуждение в статье: Решение задач на приготовление растворов с молярной и нормальной концентрацией. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы


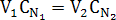
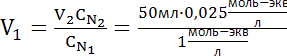 = 1,3 мл.
= 1,3 мл.