 |
Главная |
Лекция 1. Возникновение науки об атоме
|
из
5.00
|
Исторический процесс возникновения научных достижений - предвестников атомной науки и техники. Понятие атома. Строение атома. Открытие явления радиоактивности, ядерной реакции, протона, электрона, нейтрона, позитрона, дейтерия. Первый искусственный радиоактивный изотоп.
Непосредственными предшественниками атомистов были Эмпедокл (490-430 до н. э.) и Анаксагор (500-428 до н. э.), они выдвинули концепцию элементов, из которых построена Вселенная.
Философы Левкипп и его ученик Демокрит (460-370 до н. э.) стали основателями атомистической теории. По учению Левкиппа материя состоит из отдельных частиц – атомов, находящихся в пустом пространстве, и слишком мелких, чтобы их можно было увидеть в отдельности. Атомы непрерывно движутся в пространстве и воздействуют друг на друга при помощи толчков и давления.
Естественно-научное мировоззрение древних получило свое развитие в трудах знаменитого философа того времени Аристотеля (384-322 до н. э.). Аристотель считал, что все космические тела состоят из эфира, основного элемента природы, в котором изначально заложено совершенное движение по кругу.
В своей работе «Физика» Аристотель подробно разобрал взгляды своих предшественников – Анаксагора, Левкиппа, Демокрита и др. Он резко критиковал воззрения атомистов, признающих существование бесчисленного множества атомов и миров. По Аристотелю реальный мир конечен, ограничен и построен из «конечного числа» элементов. Понятие пустоты по Аристотелю противоречит действительности. Бесконечное разреженное пустое пространство ведет к бесконечному движению, а это, по мнению Аристотеля, невозможно.
Учение Аристотеля в средние века надолго задержало развитие атомистических воззрений. И все же учение об атомах, атомистика, пройдя через многие века, выдержало ожесточенную борьбу и дошло до наших дней с более глубокими представлениями об атоме, полученными в результате огромного числа физико-химических экспериментов и исследований по физике атома.
В XVIII и XIX вв. классическая физика вступила в период, когда многие ее положения стали подвергаться серьезному переосмыслению. В 1746 г. М. В. Ломоносов (1711-1765) писал: «Мы живем в такое время, в которое науки после своего возобновления в Европе возрастают и к совершенству приходят».
В химических работах Ломоносова важную роль играет атомистика, она – краеугольный камень его научного мышления. Ломоносов дал свою формулировку принципа сохранения материи и движения: «...все перемены, в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимается, столько присовокупится к другому... Сей всеобщий естественный закон простирается и в самые правила движения, ибо тело, движущее своею силою другое, столько же оныя у себя теряет, сколько сообщает другому, которое от него движение получает...»
Атомно-молекулярное учение о материи лежало в основе многих физических и химических исследований на всем протяжении истории науки. Первым действительно научным обоснованием атомистической теории, убедительно продемонстрировавшим рациональность и простоту гипотезы о том, что всякий химический элемент состоит из мельчайших частиц, явилась работа английского школьного учителя математики Дж.Дальтона (1766–1844), статья которого, посвященная этой проблеме, появилась в 1803.
Дальтон изучал свойства газов, в частности отношения объемов газов, вступавших в реакцию образования химического соединения, например, при образовании воды из водорода и кислорода. Он установил, что отношения прореагировавших количеств водорода и кислорода всегда представляют собой отношения небольших целых чисел. Так, при образовании воды (H2O) в реакцию с 16 г кислорода вступают 2,016 г газообразного водорода, а при образовании пероксида водорода (H2O2) с 2,016 г водорода соединяются 32 г газообразного кислорода. Массы кислорода, реагирующие с одной и той же массой водорода при образовании этих двух соединений, соотносятся между собой как небольшие числа:
16:32 = 1:2.
На основе подобных результатов Дальтон сформулировал свой «закон кратных отношений». Согласно этому закону, если два элемента соединяются в разных пропорциях, образуя разные соединения, то массы одного из элементов, соединяющиеся с одним и тем же количеством второго элемента, соотносятся как небольшие целые числа. По второму закону Дальтона, «закону постоянных отношений», в любом химическом соединении соотношение масс входящих в него элементов всегда одно и то же. Большое количество экспериментальных данных, относящихся не только к газам, но также и к жидкостям и твердым соединениям, собрал Й.Берцелиус (1779–1848), который провел точные измерения реагирующих масс элементов для многих соединений. Его данные подтвердили сформулированные Дальтоном законы и убедительно продемонстрировали наличие у каждого элемента наименьшей единицы массы.
Хотя законы Дальтона лежат в основе всей химии, ими не определяются фактические размеры и массы атомов. Они ничего не говорят о числе атомов, содержащихся в определенной массе элемента или соединения. Молекулы простых веществ слишком малы, чтобы их можно было взвесить по отдельности, поэтому для определения масс атомов и молекул приходится прибегать к косвенным методам.
В 1858 году немецкий стеклодув и владелец кустарной мастерской Генрих Гейсслер (1815-1879) изготовил стеклянную трубку с разрежённым газом, в которую были впаяны два электрода (так называемая гейсслерова трубка).
Простейший аппарат, в котором они наблюдались, представлял собой герметичную стеклянную трубку, заполненную разреженным газом, в которую с двух сторон было впаяно по электроду: с одной стороны катод, подключавшийся к отрицательному полюсу электрической батареи; с другой — анод, подключавшийся к положительному полюсу. При подаче на катодно-анодную пару высокого напряжения разреженный газ в трубке начинал светиться, причем при низких напряжениях свечение наблюдалось лишь в области катода, а при повышении напряжения — внутри всей трубки; однако при откачивании газа из трубки, начиная с какого-то момента, свечение исчезало уже в области катода, сохраняясь около анода. Это свечение ученые и приписали катодным лучам.
Примерно в середине XIX в. газовыми разрядами заинтересовался немецкий физик Юлиус Плюккер Он установил, что проводимость газа зависит от его плотности в трубке: она возрастает, когда часть газа откачана. При этом оказалось, что каждый газ светится своим характерным цветом. Так Плюккер в 1858 г. изобрёл светящиеся трубки. Теперь они широко используются в рекламе и различных шоу.
Когда разрежение в трубке увеличивается, вблизи катода появляется тёмное пространство — «катодное пятно», которое при дальнейшем откачивании газа расширяется и затем заполняет всю трубку. Тогда она перестаёт светиться. Исследования Плюккера (1859 г.) показали, что это тёмное пространство пронизывают какие-то невидимые для глаза «лучи», позднее получившие название «катодных лучей».
В 1895 году немецкий физик Вильгельм Конрад Рентген, работая с катодными лучами обнаружил, что при их столкновении со стеклом трубки возникает какое-то излучение, способное проникать сквозь материальные преграды. Тщательное исследование показало Рентгену, «что черный картон, не прозрачный ни для видимых и ультрафиолетовых лучей солнца, ни для лучей электрической дуги, пронизывается каким-то агентом, вызывающим энергичную флюоресценцию». Рентген исследовал проникающую способность этого «агента», который он для краткости назвал «Х-лучи», для различных веществ. Он обнаружил, что лучи свободно проходят через бумагу, дерево, эбонит, тонкие слои металла, но сильно задерживаются свинцом. Затем он описывает сенсационный опыт: «Если держать между разрядной трубкой и экраном руку, то видны темные тени костей в слабых очертаниях тени самой руки». Это было первое рентгеноскопическое исследование человеческого тела.
Воодушевлённые успехом физики стали повсюду искать рентгеновские лучи. Французский физик Антуан Анри Беккерель заметил, что сульфат урана, выставленный на свет, затем начинал светиться в темноте. Беккерель решил выяснить, не излучает ли это соединение и «Х-лучи»: оказалось, что дело обстоит именно так.
В ходе дальнейших исследований, в 1896 году, Беккерель обнаружил, что сульфат урана испускает невидимые, похожие на рентгеновские лучи постоянно, вне зависимости от того, выставляют его на солнечный свет или нет. Он обратил внимание на то, что эти лучи заставляют чернеть фотопластинку даже в том случае, если она заворачивалась в чёрную бумагу. Беккерель назвал это явление радиацией.
В 1897 году состоялось открытие электрона.
К концу 1880-х годов дискуссия о природе катодных лучей приняла острый полемический характер. Подавляющее большинство видных ученых немецкой школы придерживалось мнения, что катодные лучи представляют собой, подобно свету, волновые возмущения невидимого эфира. В Англии же придерживались мнения, что катодные лучи состоят из ионизированных молекул или атомов самого газа. Наконец в 1897 году молодой английский физик Дж. Дж. Томсон положил конец этим спорам раз и навсегда, а заодно прославился в веках как первооткрыватель электрона. В своем опыте Томсон использовал усовершенствованную катодно-лучевую трубку, конструкция которой была дополнена электрическими катушками, создававшими внутри трубки магнитное поле, и набором параллельных электрических конденсаторных пластин, создававших внутри трубки электрическое поле. Благодаря этому появилась возможность исследовать поведение катодных лучей под воздействием и магнитного, и электрического поля.
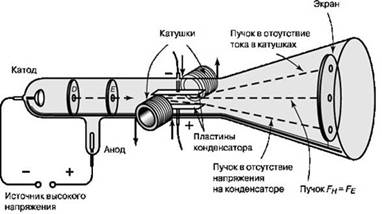
Используя трубку новой конструкции, Томсон последовательно показал, что: (1) катодные лучи отклоняются в магнитном поле в отсутствие электрического; (2) катодные лучи отклоняются в электрическом поле в отсутствие магнитного; и (3) при одновременном действии электрического и магнитного полей сбалансированной интенсивности, ориентированных в направлениях, вызывающих по отдельности отклонения в противоположные стороны, катодные лучи распространяются прямолинейно, то есть действие двух полей взаимно уравновешивается.
Томсон выяснил, что соотношение между электрическим и магнитным полями, при котором их действие уравновешивается, зависит от скорости, с которой движутся частицы. Проведя ряд измерений, Томсон смог определить скорость движения катодных лучей. Оказалось, что они движутся значительно медленнее скорости света, из чего следовало, что катодные лучи могут быть только частицами, поскольку любое электромагнитное излучение, включая сам свет, распространяется со скоростью света. Эти неизвестные частицы. Томсон назвал «корпускулами», но вскоре они стали называться «электронами».
В 1898 году французский физик польского происхождения Мария Склодовская-Кюри совместно со своим мужем Пьером Кюри доказала, что источником радиации был именно атом урана, то есть любое соединение урана испускает излучение. Мадам Кюри назвала от-крытое ей свойство урана радиоактивностью. Чуть позже выяснилось, что открытый Берцелиусом в 1829 году торий также радиоактивен.
Что представляла собой испускаемая этими элементами радиация? Почти сразу учёные установили, что это излучение неоднородно по составу. В 1899 году Беккерель и другие показали, что под воздействием магнита часть излучения отклоняется в сторону, тогда как другая часть излучения распространяется по прямой линии. Кроме того, было установлено, что отклоняющиеся в магнитном поле лучи делятся на два потока в электрическом поле, т.е. представляет собой положительно и отрицательно заряженное излучение. Уроженец Новой Зеландии, английский физик Эрнест Резерфорд назвал первый вид радиации «альфа-лучами», а второй «бета-лучами». Не отклоняющееся в магнитном поле излучение вскоре назвали «гамма-лучами». Чуть позже выяснилось, что гамма-лучи подобны обычному свету, но их волны ко-роче рентгеновских лучей; Резерфорд в 1900 году установил, что бета-лучи – это просто потоки электронов; в 1906 году он же показал, что альфа-лучи – это потоки ядер гелия без электронных оболочек и начал активно исследовать эти частицы.
В 1904 г. появилась публикация о строении атома, принадлежащая Томсону. В атоме. Томсона положительное электричество «размазано» по сфере, в которую вкраплены, как изюм в пудинг, электроны. В простейшем атоме водорода электрон находится в центре положительно заряженной сферы. При смещении из центра на электрон действует квазиупругая сила электростатического притяжения, под действием которой электрон совершает колебания. Частота этих колебаний определяется радиусом сферы, зарядом и массой электрона. В многоэлектронных атомах электроны располагаются по устойчивым конфигурациям, рассчитанным Томсоном. Томсон считал каждую такую конфигурацию определяющей химические свойства атомов.
Под руководством Томсона молодой физик Эрнест Резерфорд проводил исследования рентгеновских лучей с проверки своего предположения о связи между рентгеновскими и беккерелиевыми лучами. Эта мысль пришла в голову Резерфорду по очень простой причине: и те и другие «лучи» производили ионизацию воздуха. Целый год работы показал, что сходства между рентгеновскими и беккерелиевыми лучами не существует. Резерфорд опроверг предположение Беккереля о том, что «урановое излучение» обнаруживает свойства света: на самом деле оно не подчинялось законам световой оптики.
Но наиболее важным результатом Резерфорда было открытие альфа-частиц в составе излучения, испускаемого ураном. Резерфорд поместил урановый источник в сильное магнитное поле и разделил излучение на три различных его вида. Таким образом был открыт состав радиоактивности: альфа- и бета-частицы и гамма-излучение.
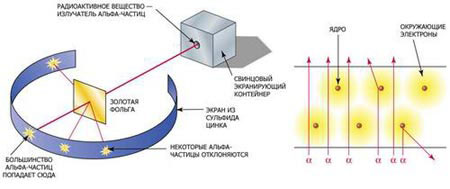
Суть опыта Резерфорда состояла в следующем. От радиоактивного источника, заключенного в свинцовый контейнер, α-частицы
направлялись на тонкую золотую фольгу. Рассеянные частицы попадали на экран, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Вспышки на экране наблюдались глазом с помощью микроскопа. Наблюдения рассеянных α-частиц в опыте Резерфорда можно было проводить под различными углами φ к первоначальному направлению пучка. Было обнаружено, что большинство α-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°. Столь малое количество отклонившихся частиц привело Резерфорда к мысли, что атом почти пустой, а весь его положительный заряд сконцентрирован в малом объеме – ядре.
Получив альфа-частицы, Резерфорд тотчас же сделал гениальное заключение, что именно они представляют собой мощный инструмент для проникновения в глубь атома. В последующих работах Резерфорд широко использовал альфа-частицы в качестве снарядов, проникающих в атомное ядро. В ходе этих экспериментов Резерфорд опроверг атомную модель Томсона.
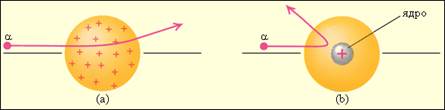
Рассеяние α-частицы в атоме Томсона (a) и в атоме Резерфорда (b).
Рассеяние отдельных α-частиц на большие углы Резерфорд объяснил тем, что положительный заряд в атоме не распределен равномерно в шаре радиусом 10-10м, как предполагали ранее, а сосредоточен в центральной части атома (атомном ядре) в области значительно меньших размеров. Расчеты Резерфорда показали, что для объяснения опытов по рассеянию α-частиц нужно принять радиус атомного ядра равным примерно 10-15м.
Резерфорд предположил, что атом устроен подобно планетарной системе. Как вокруг Солнца на больших расстояниях от него обращаются планеты, так электроны в атоме обращаются вокруг атомного ядра. Радиус круговой орбиты самого далекого от ядра электрона и есть радиус атома. Такая модель атома была названа планетарной моделью.
В 1913 г. Э. Резерфорд выдвинул гипотезу, что одной из частиц , входящих в ядро атома любого химического элемента должно быть ядро атома водорода, т.к. было известно, что массы атомов химических элементов превышают массу атома водорода в целое число раз.
Резерфорд поставил опыт по исследованию взаимодействия альфа-частиц с ядрами атома азота. В результате взаимодействия из ядра атома азота вылетала частица, которую Резерфорд назвал протоном и предположил, что это ядро атома водорода.
Позднее с помощью камеры Вильсона было доказано, что эта частица действительно является ядром атома водорода.
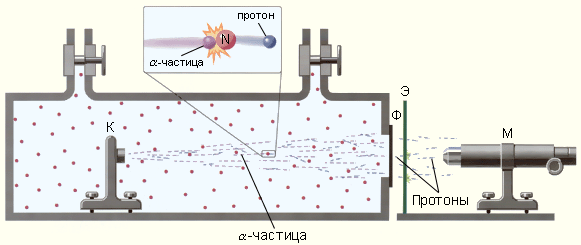
Схема опытов Резерфорда по обнаружению протонов в продуктах расщепления ядер. К – свинцовый контейнер с радиоактивным источником α-частиц, Ф – металлическая фольга, Э – экран, покрытый сульфидом цинка, М – микроскоп.
В 1920 г. Резерфорд высказал предположение, что должна существовать частица массой, равной массе протона, но не имеющая электрического заряда. Однако, обнаружить такую частицу Резерфорду не удалось.
Английский ученый Дж. Чедвик выдвинул гипотезу о существовании нейтральных частиц, близких по размерам и массе к протонам. Эти частицы он назвал нейтронами.

Схема установки для обнаружения нейтрона.
В результате исследования космических лучей в 1932 году была открыта еще одна новая частица - позитрон. По сути дела, это открытие было предсказано физиками-теоретиками. Занимаясь математическими расчетами свойств элементарных частиц, П. Дирак пришел к выводу, что у каждой частицы должен быть свой антипод, или античастица. Таким образом, должен существовать антиэлектрон, тот же электрон, но с положительным зарядом, и антипротон - отрицательно заряженная частица, в остальном полностью эквивалентная протону.
Гипотеза Дирака, которую он сформулировал в 1930 году, вначале оставалась без особого внимания ученого мира. Однако два года спустя и в самом деле появилось сообщение о реально зафиксированном антиэлектроне. В ходе этого эксперимента американцы К. Андерсон и Р. Милликен работали над выяснением природы космических лучей: что это - волны или частицы?
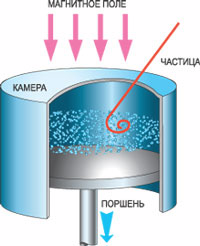
К тому времени большинство ученых склонялись к мнению Комптона, утверждавшего, что это поток частиц. Но Милликен упорно не соглашался с этой идеей, считая, что еще ничего не доказано. Вместе с Андерсоном они с помощью камеры Вильсона решили проверить, отклоняются ли космические лучи в сильном магнитном поле. Максимально замедлив поток лучей с помощью большой массы свинца, они обнаружили, что траектория лучей в камере искривляется. Но при этом выяснился еще один странный момент. При прохождении через свинец космические лучи выбили из него непонятные частицы. Причем траектория такой частицы напоминала след от электрона, но отклонялась в противоположном направлении! У нее была та же масса, но противоположный по знаку заряд. Это и был предсказанный Дираком антиэлектрон, который по предложению Андерсона окрестили позитроном.
Почти сразу вслед за открытием позитрона супруги Жолио-Кюри, подошедшие к позитрону с другой стороны, сделали важное открытие. Бомбардируя алюминий альфа-частицами, они обнаружили, что при этом из мишени выбиваются не только протоны, но и позитроны. Со временем эта эмиссия затухала. Из этих результатов ученые сделали вывод, что в мишени образовалось новое радиоактивное вещество. Таким образом был получен первый в мире искусственный изотоп фосфор-30.
1932 г. физики назвали «годом чудес». Одно за другим следовали выдающиеся открытия в области физики: были открыты нейтрон и позитрон, разработана протонно-нейтронная теория строения ядер и релятивистская квантовая механика, построен первый циклотрон и изобретен электронный микроскоп, проведена первая реакция ядерного синтеза, экспериментально измерена скорость движения молекул. В этом же году был открыт и второй изотоп водорода, названный дейтерием.
|
из
5.00
|
Обсуждение в статье: Лекция 1. Возникновение науки об атоме |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

