 |
Главная |
Возбужденное состояние атома
|
из
5.00
|
Возбужденное состояние атома - энергетически нестабильное состояние, в которое атом переходит, получая энергию извне. В возбужденном состоянии атом может пребывать лишь короткое время. Возбужденный атом, отдавая энергию, возвращается в основное состояние.
Взаимодействие, донорно-акцепторное иначе донорно-акцепторная связь; координационная связь — взаимодействие, основанное на переносе заряда или передаче пары электронов от донора к акцептору.
Донорно-акцептороное взаимодействие включает случаи переноса заряда между молекулами донора и акцептора без образования между ними химической связи и передачи неподеленной электронной пары от донора к акцептору, приводящей к образованию связи.
В первом случае речь может идти, например об органических донорах, в частности — -донорах, например, тетракис(диметиламино)этилене (ТДАЭ), других ненасыщенных аминосоединениях, металлоценах и т. п., и органических акцепторах, таких как фуллерены или хинодиметаны с акцепторными заместителями. При взаимодействии таких соединений образуется комплекс с переносом заряда, в котором отрицательно заряженный акцептор и положительно заряженный донор взаимодействуют электростатически. Важную роль играют такие системы, где в основном электронном состоянии перенос заряда только частичный, тогда как состояние с практически полным переносом заряда может быть получено при фотовозбуждении. Подобные системы, донорно-акцепторные диады, а также триады, в которых между донором и акцептором внедрена мостиковая группа, способствующая повышению времени жизни состояния с переносом заряда, могут использоваться для создания устройств для преобразования солнечной энергии (см. например, искусственный фотосинтез). Вообще, перенос заряда в различных его формах и проявлениях играет ключевую роль во многих биологических процессах.
Во втором случае донор и акцептор представляют собой, соответственно, кислоту и основание Льюиса. Если обычная ковалентная связь между двумя атомами обусловлена образованием общей пары электронов — по одному от каждого атома, то донорно-акцепторная связь осуществляется за счет пары электронов донора и свободной (незаполненной) орбитали акцептора. Этот вид донорно-акцепторного взаимодействия — основной способ образования комплексных соединений (рис.). Подобное взаимодействие отвечает за многие кислотно-основные превращения, связанные с переносом иона водорода (акцептора), а также образование супрамолекулярных наноструктур. 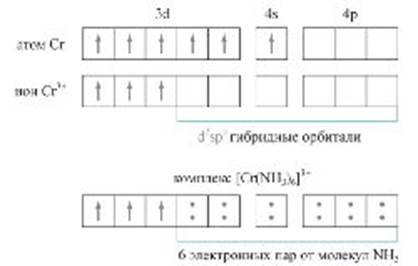
Направленность ковалентной связи является результатом стремления атомов к образованию наиболее прочной связи за счет возможно большей электронной плотности между ядрами. Это достигается при такой пространственной направленности перекрывания электронных облаков, которая совпадает с их собственной. Исключение составляют s-электронные облака, поскольку их сферическая форма делает все направления равноценными. Для p- и d-электронных облаков перекрывание осуществляется вдоль оси, по которой они вытянуты, а образующаяся при этом связь называется σ-связью. σ-Связь имеет осевую симметрию, и оба атома могут вращаться вдоль линии связи, т.е. той воображаемой линии, которая проходит через ядра химически связанных атомов.
После образования между двумя атомами σ-связи для остальных электронных облаков той же формы и с тем же главным квантовым числом * остается только возможность бокового перекрывания по обе стороны от линии связи. В результате образуется π-связь. Она менее прочна, чем σ-связь: перекрывание происходит диффузными боковыми частями орбиталей. Каждая кратная связь (например, двойная или тройная) всегда содержит только одну σ-связь. Число σ-связей, которые образует центральный атом в сложных молекулах или ионах, определяет для него значение координационного числа. Например, в молекуле NH3 и ионе NH4+ для атома азота оно равно трем и четырем. Образование σ-связей фиксирует пространственное положение атомов относительно друг друга, поэтому число σ-связей и углы между линиями связи, которые называются валентными углами, определяют пространственную геометрическую конфигурацию молекул.
При оценке степени перекрывания электронных облаков следует учитывать знаки волновых функций * электронов. При перекрывании облаков с одинаковыми знаками волновых функций электронная плотность в пространстве между ядрами возрастает. В этом случае происходит положительное перекрывание, приводящее к взаимному притяжению ядер. Если знаки волновых функций противоположны, то плотность электронного облака уменьшается (отрицательное перекрывание), что приводит к взаимному отталкиванию ядер.
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул. В газообразном состоянии NaCl имеет дипольный момент ~3∙10–29 Кл∙м, что соответствует смещению 0,8 заряда электрона на длину связи 0,236 нм от Na к Cl, т. е. Na0,8+Cl0,8–.
Водородная связь
Помимо различных гетерополярных и го-меополярных связей, существует еще один особый вид связи, который в последние два десятилетия привлекает все большее внимание химиков. Это так называемая водородная связь. Оказалось, что атом водорода может образовывать связь между двумя электроотрицательными атомами (F, О, N, реже Сl и S). Известны случаи, когда эту связь образует водородный атом, связанный с атомом углерода в соединениях типа НСХ3, где X — электроотрицательный атом или группа (например, в HCN, фторуглеводородах). Хотя в настоящее время природа водородной связи еще до конца не выяснена, одна.ко определен-ное представление о ней уже можно составить.
Водородная связь образуется между электроотрицательными атомами, из которых хотя бы один имеет свободную электронную пару, например:
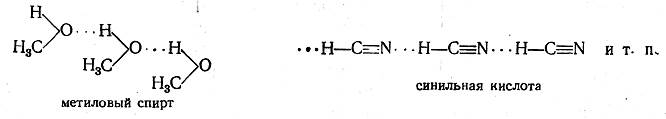
(водородная связь обозначается пунктиром из трех точек).
Таким образом, водородная связь по своему характеру является, по-видимому, электростатической; она образуется вследствие притяжения ковалентно связанного протона свободными электронами атома другой молекулы. При этом протон находится не посредине между связываемыми им атомами (даже если они одинаковы), а ближе к тому атому, с которым он связан ковалентно. Так, в случае воды
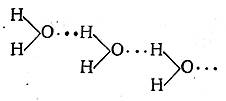
одно расстояние О—Н равно 0,99 А, а другое 1,76 А.
Вопрос о том, находится ли водород в фиксированном положении или он совершает колебания между двумя положениями равновесия, в общем случае еще неясен, хотя исследование хингидрона методом меченых атомов свидетельствует о фиксированном положении водорода водородной связи в этом соединении.
Энергия водородной связи мала; она имеет порядок 5—10 ккал/моль, в то время как, например, энергия нормальной связи О—Н равна 109 ккал/моль, а связи Н—F 148 ккал/моль. При плавлении льда рвется около 15% всех водородных связей, при нагревании воды до 40° С рвется около половины водородных связей. В парах воды водородных связей практически нет. При плавлении спиртов водородные связи почти не разрываются, однако они полностью рвутся при их испарении. В кар-боновых кислотах водородные связи не разрываются и при испарении, благодаря чему, например, муравьиная кислота и в паровой фазе существует в виде димера
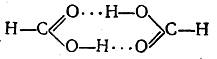
Однако и в этом случае энергия водородной связи составляет всего около 7 ккал/моль.
Наличие водородных связей оказывает существенное влияние на физические свойства соединений. Именно водородные связи обусловливают ассоциацию воды и спиртов, а следовательно, и аномально высокие точки их кипения сравнительно, например, с сероводородом и меркаптанами. Способность спиртов, аминов, карбоновых кислот, амидов растворяться в воде вызвана образованием водородных связей с молекулами воды. Некоторые соединения, подобно енольной форме ацетоуксус-ного эфира, о-нитрофенолу и др., образуют внутримолекулярные водородные связи с замыканием цикла. Изучение водородных связей должно пролить дополнительный свет на строение и свойства многих органических веществ.
Фторид бериллия Be F(2) – стекловидный материал. Его структура состоит из неупорядоченной сетки из атомов бериллия (КЧ 4), связанных мостиками из атомов фтора, и похожа на структуру кварцевого стекла. Выше 270° С фторид бериллия самопроизвольно кристаллизуется. Подобно кварцу, он существует в низкотемпературной a-форме, которая при 227° С переходит в b-форму. Кроме того, можно получить формы кристобалита и тридимита. Структурное сходство между BeF2 и SiO2 распространяется также на фторобериллаты (которые образуются при взаимодействии фторида бериллия с фторидами щелочных элементов и аммония) и силикаты. Фторид бериллия – компонент фторобериллатных стекол и солевой смеси, используемой в ядерных реакторах на расплавленных солях.
Молекула воды состоит из двух атомов водорода (1H) и одного атома кислорода (16O). Оказывается, что едва ли не все многообразие свойств воды и необычность их проявления определяется, в конечном счете, физической природой этих атомов, способом их объединения в молекулу и группировкой образовавшихся молекул.В отдельно рассматриваемой молекуле воды атомы водорода и кислорода, точнее их ядра, расположены так, что образуют равнобедренный треугольник. В вершине его - сравнительно крупное кислородное ядро, в углах, прилегающих к основанию, - по одному ядру водорода.В соответствии с электронным строением атомов водорода и кислорода молекула воды располагает пятью электронными парами. Они образуют электронное облако. Облако неоднородно - в нем можно различить отдельные сгущения и разрежения. У кислородного ядра создается избыток электронной плотности. Внутренняя электронная пара кислорода равномерно обрамляет ядро: схематически она представлена окружностью с центром - ядром O2-. Четыре внешних электрона группируются в две электронные пары, тяготеющие к ядру, но частично не скомпенсированные. Схематически суммарные электронные орбитали этих пар показаны в виде эллипсов, вытянутых от общего центра - ядра O2-. Каждый из оставшихся двух электронов кислорода образует пару с одним электроном водорода. Эти пары также тяготеют к кислородному ядру. Поэтому водородные ядра - протоны - оказываются несколько оголенными, и здесь наблюдается недостаток электронной плотности.Таким образом, в молекуле воды различают четыре полюса зарядов: два отрицательных (избыток электронной плотности в области кислородного ядра) и два положительных (недостаток электронной плотности у двух водородных ядер). Для большей наглядности можно представить, что полюса занимают вершины деформированного тетраэдра, в центре которого находится ядро кислорода
|
из
5.00
|
Обсуждение в статье: Возбужденное состояние атома |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

