 |
Главная |
Гальванические элементы
|
из
5.00
|
Гальванический элемент - устройство, в котором энергия самопроизволь-ной окислительно-восстановительной реакции превращается непосредственно в электрическую, т.е. гальванические элементы являются источником постоянного электрического тока.
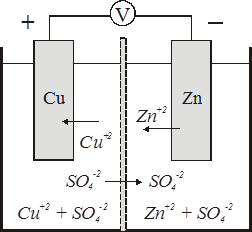
Простейшим гальваническим элементом является элемент Даниэля-Якоби (рис. 3), состоящий из цинкового и медного электродов, погруженных в растворы сульфатов цинка и меди.
Растворы разделены полупроницаемой мембраной. На цинковом электроде окисляется цинк
Zn = Zn2 + 2  (анодный процесс).
(анодный процесс).
|
Р и с. 3. Схема гальванического элемента Даниэля-Якоби
Электроны окисленных атомов по внешней цепи поступают на медный электрод, где ионы меди восстанавливаются из раствора
Сu2+ + 2 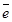 = Сu (катодный процесс).
= Сu (катодный процесс).
Одновременно часть ионов 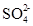 для выравнивания отрицательных потенциалов катодного и анодного пространств переходит через пористую перегородку в сосуд с раствором сульфата цинка. Суммарное уравнение процесса
для выравнивания отрицательных потенциалов катодного и анодного пространств переходит через пористую перегородку в сосуд с раствором сульфата цинка. Суммарное уравнение процесса
Zn + CuSO4 = ZnSO4 + Сu.
Электроды называются в соответствии с происходящими на них процессами. Электрод, на котором происходит окисление, называется анодом, электрод, на котором происходит восстановление, называется катодом. Элек-трическая схема рассмотренного гальванического элемента записывается следую-щим образом
A(-)Zn|Zn2+‖Cu2+|Cu(+)K
Одинарная вертикальная черта означает границу раздела между электродом и электролитом, а двойная черта означает границу между проводниками второго рода, т.е. электролитами. На каждом электроде возникает собственный электрод-ный потенциал. Разность этих потенциалов называется напряжением гальва-нического элемента Δφ (электродвижущей силой или ЭДС) и всегда является поло-жительной величиной, так как определяется вычитанием более отрицательного потенциала из более положительного.
Так, для элемента Даниэля-Якоби
Δφ = φк – φа = φCu – φZn = 0,34 – (-0,76) = 1,1 B.
Пример 1. Определить ЭДС гальванического элемента e, состоящего из магниевого и медного электродов, опущенных соответственно в одномолярные растворы собственных солей.
Решение. ЭДС гальванического элемента определяется как разность нор-мальных или стандартных потенциалов катода и анода, взятых из ряда напря-жений.
φ0Cu2+/Cu = 0,34 B; φ0Mg2+/Mg = - 2,38 B
Δφ = φк – φа = 0,34 – (-2,38) = 2, 72 B
Пример 2. Определить ЭДС гальванического элемента (Δφ), составленного из алюминиевой пластины, опущенной в 0,001 М раствор сульфата алюминия и медной пластины, опущенной в 0,1 М раствор сульфата меди.
Решение. Стандартные электродные потенциалы равны
φ0Cu2+/Cu = 0,34 B; φ0Al3+/Al = - 1,66 B
По формуле Нернста вычисляем электродные потенциалы с учетом концен-трации электролитов
φAl3+/Al = φ0Al/ Al3+ +  lg0,001 = -1,66 +
lg0,001 = -1,66 +  lg10-3 = -1,66 + (-3)×
lg10-3 = -1,66 + (-3)×  = -1,72 B;
= -1,72 B;
φCu2+/Cu = φ0Cu2+/Cu +  lg0,1 = 0,34 +
lg0,1 = 0,34 +  (-1) = 0,34 – 0,03 = 0,31 B.
(-1) = 0,34 – 0,03 = 0,31 B.
Отсюда, Δφ = φк – φа = 0,31 – (-1,72) = 2, 03 B.
Экспериментально наблюдаемая разность потенциалов всегда меньше теоретически вычисленной на величину, называемую разностью потенциалов поляризации. Чем больше сила тока гальванического элемента, тем меньше реальная разность потенциалов и тем ниже коэффициент полезного действия (КПД) элемента.
Поляризация электродов. Явление поляризации заключается в изменении электродных потенциалов анода и катода. Известно несколько причин поляризации.
Концентрационная поляризация возникает за счет изменения концентраций ионов в приповерхностном слое электрода. Так, в гальваническом элементе Даниэля-Якоби скорость растворения цинка существенно больше скорости диффузии его ионов в электролите, поэтому возникает повышенная, против рав-новесной, концентрация ионов цинка у анода. Это затрудняет дальнейшее раство-рение цинка, и его потенциал становится более положительным. На катоде скорость восстановления ионов меди больше скорости диффузии их к поверх-ности меди и концентрация ее ионов уменьшается против равновесной. Катодный потенциал становится более отрицательным. Поэтому и ЭДС, т.е. разность потен-циалов гальванического элемента, уменьшается. Концентрационную поляриза-цию можно уменьшить перемешиванием электролита, но целиком ее устранить нельзя.
В том случае, когда поляризация вызывается химической природой электрода, ее называют химической. Так, химическая («газовая») поляризация возникает на катоде гальванического элемента за счет разрядки ионов:
Н+ + 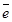 ® Н0; 2Н0 ® Н2.
® Н0; 2Н0 ® Н2.
Процесс идет в несколько стадий: разрядка ионов, адсорбция атомарного водорода металлом, рекомбинация в молекулы, десорбция и зарождение газового пузырька, его развитие и отрыв от поверхности электрода. В результате поверхность электрода покрывается пузырьками водорода, и потенциал водорода изменяется. Газовую поляризацию можно уменьшить введением веществ – «деполяризаторов», которые реагируют с газами и переводят их в молекулы воды. В качестве деполяризаторов на катоде используют сильные окислители (К2Cr2O7, KMnO4, MnO2), окисляющие водород в момент его разрядки.
241. Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом - анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и аноде, а также рассчитайте ЭДС элементов.
242. Какой должна быть концентрация соли цинка в растворе, чтобы элемент (-) Mg|Mg2+‖Zn2+|Zn(+) при [Mg2+] = 1 моль/л вырабатывал ЭДС = 1,60 В.
243. Какие процессы происходят на электродах гальванического элемента, состоящего из медной и никелевой пластинок, погруженных в одномолярные растворы СuSO4 и NiSO4? Рассчитайте ЭДС элемента.
244. Какие химические процессы протекают на электродах при зарядке и разрядке железоникелевого аккумулятора?
245. Железная и медная пластинки погружены в 0,001 М водные растворы своих солей. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента.
246. Марганцевый электрод в растворе его соли имеет потенциал -1,23 В. Вычислите концентрацию ионов Mn2+ в моль/л.
247. Составьте схему работы гальванического элемента, образованного железом и свинцом, погруженными в 0,001 М растворы их солей. Рассчитайте ЭДС этого элемента.
248. Составьте схему, напишите электронные уравнения электродных про-цессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией ионов [Pb2+] = [Mg2+] = 0,01 моль/л. Изменится ли ЭДС этого элемента, если концен-трацию каждого из ионов увеличить в одинаковое число раз?
249. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению
Ni + Pb(NO3)2 = Ni(NO3)2 + Pb.
Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если [Ni2+] = 0,01 моль/л, [Pb2+] = 0,0001 моль/л.
250. Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора?
251. Катодом гальванического элемента является свинец. Подберите металл для анода элемента. Составьте схему гальванического элемента, уравнения полуреакций анодного и катодного процессов, ионное и молекулярное уравнения реакции, происходящей при работе гальванического элемента.
252. В два сосуда с голубым раствором сульфата меди поместили: в первый цинковую пластинку, а во второй – серебряную. В каком сосуде цвет раствора постепенно пропадает? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
253. При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод – в 0,01 М растворе сульфата никеля.
254. Рассчитайте ЭДС элемента, образованного кадмиевым электродом, погруженным в 0,01 М раствор CdSO4, и медным электродом, погруженным в 1 М раствор CuSO4. Составьте схему, напишите уравнения анодного и катодного про-цессов, протекающих при работе этого элемента.
255. На основе какой из реакций может работать гальванический элемент:
Mg + ZnSO4 = MgSO4 + Zn;
MgCl2 + ZnSO4 = MgSO4 + ZnCl2.
Составьте схему гальванического элемента, уравнения полуреакций катодного и анодного процессов, ионные уравнения реакций.
256. Никелевый и кобальтовый электроды опущены соответственно в растворы Ni(NO3)2 и Co(NO3)2. В каком соотношении должна быть концентрация ионов этих металлов, чтобы потенциалы обоих электродов были одинаковыми?
257. Какие химические процессы протекают на электродах при зарядке и разрядке железоникелевого аккумулятора?
258. Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами: а) АgNO3; б) Zn(NO3)2; в) Pb(NO3)2? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
259. Составьте схемы двух гальванических элементов, в одном из которых медь была катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
260. Электродвижущая сила элемента, состоящего из медного и цинкового электродов, опущенных в одномолярные растворы CuSO4 и ZnSO4, равна 1,1 В. Рассчитайте, как изменится ЭДС, если взять 2 М раствор CuSO4 и 0,001 М раствор ZnSO4.
ЭЛЕКТРОЛИЗ
Электролизом называется окислительно-восстановительный процесс, про-текающий при прохождении электрического тока через расплав или раствор электролита. Ячейка для электролиза состоит из двух электродов и электролита между ними. Электрод, на котором идет восстановление, называется катодом и имеет отрицательный заряд. Другой электрод, на котором идет окисление, называется анодом – он заряжен положительно. Характер и течение электродных процессов при электролизе зависят от состава электролита, растворителя, материала электродов и режима электролиза (напряжение, плотность тока, температура).
Различают электролиз расплавов и растворов.
Электролиз расплава
Рассмотрим электродные реакции на примере электролиза расплава хлорида натрия. В расплаве этой соли имеются ионы Na+ и Cl-, которые при подключении источника тока движутся к противоположно заряженным электродам: ион Na+ - к отрицательно заряженному катоду, ион Cl- - к положительно заряженному аноду. На катоде восстанавливается ион натрия:
Na+ + 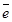 = Na,
= Na,
на аноде окисляется хлорид-ион:
2Cl- = Cl2 + 2 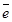 .
.
|
из
5.00
|
Обсуждение в статье: Гальванические элементы |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

