 |
Главная |
Хинолин (синтез Скраупа)
|
из
5.00
|

В 0,5 л колбу помещают 10,0 г нитробензола, 15,5 г анилина и 50,0 г глицерина. В смесь постепенно при сильном встряхивании вводят 12 мл серной кислоты (d = 1,84 г/мл). Затем колбу снабжают обратным холодильником и осторожно нагревают газовой горелкой до начала реакции. После этого через холодильник порциями по 0,5 – 1,0 мл вводят 12 мл серной кислоты, нагревая смесь после внесения каждой порции, и кипятят в течение 3 часов. К смеси добавляют небольшое количество воды и отгоняют непрореагировавший нитробензол с водяным паром. Содержимое колбы охлаждают и добавляют 40 %-й раствор гидроксида натрия до щелочной реакции по фенолфталеину. Суспензию хинолина и непрореагировавшего анилина подкисляют серной кислотой, охлаждают, и диазотируют концентрированным раствором нитрита натрия до положительной реакции на присутствие азотистой кислоты (около 2,5 г насыщенного раствора нитрита натрия). Реакционную смесь нагревают на водяной бане до прекращения выделения азота, доводят до щелочной реакции 40 %-м раствором гидроксида натрия и отгоняют хинолин с водяным паром. Дистиллят экстрагируют эфиром, эфирный раствор обезвоживают гидроксидом калия, отгоняют эфир на водяной бане и остаток перегоняют при пониженном давлении (10 мм рт. ст.)с дефлегматором, собирая фракцию с температурой кипения 105 – 110 °С. Выход 12,0 – 13,0 г (~55%).
Пояснения к синтезу
При повышенной температуре серная кислота дегидратирует глицерин, образуя непредельный спирт НОСН2СН=СНОН, который перегруппировывается в β-гидроксипропаналь НОСН2СН2СНО и вновь подвергается дегидратации, образуя акролеин СН2=СН-СНО.II
Акролеин, как и другие α,β-ненасыщенные альдегиды, вступает в реакции присоединения против правила Марковникова. Взаимодействуя с анилином, он образует 1-фениламинопропаналь I. Его аминогруппа активирует о-положение бензольного ядра по отношению к действию электрофильного атома углерода альдегидной группы. По отношению к бензольному ядру реакция образования промежуточного соединения II является электрофильным замещением. Под каталитическим и водоотнимающим действием серной кислоты II подвергается дегидратации, образуя III. Наконец, III окисляется до хинолина действием нитробензола, который в свою очередь восстанавливается до анилина, вновь вступает в реакцию с акролеином.
Фенилизоиндолизин
При взаимодействии α-пиколина с фенацилбромидом образуется 2-метил-1-фенацилпиридиний бромид, который при кипячении в воде в присутствии гидрокарбоната натрия превращается в фенилизоиндолизин:

2-Метил-1-фенацилпиридиний бромид. В трехгорлую колбу, снабженную обратным холодильником и мешалкой, вносят 9,3 мл (0,1 моль) α-пиколина и раствор 19,9 г (0,1 моль) фенацилбромида (лакриматор, работать под тягой!) в 20 мл ацетона. Смесь при перемешивании кипятят на водяной бане в течение 2-х часов, и выпавший при охлаждении осадок четвертичной соли отфильтровывают, дважды промывают ацетона и дважды – эфиром, порциями по 10 мл.
Выход 25,7 – 26,8 г (88 – 92 %), tпл 211 °С (с разложением).
Фенилизоиндолизин. Раствор 14,6 г (0,05 моль) 2-метил-1-фенацилпиридиний бромида в 250 мл воды кипятят при перемешивании в присутствии 6,3 г (0,075 моль) гидрокарбоната натрия 40 – 50 минут. Через 20 – 30 мин от начала кипения выпадает обильный белый осадок, который после окончания реакции и охлаждения реакционной смеси, отфильтровывают, трижды промывают ледяной водой, порциями по 20 мл и сушат при 100 °С.
Выход 8,8 – 9,0 г (91 – 93 %). Перекристаллизованный из спирта продукт имеет Тпл 210 – 211 °С.
Пояснения к синтезу
Пиридин сравнительно легко вступает в реакции электрофильного присоединения по атому азота. Бромированый ацетофенон на атоме углерода группы СН2 под электроноакцепторным действием соседнего атома брома и карбонильной группы несет существенный положительный заряд и проявляет свойства электрофила.
В силу электроноакцепторного влияния положительно заряженного азота 2-метил-1-фенацилпиридиний бромид является достаточно сильной СН-кислотой. Кислотный разрыв связи С-Н метильной группы происходит под действием гидрокарбоната натрия:
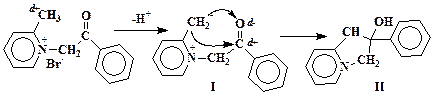
Разумеется, отрицательный заряд в значительной степени мигрирует с группы СН2 на атом азота, но структура I подчеркивает нуклеофильный характер образующегося соединения и демонстрирует суть последующей реакции циклизации с образованием спирта II, дегидратация которого дает конечный продукт – фенилизоиндолизин.
Фенотиазин
Фенотиазин получают нагреванием дифениламина с серой в присутствии небольшого количества йода в качестве катализатора:

Фенотиазин. Предварительно хорошо перемешанную смесь 8,4 г (0,05 моль) дифениламина, 3,2 г (0,1 моль) серы и 0,15 г йода нагревают в круглодонной колбе емкостью 100 мл при 190 – 200 °С в течение получаса на силиконовой бане или на сплаве Вуда. Горячий плав выливают в фарфоровую чашку и после охлаждения измельчают в ступке до порошкообразного состояния. Сырой продукт перекристаллизовывают из этанола, добавляя активированный уголь для удаления окрашенных примесей. На 1 г вещества идет 6 мл спирта. Фенотиазин кристаллизуется в виде желтых призм. Выход 8,5 – 9,0 г (86 – 91 %). Тпл 184 – 185 °С.
|
из
5.00
|
Обсуждение в статье: Хинолин (синтез Скраупа) |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

